Phản ứng thế của một số muối halide
Giải Hóa 10 Bài 21 - Kết nối tri thức: Nhóm halogen
Hoạt động trang 110 Hóa học 10: Phản ứng thế của một số muối halide
Chuẩn bị: 3 ống nghiệm, dung dịch NaBr, dung dịch NaI, nước Cl2, nước Br2 loãng.
Tiến hành:
- Lấy khoảng 2 mL dung dịch NaBr vào ống nghiệm (1), 2 mL dung dịch NaI vào mỗi ống nghiệm (2) và (3).
- Thêm vào ống nghiệm (1) và (2) vài giọt nước Cl2, thêm vào ống (3) vài giọt nước Br2, lắc đều các ống nghiệm.
Lưu ý: Cẩn thận không để nước Cl2, nước Br2 giây ra tay, quần áo.
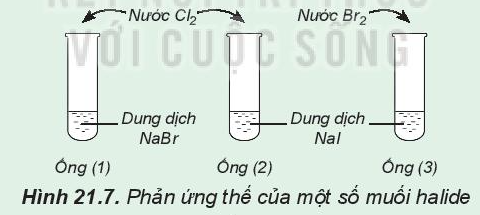
Quan sát hiện tượng và thực hiện yêu cầu sau:
1. Nhận xét sự thay đổi màu của dung dịch trong các ống nghiệm.
2. So sánh tính oxi hoá của Cl2, Br2, I2.
3. Hãy chọn một thuốc thử để chứng tỏ có sự tạo thành I2 khi cho nước chlorine (hoặc nước bromine) tác dụng với dung dịch sodium iodide.
Lời giải:
1. - Ống nghiệm (1): dung dịch ban đầu không màu dần chuyển sang màu vàng.
- Ống nghiệm (2): dung dịch ban đầu không màu dần chuyển thành dung dịch có màu vàng nâu và có chất rắn màu đen tím.
- Ống nghiệm (3): dung dịch NaI không màu, dung dịch Br2 có màu vàng nâu. Dung dịch chuyển từ không màu thành màu vàng nâu.
2. - Ống nghiệm (1) xảy ra phản ứng:
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 có thể oxi hóa ion Br- trong dung dịch NaBr thành Br2
⇒ Cl2 có tính oxi hóa mạnh hơn Br2 (1)
- Ống nghiệm (2) xảy ra phản ứng:
Cl2 + 2NaI → 2NaCl + I2
Cl2 có thể oxi hóa ion I- trong dung dịch NaI thành I2
⇒ Cl2 có tính oxi hóa mạnh hơn I2 (2)
- Ống nghiệm (3) xảy ra phản ứng:
Br2 + 2NaI → 2NaBr + I2
Br2 có thể oxi hóa ion I- trong dung dịch NaI thành I2
⇒ Br2 có tính oxi hóa mạnh hơn I2 (3)
Từ (1), (2), (3) ta có thể sắp xếp mức độ giảm dần tính oxi hóa: Cl2 > Br2 > I2
3. Để chứng tỏ có sự tạo thành I2 khi cho nước chlorine (hoặc nước bromine) tác dụng với dung dịch sodium iodide ta có thể dùng thuốc thử là hồ tinh bột
Hiện tượng: Dung dịch màu vàng chuyển màu xanh tím.
Xem thêm lời giải bài tập Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Câu hỏi 1 trang 105 Hóa học 10: Kể tên một số hợp chất phổ biến của halogen trong tự nhiên....
Hoạt động 2 trang 105 Hóa học 10: Tham khảo Bài 12 (Liên kết cộng hoá trị), hãy...
Câu hỏi 2 trang 106 Hóa học 10: Trong tự nhiên, các nguyên tố halogen tồn tại ở dạng hợp chất...
Câu hỏi 4 trang 107 Hóa học 10: Từ Bảng 21.2, nhận xét xu hướng biến đổi nhiệt độ nóng chảy...
Câu hỏi 6 trang 109 Hóa học 10: Một nhà máy nước sử dụng 5 mg Cl2 để khử trùng 1 L nước sinh hoạt...
Hoạt động trang 109 Hóa học 10: Tìm hiểu tính tẩy màu của khí chlorine ẩm...
Hoạt động trang 110 Hóa học 10: Phản ứng thế của một số muối halide...
Bài viết liên quan
- Tìm hiểu tính tẩy màu của khí chlorine ẩm
- Khí Cl2 phản ứng với dung dịch sodium hydroxide nóng tạo thành sodium chloride
- Viết phương trình hoá học minh hoạ tính oxi hoá giảm dần trong dãy Cl2, Br2, I2
- Khi sản xuất chlorine trong công nghiệp, NaOH và H2 được tạo thành ở cực âm
- Hydrochloric acid được sử dụng rộng rãi trong sản xuất, điển hình là dùng để đánh sạch
