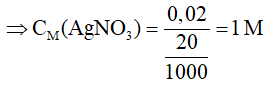Bài tập Kim loại tác dụng với dung dịch muối cực hay, có đáp án
-
498 lượt thi
-
20 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Cho thanh kim loại A (hóa trị II) vào dung dịch thì sau phản ứng khối lượng thanh giảm 0,2%. Cũng thanh kim loại trên nếu cho vào dung dịch thì khối lượng lại tăng 28,4%. Xác định kim loại A.
 Xem đáp án
Xem đáp án
Cho thanh kim loại A (hóa trị II) vào dung dịch thấy khối lượng thanh kim loại giảm đi ⇒ > ⇔ > 64.
Cho thanh kim loại A (hóa trị II) vào dung dịch thấy khối lượng thanh kim loại tăng lên ⇒ < ⇔ < 207 .
⇒ Chọn A.
Câu 2:
Ngâm một đinh sắt trong 200 ml dung dịch x M. Sau khi phản ứng kết thúc lấy đinh sắt ra khỏi dung dịch rửa nhẹ, làm khô thấy khối lượng đinh sắt tăng thêm 1,6 gam. Giá trị của x là
 Xem đáp án
Xem đáp án
= x.0,2 mol
x.0,2 ← x.0,2 → x.0,2 (mol)
Khi nhúng thanh Fe vào dung dịch , thanh Fe lúc sau có khối lượng tăng lên 1,6 gam hay:
= 1,6 g
⇔ 0,2x.64 - 0,2x.56 = 1,6
⇔ x = 1M.
⇒ Chọn C.
Câu 3:
Ngâm một thanh kim loại bằng đồng có khối lượng 10 gam trong 250 gam dung dịch 4%. Khi lấy vật ra khỏi dung dịch thì khối lượng trong dung dịch giảm 17%. Khối lượng của thanh kim loại sau phản ứng là?
 Xem đáp án
Xem đáp án
⇒ Chọn A.
Câu 4:
Một thanh kim loại M hóa trị II nhúng vào 1 lít dd 0,5M sau khi lấy thanh M ra khỏi dung dịch thấy khối lượng thanh M tăng 1,6g và nồng độ giảm còn 0,3M. Kim loại M là?
 Xem đáp án
Xem đáp án
= 0,5.1 = 0,5 mol
= 0,3.1 = 0,3 mol
⇒ = 0,5-0,3 = 0,2 mol
⇒ = 56
Vậy M là Fe.
⇒ Chọn B.
Câu 5:
Nhúng một lá kẽm vào dung dịch sau một thời gian lấy lá kẽm ra cân thấy nhẹ hơn 0,025g so với trước khi nhúng. Khối lượng Zn đã tan ra là
 Xem đáp án
Xem đáp án
Theo PTHH:
1 1 mol
→ mgiảm = 65 - 64 = 1g
Theo bài ra:
x x mol
→ = 0,025 g
⇒ x = 0,025/1 = 0,025 mol
⇒ mZn tan = 0,025.65=1,625g
⇒ Chọn D.
Câu 6:
Cho một thanh sắt nặng 20 gam vào 200ml dung dịch 0,5M. Sau khi phản ứng xảy ra hoàn toàn, lấy thanh sắt ra rửa sạch, sấy khô cân lại được m gam. Giá trị của m là
 Xem đáp án
Xem đáp án
= 0,5.0,2 = 0,1 mol
= 20/56 ≈ 0,357 mol
Vì > nên phản ứng hết.
Fe + → + Cu
⇒ = = = 0,1 mol
= 20-0,1.56+0,1.64 = 20,8g
⇒ Chọn A.
Câu 7:
Một hỗn hợp 4,15g chứa Fe và Al tác dụng với 200ml dung dịch 0,525M. Khuấy kỹ để phản ứng xảy ra hoàn toàn. Thu được kết tủa gồm hai kim loại có khối lượng 7,84g. Tìm số mol các kim loại trong hỗn hợp ban đầu.
 Xem đáp án
Xem đáp án
Vì thu được kết tủa là 2 kim loại nên Fe còn dư.
Suy ra, kết tủa là Fe dư và phản ứng hết.
Gọi a, b, c là số mol của Al phản ứng, Fe phản ứng và Fe dư.
Từ phương trình phản ứng và dữ kiện đề bài cho, ta lập được hệ phương trình:
Vậy ; .
Đáp án C
Câu 8:
Ngâm một lá đồng trong 20ml dung dịch bạc nitrat cho đến khi đồng không thể tan thêm được nữa. Lấy lá đồng ra, rửa nhẹ, làm khô và cân thì khối lượng lá đồng tăng thêm 1,52g. Hãy xác định nồng độ mol của dung dịch bạc nitrat đã dùng (giả thiết toàn bộ bạc giải phóng ra bám hết vào lá đồng).
 Xem đáp án
Xem đáp án
Cu → 2Ag
1 2 mol → = 2.108-64 = 152g
x 2x mol → =1,52g
⇒ x = 1,52/152 = 0,01 mol
⇒ = = 2x = 0,02 mol
⇒ Chọn C.
Câu 9:
Ngâm một lá sắt trong 100ml dung dịch đồng nitrat cho đến khi sắt không thể tan thêm được nữa. Lấy lá sắt ra, rửa nhẹ, làm khô và cân thì khối lượng lá sắt tăng thêm 1,6g. Hãy xác định nồng độ mol của dung dịch đồng nitrat đã dùng (giả thiết toàn bộ đồng giải phóng ra bám hết vào lá sắt).
 Xem đáp án
Xem đáp án
Chọn D.
Câu 10:
Ngâm một lá sắt có khối lượng 2,5g trong 25ml dung dịch 15% có khối lượng riêng là 1,12g/ml. Sau thời gian phản ứng, người ta lấy lá sắt ra rửa nhẹ, làm khô thì cân nặng 2,56g. Tính nồng độ phần trăm của và trong dung dịch sau phản ứng.
 Xem đáp án
Xem đáp án
vậy
⇒ Chọn A.
Câu 14:
Cho phản ứng hóa học: x… + + y…↑. Tổng (x + y) có thể là:
 Xem đáp án
Xem đáp án
Đáp án B
Fe + + ↑
=> Tổng (x+y) = 1+1 = 2