Trắc nghiệm tổng hợp Hóa 9 có đáp án
-
553 lượt thi
-
272 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Hãy chỉ ra đâu là chất, đâu là vật thể trong các ý sau:
a. Phần lớn xoong, nồi, ấm đun đều bằng nhôm.
b. Lưỡi dao bằng sắt, cán dao bằng nhựa.
c. Không khí gồm oxi, nitơ, khí cacbonic.
d. Nước biển gồm nước, muối và một số chất khác. Xem đáp án
Xem đáp án
Các từ chỉ vật thể
a. Xoong, nồi, ấm đun.
b. Lưỡi dao, cán dao.
c. Không khí.
d. Nước biển.
Các tử chỉ chất
a. Nhôm.
b. Sắt, nhựa.
c. Oxi, nitơ, khí cacbonic.
d. Nước, muối, chất khác.
Câu 2:
 Xem đáp án
Xem đáp án
Một số biểu hiện được voi là tính chất của chất: thể (rắn, lỏng, hơi), màu, mì, vị, tính dẫn nhiệt, tính cháy được…
Một số tính chất của muối ăn: chất rắn, màu trắng, không mùi, tan trong nước, vị mặn…
Một vài tính chất của đường: chất rắn, không mùi, tan trong nước, vị ngọt…
Muối ăn và đường có một số tính chất giống nhau: đều là chất rắn, không mùi, tan trong nước…
Khác nhau: Muối có vị mặn, đường có vị ngọt.
Câu 3:
Thành phần và tính chất của nước cất khác với nước tự nhiên như thế nào?
 Xem đáp án
Xem đáp án
|
|
NƯỚC TỰ NHIÊN |
NƯỚC CẤT |
|
Thành phần |
Nhiều chất trộn lẫn |
Một chất (nước) |
|
Tính chất |
Thay đổi |
Nhất định, không đổi |
Câu 4:
Căn cứ vào những tính chất nào mà:
a. Đồng, nhôm được dùng làm ruột dây điện còn cao su, nhựa được làm vỏ dây điện?
 Xem đáp án
Xem đáp án
a. Đồng, nhôm dẫn điện tốt được dùng làm ruột dây điện. Cao su, nhựa cách điện dùng làm vỏ dây điện.
Câu 5:
b. Bạc dùng để tráng gương?
 Xem đáp án
Xem đáp án
b. Bạc có ánh kim, phản xạ ánh sáng dùng để tráng gương.
Câu 7:
d. Than dùng để đốt lò?
 Xem đáp án
Xem đáp án
d. Than cháy được, khi cháy tỏa nhiều nhiệt dùng để đốt lò.
Câu 8:
 Xem đáp án
Xem đáp án
Thổi vào nước vôi trong, khí cacbonic có trong hơi thở ra sẽ làm đục nước vôi.
Câu 9:
Dựa vào tính chất vật lí và hóa học của các chất, hãy phân biệt các chất sau:
a. Bột sắt và bột lưu huỳnh.
 Xem đáp án
Xem đáp án
a. Có thể phân biệt bột sắt và bột lưu huỳnh dựa vào sự khác nhau về màu sắc của chúng: lưu huỳnh màu vàng, sắt màu xám…
Câu 10:
b. Đường và tinh bột.
 Xem đáp án
Xem đáp án
b. Có thể phân biệt được đường và tinh bột dựa vào sự khác nhau về khả năng hòa tan: đường tan tốt trong nước, tinh bột không tan trong nước.
Câu 11:
c. Et-xăng và nước.
 Xem đáp án
Xem đáp án
c. Có thể phân biệt được et-xăng và nước dựa vào sự khác nhau về tính chất hóa học của chúng: et-xăng cháy được, nước không cháy được.
Câu 12:
 Xem đáp án
Xem đáp án
Một chất được coi là tinh khiết hóa học khi không có lẫn chất khác. Chỉ chất tinh khiết mới có những tính chất nhất định, không đổi.
Câu 13:
Hỗn hợp là gì? Trong hỗn hợp tính chất riêng của mỗi chất có còn giữ nguyên hay không?
 Xem đáp án
Xem đáp án
Hỗn hợp gồm nhiều chất trộn lẫn với nhau. Trong hỗn hợp, tính chất riêng biệt của từng chất vẫn còn giữ nguyên.
Câu 14:
 Xem đáp án
Xem đáp án
Có thể dựa vào sự khác nhau về tính tan của đường và không tan của tinh bột để tách riêng tinh bột ra khỏi hỗn hợp.
Cách làm:
Đổ hỗn hợp tinh bột và đường trắng vào nước. Lắc và khuấy cho đường tan hết. Lọc qua phễu có giấy lọc. Tinh bột nằm lại trên giấy lọc. Làm khô sẽ thu được tinh bột không có lẫn đường. (Nếu cẩn thận hơn có thể đổ thêm nước vào phần tinh bột nằm trên giấy lọc. Nước sẽ hòa tan hết phần đường còn bám lại và chảy qua giấy lọc).
Câu 15:
 Xem đáp án
Xem đáp án
Không khí, nước đường là những hỗn hợp vì:
Không khí gồm khí oxi, khí nitơ, khí cacbonic…
Nước đường gồm nước, đường.
Muốn làm tăng độ ngọt của nước đường, ta thêm đường, ngược lại muốn giảm độ ngọt ta thêm nước.
Câu 16:
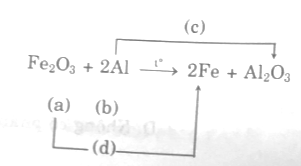
Không khí là hỗn hợp gồm hai chất khí chính là oxi và nitơ. Biết oxi lỏng sôi ở nhiệt độ −183oC, nitơ lỏng sôi ở nhiệt độ −196oC. Làm thế nào để tách riêng được oxi và nitơ lỏng?
 Xem đáp án
Xem đáp án
Tăng dần nhiệt độ của không khí:
Khi đạt đến nhiệt độ −196oC ta thu được khí nitơ.
Khi đạt đến nhiệt độ −183oC ta thu được khí oxi.
Phương pháp này được gọi là phương pháp chưng cất phân đoạn.
Câu 17:
Làm thế nào để tách:
a. Nước ra khỏi cát?
 Xem đáp án
Xem đáp án
a. Để tách nước ra khỏi cát ta có thể dùngL
Phép lắng gạn: Để yên một lúc, cát nặng và không tan trong nước sẽ chìm xuống dưới, nước ở phía trên. Gạn để tách nước ra khỏi cát.
Phép lọc: Đổ hỗn hợp cát và nước vào phễu lọc. Nước thấm qua giấy lọc và chảy xuống dưới, cát bị giữ lại trên giấy.
Câu 18:
b. Tách rượu etylic ra khỏi nước? (Cho biết nhiệt độ sôi của rượu etylic là 78,3oC).
 Xem đáp án
Xem đáp án
b. Để tách rượu ra khỏi nước ta có thể dùng phép chưng cất.
Đun nóng hỗn hợp gồm nước và rượu etylic trong bình chưng cất bằng thủy tinh. Vì nhiệt độ sôi của rượu etylic là 78,3oC, của nước là 100oC, nên rượu sẽ thoát ra trước và hơi nước thoát ra sau. Hơi rượu được dẫn qua ống làm lạnh bằng thủy tinh (ống sinh hàn) và ngưng tụ thành những giọt chất lỏng chảy qua miệng ống sinh hàn vào bình hứng.
Câu 19:
a. Nguyên tử được tạo thành từ ba loại hạt nhỏ hơn nữa, đó là những hạt nào?
 Xem đáp án
Xem đáp án
a. Ba loại hạt tạo thành nguyên tử là: proton, notron và electron.
Câu 20:
b. Hãy nói tên, kí hiệu và điện tích của những hạt mang điện.
 Xem đáp án
Xem đáp án
b.
− Proton, kí hiệu là p, có điện tích là 1+.
− Electron, kí hiệu là e, có điện tích là 1−.
Câu 21:
c. Những nguyên tử cùng loại có cùng số hạt nào trong hạt nhân?
 Xem đáp án
Xem đáp án
c. Những nguyên tử cùng loại có cùng số hạt proton trong hạt nhân.
Câu 22:
 Xem đáp án
Xem đáp án
Proton và notron có cùng khối lượng và tạo nên hạt nhân nguyên tử, còn electron có khối lượng rất bé, không đáng để so với khối lượng hạt nhân.
(mnguyên tử = mp + mn + me mp + mn)
Câu 23:
Viết CTHH của các hợp chất sau:
a. Vôi sống (canxi oxit) biết trong phân tử có một nguyên tử Ca và một nguyên tử O.
 Xem đáp án
Xem đáp án
a. CaO, phân tử khối của CaO bằng:
40 + 16 = 56
Câu 24:
b. Kẽm clorua biết trong phân tử có một nguyên tử kẽm và hai nguyên tử clo.
 Xem đáp án
Xem đáp án
b. ZnCl2, phân tử khối của ZnCl2 bằng:
65 + 2.35,5 = 136
Câu 25:
c. Đường, biết trong phân tử có 12 nguyên tử C, 22 nguyên tử H và 11 nguyên tử O. Xác định phân tử khối của vôi sống, kẽm clorua và của đường.
 Xem đáp án
Xem đáp án
c. C12H22O11, phân tử khối của C12H22O11 bằng:
12.12 + 22.1 + 11.16 = 342
Câu 26:
a. Hóa trị của nguyên tố hóa học được quy định bằng gì? Nêu ví dụ.
 Xem đáp án
Xem đáp án
a. Hóa trị của một nguyên tố được quy định bằng số nguyên tử hiđro liên kết với một nguyên tử của nguyên tố trong hợp chất của nó với hiđro.
Ví dụ: Trong H2O oxi có hóa trị II.
Trong CH4 cacbon có hóa trị IV.
Câu 27:
b. Có thể xác định hóa trị gián tiếp qua nguyên tố nào?
 Xem đáp án
Xem đáp án
b. Có thể xác định hóa trị gián tiếp qua nguyên tố oxi hoặc qua bất kì một nguyên tố nào khác đã biết hóa trị.
Ví dụ: Trong Na2O vì oxi có hóa trị II, nên Na có hóa trị I.
Trong FeCl3 vì Cl có hóa trị I, nên Fe có hóa trị III.
Câu 28:
Mol là gì?
a. Một mol nguyên tử gồm bao nhiêu nguyên tử? Lấy ví dụ 1 mol N; 1 mol P; 1 mol Ca; 1 mol Fe.
 Xem đáp án
Xem đáp án
Mol là lượng chất (hay nguyên tố chứa N. (N = 6,023.1023) hạt vi mô (nguyên tử, phân tử…)
a. Một mol nguyên tử gồm N (6,023.1023) nguyên tử.
Vậy số nguyên tử 1 mol N; 1 mol P; 1 mol Ca và 1 mol Fe đều bằng nhau và bằng 6,023.1023 nguyên tử.
Câu 29:
b. Một mol nguyên tử có bao nhiêu phân tử? Lấy ví dụ với 1 mol N2; 1 mol NaCl; 1 mol CaO; 1 mol CaCO3.
 Xem đáp án
Xem đáp án
b. Một mol phân tử gồm N (6,023.1023) phân tử.
Vậy số phân tử 1 mol N2; 1 mol NaCl; 1 mol CaO và 1 mol CaCO3 đều bằng nhau và bằng 6,023.1023 phân tử.
Câu 30:
a. Tính thành phần % về khối lượng các nguyên tố S và O trong khí SO3.
 Xem đáp án
Xem đáp án
Lời giải
a. trong 1 mol SO3 có 1 mol S và 3 mol O.
Vậy khối lượng nguyên tố S trong 1 mol SO3:
mS = 1.32 = 32 g
Khối lượng nguyên tố O trong 1 mol SO3:
mO = 3.16 = 48g
Vậy:
(Vì %S + %O = 100%).
Câu 31:
b. Tính khối lượng nguyên tố S và O có trong 12,8g khí SO3.
 Xem đáp án
Xem đáp án
b. Khối lượng nguyên tố S trong 12,8g SO3:
Khối lượng nguyên tố O trong 12,8g SO3:
(hoặc )
Câu 33:
b. Có bao nhiêu phân tử H2SO4.
 Xem đáp án
Xem đáp án
b. Số phân tử: n.N = 0,1.6,02.1023 = 6,02.1022 phân tử.
Câu 34:
c. Có bao nhiêu mol nguyên tử H; O; S.
 Xem đáp án
Xem đáp án
c. Có 0,2 nguyên tử H (0,2g H)
0,4 nguyên tử O (0,4.16 = 6,4gO)
0,1 nguyên tử S (0,1.32=3,2g S)
Câu 35:
d. Tỉ lệ số nguyên tử các nguyên tố trong H2SO4.
 Xem đáp án
Xem đáp án
d. Tỉ lệ số nguyên tử H : O : S = 0,2N : 0,4N : 0,1N = 2 : 4 : 1
Câu 36:
a. Tính khối lượng của 0,2 mol O2; 0,5 mol NaOH.
 Xem đáp án
Xem đáp án
a. Khối lượng của 0,2 mol O2:
Khối lượng của 0,5 mol NaOH:
Câu 38:
 Xem đáp án
Xem đáp án
c. Theo công thức:
Câu 39:
 Xem đáp án
Xem đáp án
c. Theo công thức:
Câu 40:
 Xem đáp án
Xem đáp án
Đặt công thức hợp chất CxOy
Từ (1) ta có: 44 = 12.1 + 16.y
Vậy y = 2
CTHH của hợp chất là CO2.
Câu 41:
Một loại quặng sắt chứa 90% oxit Fe3O4 (còn 10% là tạp chất không có sắt). Hãy tính:
a. Khối lượng sắt có trong 1 tấn quặng đó.
 Xem đáp án
Xem đáp án
a. Khối lượng Fe3O4 có trong 1 tấn quặng là:
(tấn)
Theo CTHH Fe3O4, ta có:
Cứ 232 gam Fe3O4 có 168 gam Fe
Hay 232 tấn Fe3O4 có 168 tấn Fe
vậy 0,9 tấn Fe3O4 có x tấn Fe
Khối lượng sắt có trong 1 tấn quặng:
(tấn)
Câu 42:
b. Khối lượng quặng cần lấy để được 1 tấn sắt.
 Xem đáp án
Xem đáp án
b. Từ kết quả câu (a) ta có:
Cứ 1 tấn quặng có 0,6517 tấn Fe.
Vậy y tấn quặng có 1 tấn Fe.
Khối lượng quặng là:
(tấn)
Câu 43:
Hãy giải thích tại sao:
a. Khi nung nóng canxi cacbonat (đá vôi) thấy khối lượng giảm đi.
 Xem đáp án
Xem đáp án
a. Khi nung nóng đá vôi có phản ứng xảy ra:
Khí CO2 thoát ra làm khối lượng giảm.
(Phần khối lượng giảm đúng bằng lượng CO2 thoát ra).
Câu 44:
b. Khi nung nóng một miếng đồng thì thấy khối lượng tăng lên.
 Xem đáp án
Xem đáp án
b. Khi nung miếng đồng có phản ứng hóa học xảy ra:
Do oxi hóa hợp với đồng tạo ra đồng (II) oxit CuO, là chất rắn nên khối lượng tăng (phần khối lượng tăng đúng bằng khối lượng oxi đã hóa hợp với đồng).
Câu 45:
a. Để đốt cháy m gam chất X cần dùng 4,48 lít O2 (ở đktc) thu được 2,24 lít CO2 (đktc) và 2,6 gam H2O. Tính m.
 Xem đáp án
Xem đáp án
a. Ta có phản ứng:
Vậy mX + 6,4 = 4,4 + 3,6 = 8 mX = 1,6 (gam)
Câu 46:
 Xem đáp án
Xem đáp án
b. Thep phản ứng ta có:
Ta có tổng khối lượng MY + O2 phải bằng tổng khối lượng CO2 + H2O. (Theo định luật bảo toàn khối lượng).
Vậy tổng khối lượng H2O + CO2 là:
Vì: tức tỉ lệ khối lượng
Vậy
(hay )
Câu 47:
Tính số mol nguyên tử n có trong:
a. 6g cacbon. Xem đáp án
Xem đáp án
Áp dụng công thức trong đó n là số mol nguyên tử. M là khối lượng mol nguyên tử.
Ta có:
a.
Câu 50:
d. 4,8g oxi.
 Xem đáp án
Xem đáp án
d)
Ở cacbon có số nguyên tử nhiều hơn cả và bằng:
0,5.N = 0,5.6.1023 = 3. 1023 nguyên tử C
Câu 51:
Lập phương trình hóa học của phản ứng giữa axit clohiđric tác dụng với kẽm theo sơ đồ sau: . Biết rằng sau phản ứng thu được 0,3 mol khí hiđro. Hãy tính:
a. Khối lượng kẽm đã phản ứng.
 Xem đáp án
Xem đáp án
PTHH:
Tỉ lệ: 1 mol 2 mol 1 mol 1 mol
Hay: 65g 2.36,5g 136g 2g
a. Cứ 1 mol H2 tạo thành 1 mol Zn đã phản ứng. Vậy 0,3 mol H2 tạo thành có X mol Zn đã phản ứng:
Số mol Zn = nZn = x = 0,3 mol
mZn = n.M = 0,3.65=19,5g
Câu 52:
 Xem đáp án
Xem đáp án
b. Cứ 1 mol H2 sinh ra cũng có 1 mol ZnCl2 tạo thành, 0,3 mol H2 sinh ra có x mol ZnCl2
Câu 53:
Khi đốt chát 4,6g một hợp chất bằng oxi thì thu được 8,8g CO2 và 5,4g H2O. Hãy cho biết:
a. Hợp chất do nguyên tố nào tạo nên.
 Xem đáp án
Xem đáp án
Hợp chất cháy (tác dụng với oxi) tạo thành CO2 và H2O chứng tỏ trong hợp chất có nguyên tố C, nguyên tố H và có thẻ có nguyên tố oxi.
- Lượng C có trong 8,8g CO2:
- Lượng H có trong 5,4g H2O:
- mC + mH = 2,4 + 0,6 = 3g . Khối lượng này nhỏ hơn khối lượng đem đốt. Vậy suy ra trong hợp chất còn oxi và khối lượng oxi có trông hợp chất trên là:
Từ kết quả trên ta thấy:
a. Hợp chất do 3 nguyên tố là H, C và O tạo nên.
Câu 54:
b. Tính khối lượng các nguyên tố có trong lượng chất trên.
 Xem đáp án
Xem đáp án
b. Trong 4,6g chất có 2,4g C; 0,6g H và 1,6g O.
Câu 55:
Tính % khối lượng của các nguyên tố có trong các hợp chất sau:
H2O; H2SO4; C2H5OH; CH3−COOH; CnH2n+2; FexOy Xem đáp án
Xem đáp án
Trong H2O, % khối lượng của:
Trong H2SO4:
Trtong CH3COOH:
Trong FexOy:
Trong CnH2n+2:
Câu 56:
Tính khối lượng m của:
a. 0,5 mol Mg và 0,5 mol Zn.
 Xem đáp án
Xem đáp án
Ta có công thức m = n.M
Theo n và giá trị tương ứng của M, ta có:
Câu 60:
 Xem đáp án
Xem đáp án
Tỉ lệ khối lượng các chất cho:
(1)
PTHH: Fe + S = FeS
Tỉ lệ: 1 mol 1 mol 1 mol
Hay 56g 32g 88g
Theo PTHH: (2)
So sánh (1) và (2) suy ra Fe còn dư:
Vậy lượng FeS phải tính theo lượng S
Cứ 32g S 88g FeS 56g Fe
Vậy 3,2g S x g FeS y g Fe
Vậy sau phản ứng được FeS = 8,8g.
Và Fe còn dư = 11,2 – 5,6 = 5,6g.
Nếu dùng số mol để tính, ta có:
PTHH: Fe + S = FeS
Trước p.ư 0,2 0,1 (mol)
P.ư 0,1 0,1
Sau p.ư 0,1 0 0,1
Vậy mFeS = n.M = 0,1.88 = 8,8g
mFe dư = n.M = 0,1.56 = 5,6g
Câu 61:
 Xem đáp án
Xem đáp án
Hỗn hợp oxi lỏng và nột than sẽ là hỗn hợp nổ mạnh nhất và tiết kiệm nhất khi các phản ứng vừa đủ với nhau.
PTHH: C + O2 = CO2
Theo PTHH thì cứ 1 mol C (12g C) phản ứng vừa đủ với 1 mol O2 (32g O2) vì vậy cần trộn theo tỉ lệ khối lượng là:
Câu 62:
 Xem đáp án
Xem đáp án
Khi phân tích nước ta thu được tỉ lệ:
(1)
Nếu đặt x là số nguyên tử H, y là số nguyên tử O trong một phân tử nước, a là khối lượng tính bằng gam của một đ.v.c
Ta có:
(2)
Từ (1) và (2) suy ra:
Tỉ số này phù hợp với CTHH của nước H2O.
Câu 63:
Tính thành phần % về khối lượng của nguyên tố O có trong:
a. Khí cacbonoxit CO.
 Xem đáp án
Xem đáp án
a. MCO = 28g.
Trong 1 mol CO có 1 mol O nên mO = 1.16 = 16g
Câu 65:
c. Nhôm oxit Al2O3.
Ở chất nào có nhiều oxi hơn cả?
 Xem đáp án
Xem đáp án
c.
Trong 1 mol Al2O3 có 3 mol O nên mO = 3.16 = 48g
Vậy: Oxit cacbon có nhiều oxi hơn cả.
Câu 66:
Xác định công thức phân tử của các chất X, Y, Z biết thành phần phần trăm khối lượng như sau:
a. Chất X chứa 85,71% cacbon và 14,29% hiđro, một lít khí X (đktc) nặng 1,25g.
 Xem đáp án
Xem đáp án
a. Chất X: Khối lượng mol phân tử của X
MX = 1,25.22,4 = 2,8 (g/mol)
Số nguyên tử
Số nguyên tử
Vậy CTPT của X là C2H4.
Câu 67:
b) Chất Y chứa 80% cacnon và 20% hiđro.
 Xem đáp án
Xem đáp án
b. Chất Y: Gọi CTPT của Y là CxHy ta có tỉ lệ:
Vậy công thức đơn giản nhất của Y là (CH3)n.
Nếu n = 1: CH3 loại vì cacbon hóa trị 3.
Nếu n = 2: C2H6: đúng, đó là etan.
Nếu n = 3: C3H9 loại vì dư hóa trị C.
Nếu n = 4: C2H12 loại vì dư hóa trị C.
Vậy CTPT của Y: C2H6.
Câu 68:
c. Chất X chứa 40% cacbon, 6,67% hiđro và 53,35% oxi. Biết mỗi phân tử Z có 2 nguyên tử oxi.
 Xem đáp án
Xem đáp án
c. Chất Z: Gọi CTPT của Z là CxHyOz, ta có:
Công thức đơn giản của Z: (CH2O)n.
Vì phân tử chỉ có 2 nguyên tử O nên CTPT của Z: C2H4O2.
Câu 69:
 Xem đáp án
Xem đáp án
và có 0,25N nguyên tử.
Suy ra số nguyên tử Na cần có là: 2.0,25.N = 0,5N nguyên tử Na.
1 mol Na có N nguyên tử Na và có khối lượng 23g.
Vậy muốn có 0,5N nguyên tử Na phải lấy: 0,5.23 = 11,5g Na
Câu 70:
Cho sơ đồ của phản ứng phân hủy thủy phân oxit: Hãy lập PTHH và:
a. Tính khối lượng khí oxi sinh ra khi có 0,1 mol HgO đã phân hủy.
 Xem đáp án
Xem đáp án
PTHH phân hủy thủy ngân oxit:
2HgO = 2Hg + O2
có tỉ lệ 2 mol 2 mol 1 mol
hay 2.217g 2.201g 32g
a. Từ tỉ lệ số mol các chất phản ứng ta có:
Cứ 2 mol HgO sinh ra 1 mol O2.
0,1 mol HgO x mol O2
Vậy số mol
Câu 71:
b. Tính khối lượng thủy ngân Hg sinh ra khi có 43,4g HgO phân hủy.
 Xem đáp án
Xem đáp án
b. Từ tỉ lệ về khối lượng, ta có:
Cứ 434g HgO phân hủy sinh ra 402g Hg.
Vậy 43,4 g HgO phân hủy sinh ra y g Hg.
-> y = 40,2 (g)
Câu 72:
c. Tính khối lượng oxit thủy ngân đã phân hủy khi có 14,07g Hg sinh ra.
 Xem đáp án
Xem đáp án
c. Cứ 402g Hg sinh ra có 434g HgO đã phân hủy vậy 14,7g Hg sinh ra có z g HgO đã phân hủy.
Câu 73:
a. Sắt tạo được 3 oxit FeO; Fe2O3; Fe3O4. Nếu hàm lượng của Fe trong oxit là 70% (khối lượng) thì đó là oxit nào của sắt?
 Xem đáp án
Xem đáp án
a. Trong FeO thì
Fe2O3 thì
Fe3O4 thì
Vậy oxit sắt đó là Fe2O3.
Câu 74:
 Xem đáp án
Xem đáp án
b. Gọi M là kim loại hóa trị n.
Theo công thức phân tử M2(CO3)n:
Đối với muối photphat: M3(PO4)n ta có:
Thay M = 20n vào công thức này ta có:
Câu 75:
 Xem đáp án
Xem đáp án
Thể tích oxi có trong 5,6l không khí:
PTHH:
Theo PTHH: (1)
Theo giả thiết cho: (2)
So sánh (1) và (2) suy ra P cháy hết, dựa vào thể tích oxi phản ứng, tính ra lượng P phản ứng là: 1,24g, khối lượng P dư là 8,76g.
Câu 76:
Những công thức hóa học sau đây cho biết những ý gì?
a. Cu.
 Xem đáp án
Xem đáp án
a. Cu: Chỉ nguyên tố đồng.
Chỉ 1 nguyên tử đồng.
KLNT: Cu = 64.
Câu 78:
c. H2SO4.
 Xem đáp án
Xem đáp án
. H2SO4: Chỉ chất axit sunfuric.
Chỉ 1 phân tử axit sunfuric
KLPT: H2SO4 = 2.1 + 32 + 16.4 = 98.
Câu 79:
Cho các sơ đồ phản ứng sau:
Hãy lập PTHH của các phản ứng đó và cho biết chúng thuộc loại phản ứng nào? Nếu là phản ứng oxi hóa khử thì hãy cho biết chất nào là chất khử? Chất nào là chất oxi hóa.
 Xem đáp án
Xem đáp án
a. (p.ư oxi hóa – khử)
(khử) (oxi hóa)
b.
c.
(oxi hóa) (khử) (p.ư oxi hóa – khử)
Câu 80:
 Xem đáp án
Xem đáp án
Khối lượng vôi sống CaO:
Phản ứng:
Tỉ lệ 56g 74g
Cho 112g x?
Khối lượng Ca(OH)2 tạo thành:
Câu 81:
 Xem đáp án
Xem đáp án
Lượng cacbon nguyên chất có trong 1kg than:
PTPƯ:
Tỉ lệ: 12kg 32kg 44kg
Cho: 0,96kg y? kg x? kg
Câu 82:
Dùng chữ số, công thức hóa học và kí hiệu hóa học để diễn đạt các ý sau:
a. Hai phân tử nước.
 Xem đáp án
Xem đáp án
a. 2H2O.
Câu 85:
Người ta đốt lưu huỳnh trong một bình chứa 10g oxi. Sau phản ứng người ta thu được 12,8g khí sunfurơ SO2.
a. Tính khối lượng lưu huỳnh đã cháy.
 Xem đáp án
Xem đáp án
a) Tính lượng các chất phản ứng:
Tỉ lệ: 32 (g) 32(g) 64(g)
Cho: x? g y? g 12,8g
Khối lượng S đã cháy:
Câu 86:
b. Tính khối lượng oxi còn thừa sau phản ứng.
 Xem đáp án
Xem đáp án
b) Khối lượng oxi đã phản ứng:
Khối lượng oxi còn dư: 10 – 6,4 = 36(g)
Câu 87:
Cho các sơ đồ phản ứng:
Hãy lập PTHH của phản ứng trên và cho biết trong các sản phẩm tạo thành, chất nào là oxit, chất nào là axit, chất nào là bazơ? Xem đáp án
Xem đáp án
a. (bazơ)
b. (oxit)
c. (axit)
d. (đều là oxit).
Câu 88:
Phân tích 3,16g một hợp chất gồm 3 nguyên tố K; Mn; O thì thu được 0,78g K; 1g Mn.
a. Biết hợp chất trên có phân tử khối là 158. Hãy xác định công thức hóa học và gọi tên hợp chất.
 Xem đáp án
Xem đáp án
a. mO = 3,16 – (mK + mMn) = 3,16 – (0,78 + 1,1) = 1,28g
Đặt công thức hợp chất là KxMnyOz.
Ta có tỉ lệ thức sau:
Vậy công thức hợp chất là: KMnO4.
Tên: Kali pemanganat (thuốc tím).
Câu 89:
b. Đem phân hủy hoàn toàn lượng hợp chất trên thì thu được bao nhiêu lít khí sau phản ứng (đo ở đktc).
 Xem đáp án
Xem đáp án
b. Số mol KMnO4 phản ứng:
Phản ứng xảy ra:
Tỉ lệ: 2 mol 1 mol
Cho: 0,02 mol x = 0,01 mol
Vậy: Thể tích O2:
Câu 90:
c. Nếu dùng toàn bộ thể tích khí thu được ở (b). Cho tham gia phản ứng tiếp với dây sắt đã được mồi lửa (lấy dư). Tính khối lượng sắt đã tham gia vào phản ứng. Tính khối lượng sản phẩm được tạo thành sau phản ứng.
 Xem đáp án
Xem đáp án
c.
Tỉ lệ: 3 mol 2 mol 1 mol
Cho: x? mol 0,01 mol y? mol
Số mol Fe phản ứng:
Số mol Fe3O4 tạo thành:
Câu 92:
Viết CTHH của các axit mà trong thành phần hóa học lần lượt có các gốc axit sau: (có hóa trị kèm theo)
Br (I); S (II); NO3 (I); SO3 (II); SO4 (II)
CO3 (II); PO4 (III); ClO3 (I); MnO4 (I) Xem đáp án
Xem đáp án
Các axit:
HBr; H2S; HNO3; H2SO3; H2SO4; H2CO3; H3PO4; HClO3; HMnO4.
Các bazơ:
KOH; NaOH; Mg(OH)2; Ca(OH)2; Ba(OH)2; Al(OH)3; Cu(OH)2; Zn(OH)2; Pb(OH)2.
Câu 94:
Trong những chất dùng làm phân hóa học (phân đạm) sau đây, chất nào có tỉ lệ về khối lượng Nitơ (hàm lượng Nitơ hay hàm lượng đạm) cao nhất?
 Xem đáp án
Xem đáp án
a. (M = 85)
b. (M = 164)
c. (M = 132)
d. (M = 80)
e. (M = 60)
Vậy hàm lượng nitơ cao nhất là ở phân urê.
Câu 96:
Các chất có CTHH sau:
K2O; HCl; Fe(OH)2; Fe(OH)3; H2SO4; CO
CO2; HNO3; H3PO4; FeSO4; Fe2(SO4)3
Hãy gọi tên từng chất và cho biết chất đó thuộc loại nào? Xem đáp án
Xem đáp án
loại chất oxit.
loại chất axit.
loại chất bazơ.
loại chất muối.
Câu 97:
a. Dùng khí cacbon oxit khử oxi hoàn toàn của 23,2g oxit sắt từ. Sau đó cho toàn bộ sản phẩm rắn tác dụng vừa hết với axit clohiđric (ở đktc). Viết các phương trình đã xảy ra. Tính thể tích chất khí sinh ra ở phản ứng thứ 2 (đktc).
 Xem đáp án
Xem đáp án
a. Oxit sắt từ: Fe3O4 (M = 232)
Số mol Fe3O4
Phản ứng khử Fe3O4 bằng CO:
Câu 98:
b. Nếu cho thể tích khí thu được ở trên phản ứng hết với khí õi. Tính khối lượng chất lỏng thu được sau phản ứng.
 Xem đáp án
Xem đáp án
b.
Câu 99:
Tính hóa trị của các nguyên tố
a. Cacbon trong CH4; CCl4; CO; CO2.
 Xem đáp án
Xem đáp án
Hợp chất: CH4 CCl4 CO CO2
Hóa trị của cacbon: IV IV II IV
Câu 100:
b. Lưu huỳnh trong H2S; SO2; SO3.
 Xem đáp án
Xem đáp án
Hợp chất: H2S SO2 SO3
Hóa trị của lưu huỳnh: II IV VI
Câu 101:
c. Nhôm trong Al2O3; AlCl3; Al(OH)3.
 Xem đáp án
Xem đáp án
Hợp chất: Al2O3 AlCl3 Al(OH)3
Hóa trị của nhôm: III III III
Câu 102:
Người ta điều chế kẽm oxi ZnO bằng cách đốt bột kẽm trong oxi.
a. Tính khối lượng oxi cần thiết để điều chế 40,5g kẽm oxit.
 Xem đáp án
Xem đáp án
a. Tính số mol ZnO điều chế được:
Phản ứng tạo thành kẽm oxit:
Số mol O2 cần: 0,25mol
Khối lượng O2 cần: 0,25 . 32 = 8 (g)
Câu 103:
b. Muốn có lượng oxi nói trên thì phải phân hủy bao nhiêu gam kaliclorat (KClO3)?
 Xem đáp án
Xem đáp án
b. Phản ứng phân hủy KClO3.
Tỉ lệ: 2 mol 3 mol
P.ư: x? mol 0,25 mol
Số mol KClO3 cần:
Khối lượng KClO3 cần:
Câu 104:
Cho các công thức hóa học sau, hãy sửa lại những công thức viết sai.
MgCl2; KO2; PH2; KCO3; AgNO3
Al(NO3)3; Al2(SO4)3; K2PO4; Zn(OH)2
 Xem đáp án
Xem đáp án
Những công thức viết sai: KO2, PH2, KCO3.
Phải viết đúng là: K2O, PH3, K2CO3.
Câu 105:
Cho 6g cacbon phản ứng với 24g khí oxi.
a. Viết phương trình phản ứng Xem đáp án
Xem đáp án
Tính số mol ban đầu của C và O2.
a. Phản ứng:
Ban đầu: 0,5 0,75 0 (mol)
Phản ứng: 0,5 0,5 0,5 (mol)
Sau p.ư: 0 0,25 0,5 (mol)
Câu 106:
b. Chất nào còn thừa sau phản ứng? Thừa bao nhiêu gam?
 Xem đáp án
Xem đáp án
b. Chất còn thừa sau phản ứng là oxi với khối lượng:
Câu 107:
c. Tính thể tích chất được tạo thành sau phản ứng (biết rằng chất này có thể làm đục nước vôi trong).
 Xem đáp án
Xem đáp án
c. Chất tạo thành sau phản ứng là CO2.
Số mol:
Câu 108:
Hãy cho biết ý nghĩa của phương trình hóa học. Lấy ví dụ minh họa.
 Xem đáp án
Xem đáp án
Một phương trình phản ứng hóa học cho biết những ý sau:
- Chất tham gia và chất tạo thành.
- Tỉ lệ số phân tử các chất trong phản ứng và do đó cũng cho biết tỉ lệ về khối lượng, về số mol các chất trong phản ứng.
- Ngoài ra còn cho biết loại phản ứng:
Ví dụ:
- Cho biết sắt tác dụng với axit clohiđric thì tạo thành sắt II clorua và hiđro.
- Cho biết tỉ lệ phản ứng như sau:
Tỉ lệ số phân tử: 1 2 1 1
Tỉ lệ về số mol: 1 mol 2 mol 1 mol 1 mol
Tỉ lệ về khối lượng: 56g 73g 127g 2g
(Với các chất khí còn cho biết tỉ lệ về thể tích).
Phản ứng trên thuộc loại phản ứng thế.
Câu 109:
Không khí là một hỗn hợp nhiều chất? Hiện tượng nào chứng tỏ trong không khí
a. Có khí oxi.
 Xem đáp án
Xem đáp án
Hiện tượng chứng tỏ:
a. Có oxi: không khí duy trì sự sống và sự cháy.Câu 110:
b. Có khí cacbonic.
 Xem đáp án
Xem đáp án
b. Có khí cacbonic: khí CO2 trong không khí tác dụng với nước vôi trong tạo thành một màng trắng mỏng trên mặt lớp nước vôi trong ở các hồ vôi tôi.
Câu 111:
Trong phòng thí nghiệm có 3 lọ mất nhãn đựng 3 dung dịch riêng biệt: dung dịch NaOH, dung dịch H2SO4 và dung dịch NaCl. Làm thế nào để nhận ra từng chất?
 Xem đáp án
Xem đáp án
Trích ở mỗi lọ một ít các chất (gọi là mẫu thử) rồi cho vào 3 ống nghiệm riêng biệt.
Nhỏ vào từng ống nghiệm vài giọt dung dịch quỳ tím, quan sát, nếu thấy:
Dung dịch trong ống nghiệm có màu đỏ, mẫu thử là dung dịch axit H2SO4.
Dung dịch trong ống nghiệm hóa xanh, mẫu thử là dung dịch NaOH.
Không thấy xuất hiện màu là mẫu thử dung dịch NaCl.
Câu 112:
a. Tính khối lượng của 2,24 lít cacbon (II) oxit (đktc); 5,6 lít khí oxi (đktc).
 Xem đáp án
Xem đáp án
a. Tính số mol các chất (n):
Tính khối lượng từng chất (m):
Câu 113:
b. Tính thể tích (đo ở đktc) của 15g khí hiđro.
 Xem đáp án
Xem đáp án
b. Tính số mol khí H2:
Tính thể tích khí H2 (đktc):
Câu 114:
Hỏi có bao nhiêu mol nguyên tử đồng trong:
a. 64g đồng.
 Xem đáp án
Xem đáp án
Số mol nguyên tử đồng (n):
a.
Câu 117:
Hãy cho biết 3,01.1023 phân tử oxi:
a. Có bao nhiêu phân tử gam khí oxi?
 Xem đáp án
Xem đáp án
a. Số ptg (số mol):
Câu 120:
Tính thể tích khí hiđro (đktc) điều chế được khí cho:
a. 42g sắt tác dụng với axit clohiđric dư.
 Xem đáp án
Xem đáp án
a. Tính số mol sắt:
Vì đã biết HCl dư nên lượng H2 phải tính theo lượng chất tham gia phản ứng hết là Fe.
Câu 121:
b. Kẽm dư tác dụng với dung dịch chứa 0,2 ptg axit sunfuric.
 Xem đáp án
Xem đáp án
b. Vì kẽm dư nên H2 tính theo H2SO4 là chất phản ứng hết:
Câu 122:
Đốt cháy hoàn toàn 126g sắt trong bình chứa khí oxi.
a. Viết phương trình phản ứng.
 Xem đáp án
Xem đáp án
a,
Phản ứng:
Tỉ lệ: 3 mol 2 mol
P.ư: 2,25 mol x? mol
Câu 124:
c. Tính khối lượng kali clorat cần dùng để khi phân hủy thì thu được một thể tích khí oxi bằng với thể tích khí oxi đã sử dụng ở phản ứng trên (đktc).
 Xem đáp án
Xem đáp án
c. Phản ứng phân hủy kali clorat KClO3:
Tỉ lệ: 2 mol 3 mol
P.ư: x? mol 1,5 mol
Số mol KClO3 cần
Khối lượng KClO3
Câu 125:
a. Tính số nguyên tử gam có trong:
- 30g nguyên tố cacbon.
- 80g nguyên tố oxi.
- 40g nguyên tố magie.
 Xem đáp án
Xem đáp án
a. Kí hiệu số nguyên tử gam (hay mol nguyên tử) là n.
Ta có:
Câu 126:
b. Tính số phân tử gam trong:
- 108g nước H2O.
- 8g khí oxi O2.
- 22g khí cacbon.
- 8g đồng (II) oxit CuO.
 Xem đáp án
Xem đáp án
b. Kí hiệu số phân tử gam (hay mol phân tử) là n.
Ta có:
Câu 127:
Một hỗn hợp gồm 1,5 phân tử gam oxi; 2,5 phân tử gam N2; 0,5 phân tử gam CO2 và 0,5 phân tử gam SO2.
a. Tính tổng số phân tử gam khí có trong hỗn hợp đó.
 Xem đáp án
Xem đáp án
a. Tổng số phân tử gam các khí trong hỗn hợp:
Câu 128:
b. Tính thể tích của hỗn hợp đó.
 Xem đáp án
Xem đáp án
b. Thể tích hỗn hợp khí:
V = n.22,4 = 5.22,4 = 112 (lít)
Câu 130:
Đốt cháy hoàn toàn 18,6 gam phốt pho trong bình chứa khí oxi, ta thu được một chất bột màu trắng là phốt pho (V) oxit.
a. Viết phương trình phản ứng.
 Xem đáp án
Xem đáp án
a. Tính số mol phốt pho:
Phương trình phản ứng:
(1)
Tỉ lệ: 4 mol 5 mol 2 mol
P.ư: 0,6 mol x? mol y? mol
Câu 132:
c. Cho một lượng nước dư vào bình lắc đều. Sau khi hòa tan hết bột trắng, chất lg lỏng trong bình có thể làm giấy quỳ tím hóa đỏ.
 Xem đáp án
Xem đáp án
c. Theo (1) số mol P2O5 tạo thành là:
Phản ứng xảy ra khi hòa tan P2O5 vào nước:
P.ư: 0,3 mol 0,6 mol
Vậy khối lượng sản phẩm H3PO4 là:
Câu 133:
Cho 13g kẽm vào một dung dịch chứa 0,5 mol axit clohiđric.
a. Tính thể tích hiđro thu được ở đktc.
 Xem đáp án
Xem đáp án
a. Tính số mol kẽm:
Phản ứng:
Ban đầu: 0,2 mol 0,5 mol 0 0
P.ư: 0,2 mol 0,4 mol 0,2 mol 0,2 mol
Sau p.ư: 0 0,1 mol 0,2 mol 0,2 mol
Số mol H2 = 0,2 mol
Câu 134:
b. Nếu nhúng quỳ tím vào sau khi phản ứng kết thúc, quỳ tím chuyển sang màu gì?
 Xem đáp án
Xem đáp án
b. Sau phản ứng trong dung dịch có 2 chất tan là ZnCl2 và HCl còn dư (0,1 mol). Vì có axit dư nên quỳ tím hóa đỏ.
Câu 135:
Cho phân hủy nước bằng phương pháp điện phân, người ta thu được 28 lít khí oxi (đktc).
a. Viết phương trình phản ứng.
 Xem đáp án
Xem đáp án
Tính số mol khí O2 thu được:
a. Phương trình phản ứng điện phân nước:
P.ư: 2.1,25 mol 1,25 mol
Câu 136:
b. Tính khối lượng nước đã bị phân hủy.
 Xem đáp án
Xem đáp án
b. Số mol H2O bị điện phân: 2,5 mol
Khối lượng H2O bị điện phân: 2,5.18 = 45 (gam)
Câu 137:
c. Lấy toàn bộ thể tích khí oxi nói trên để đốt cháy hoàn toàn 12,8g lưu huỳnh.
Viết phương trình phản ứng.
Tính thể tích khí oxi còn dư lại sau phản ứng (đktc).
 Xem đáp án
Xem đáp án
c. Số mol lưu huỳnh:
Ban đầu: 0,4 1,25 0 (mol)
P.ư: 0,4 0,4 0,4 (mol)
Sau p.ư: 0 0,85 0,4 (mol)
Vậy O2 còn dư: 0,85 mol
Câu 138:
Khi cho khí hiđro đi qua bột sắt III oxit Fe2O3 nung nóng, người ta thu được sắt theo sơ đồ phản ứng:
a. Nếu sau phản ứng, người ta thu được 42g sắt thì khối lượng sắt (III) oxit đã tham gia phản ứng là bao nhiêu gam?
 Xem đáp án
Xem đáp án
Tính số mol Fe tạo thành:
Phản ứng:
Tỉ lệ: 1 mol 3 mol 2 mol 3 mol
P.ư: x? mol 0,75 mol y? mol
a. Số mol Fe2O3 p.ư
Khối lượng Fe2O3p.ư = 0,375.160 = 60 (g)
Câu 139:
b. Khối lượng nước tạo thành trong phản ứng trên là bao nhiêu gam?
 Xem đáp án
Xem đáp án
b. Số mol H2O tạo thành:
Khối lượng H2O tạo thành = 1,125.18 = 20,25 (g)
Câu 140:
Người ta nung 10 tấn đá vôi (canxi cacbonat) CaCO3 phản ứng tạo thành vôi sống (canxi oxit) CaO và khí cacbonic.
a. Tính lượng vôi sống thu được.
 Xem đáp án
Xem đáp án
Tính số mol CaCO3.
10 tấn = 10.106 gam = 100 . 105 gam
P.ư:
Tỉ lệ: 1 mol 1 mol 1 mol
P.ư: 105 mol 105 mol 105 mol
a. Khối lượng vôi sống (CaO) thu được:
Câu 142:
 Xem đáp án
Xem đáp án
Đặt M là kí hiệu và cũng là KLNT kim loại.
Công thức muối cacbonat: M2CO3 (PTL = 2M + 60)
P.ư:
Tỉ lệ: (M + 60)g 22,4 lít
Cho: 0,53g 0,112 lít
Ta có phương trình liên hệ:
(1)
Giải (1)
Vậy muối đó là Na2CO3.
Câu 143:
a. Dung dịch là gì? Hãy kể vài loại dung môi thường gặp. Cho thí dụ về chất tan là chất rắn, chất lỏng, chất khí.
 Xem đáp án
Xem đáp án
a. Dung dịch là hỗn hợp đồng nhất của dung môi và chất tan.
- Các dung môi thường gặp là: nước, rượu, dầu hỏa, benzen…
- Chất tan có thể là chất rắn: Thí dụ muối ăn, đường… Có thể là chất lỏng như rượu hoặc chất khí NH3, HCl…
Câu 144:
b. Độ tan của một chất là gì? Độ tan phụ thuộc vào yếu tố nào? Thế nào là dung dịch bão hòa, chưa bão hòa?
 Xem đáp án
Xem đáp án
b. Độ tan của một chất là lượng chất tan có thể hòa tan tối đa vào dung môi nhất định. Độ tan kí hiệu bằng chữ S. Độ tan có thể biểu diễn theo gam chất tan tối đa trong 100g dung môi ở nhiệt độ nhất định. Ví dụ 25oC, 100g nước hòa tan được tối đa 35,91g NaCl. Ta nói độ tan của muối ăn trong nước 25oC là 35,91g. Cũng có thể biểu diễn độ tan theo nồng độ mol.
- Độ tan phụ thuộc vào:
+ Bản chất chất tan: Chất tan nhiều, chất tan ít.
+ Bản chất dung môi: Nước khác rượu.
+ Nhiệt độ: Chất rắn nhiệt độ tăng, độ tan tăng, chất khí nhiệt độ giảm, độ tan tăng.
- Dung dịch bão hòa: Dung dịch không thể hòa tan thêm được nữa. (Ứng với lượng tan cực đại). Dung dịch chưa bão hòa là dung dịch có thể hòa tan thêm chất tan.
Câu 145:
 Xem đáp án
Xem đáp án
Khối lượng dung dịch: 750 + 50 = 800 (g)
Cách 1: Ta có 800g dung dịch có 50g muối:
Vậy 100g dung dịch có x g muối
Theo định nghĩa: C% = 6,25%.
Cách 2: Áp dụng công thức:
Câu 146:
Tính nổng độ % của dung dịch thu được khi hòa tan 4,48l khí hiđro clorua (HCl) ở điều kiện tiêu chuẩn vào 500cm3 nước.
 Xem đáp án
Xem đáp án
Khi hòa tan khí HCl vào nước ta được dung dịch axit HCl.
Số ptg HCl
Khối lượng dung dịch là:
7,3 + 500 = 507,3 (g)
Câu 147:
Xác định nồng độ % của dung dịch thu được khi hòa tan 25g đồng sunfat ngậm nước (CuSO4.5H2O) vào 175ml nước.
 Xem đáp án
Xem đáp án
Chất tan: CuSO4.
Trong 250g (CuSO4.5H2O)có 160g CuSO4.
Vậy 25g x = 1,6g CuSO4.
Khối lượng 175ml H2O = 175.1=175g
Khối lượng dung dịch thu được: 175 + 25 = 200 (g)
Câu 148:
Hòa tan hoàn toàn 6,66 gam tinh thể Al2(SO4)3.nH2O vào nước thành dung dịch A. Lấy dung dịch A cho tác dụng với dung dịch BaCl2 dư thì thu được 0,699 gam kết tủa. Xác định xt của tinh thể muối sunfat của nhôm ngâm nước.
 Xem đáp án
Xem đáp án
Hòa tan tinh thể Al2(SO4)3.nH2O vào nước ta được dung dịch Al2(SO4)3. Khi cho BaCl2 vào xảy ra phản ứng:
Theo phản ứng ta thấy cứ một mol tinh thể ta có:
(342 + 18n) g tinh thể thu được 3.233 = 699g (kết tủa)
tinh thể thu được 0,699g kết tủa
Ta có tỉ lệ thức:
Giải ra: n = 18
Vậy công thức tinh thể nhôm sunfat ngậm nước là: Al2(SO4)3.18H2O.
Câu 149:
a. Hòa tan 24,4g BaCl2.xH2O vào 175,6g nước thu được dung dịch 10,4%. Tính x.
 Xem đáp án
Xem đáp án
a. Khối lượng BaCl2 nguyên chất:
Số mol BaCl2:
Do đó:
Vậy x = 2. Công thức tinh thể là BaCl2.2H2O.
Câu 150:
b. Cô cạn rất từ từ 20ml dung dịch CuSO4 0,2M thu được 10 gam tinh thể CuSO4.yH2O. Tính y.
 Xem đáp án
Xem đáp án
b. Ta có:
Do đó:
Công thức tinh thể là CuSO4.5H2O.
Câu 151:
 Xem đáp án
Xem đáp án
Số ptg NaOH: 60 : 40 = 1,5 (ptg)
Trong 0,5 lít dung dịch có 1,5 ptg NaOH
1 lít dung dịch có x ptg NaOH:
Theo định nghĩa: CM = 3 (mol/l)
Hoặc có thể áp dụng công thức:
Câu 152:
Xác định nồng độ phân tử gam của dung dịch thu được khi hòa tan 12,5g CuSO4.5H2O vào 87,5ml nước.
 Xem đáp án
Xem đáp án
Chất tan là CuSO4.
Trong 250g CuSO4.5H2O có 160g CuSO4 và 90g H2O.
Vậy 12,5g CuSO4.5H2O có x CuSO4 và y g H2O.
Số ptg CuSO4 là 8 : 160 = 0,05 (ptg)
Thể tích dung dịch bằng thể tích của nước (bao gồm nước hòa tan và nước kết tinh):
hay 0,092 lít
Câu 153:
 Xem đáp án
Xem đáp án
Dung dịch 5%.
Trong 100g dung dịch có 5g muối ăn.
120g dung dịch có x g muối ăn:
(hoặc áp dụng công thức:
Khối lượng nước bằng: 120 – 6 = 114 (g).
Câu 154:
 Xem đáp án
Xem đáp án
Khối lượng dung dịch:
Thể tích dung dịch cần lấy:
Câu 155:
Tính nồng độ % của các dung dịch thu được trong các trường hợp:
a. Hòa tan 4g NaOH vào 200ml dung dịch NaOH (10% (d = 1,1 g.ml).
 Xem đáp án
Xem đáp án
a. Khối lượng của 200ml dung dịch 10%:
m = V.d = 200.1,1 = 220 (g)
Khối lượng NaOH có trong lượng dung dịch trên:
Tổng khối lượng NaOH có trong dung dịch mới:
m2 = 4 + 22 = 26 (g)
Khối lượng của dung dịch mới:
220 + 4 = 224 (g)
Nồng độ % của dung dịch mới:
Câu 156:
b. Hòa tan 56 lít khí amoniac vào 157,5ml nước.
 Xem đáp án
Xem đáp án
b. Số mol của NH3:
Khối lượng của NH3: 2,5.17=42,5 (g)
Khối lượng dung dịch: 157,5 + 42,5 = 200 (g)
Nồng độ %:
Câu 157:
Hòa tan 3,94 gam BaCO3 bằng 500ml dung dịch HCl 0,4M. Cần dùng bao nhiêu ml dung dịch NaOH 0,5M để trung hòa lượng axit dư.
 Xem đáp án
Xem đáp án
Các phản ứng:
Số mol các chất:
Sau phản ứng (1) số mol HCl dư bằng số mol NaOH và bằng:
0,2 – 2.0,02 = 0,16 (mol)
Gọi V là số mol dung dịch NaOH, ta có:
Câu 158:
 Xem đáp án
Xem đáp án
Chất hòa tan là: Na2O.
Chất tan trong dung dịch NaOH: NaOH.
Khối lượng dung dịch:
mdd = 155 + 145 = 300 (g)
Số mol Na2O:
Phương trình phản ứng:
Câu 159:
Hòa tan 2,3 gam natri kim loại vào 197,8 gam nước.
a. Tính nồng độ % dung dịch thu được.
 Xem đáp án
Xem đáp án
a. Số mol Na đã dùng:
Phản ứng xảy ra:
0,1 mol 0,1 mol 0,05 mol
Dung dịch thu được chứa 0,1 mol NaOH, hay:
MNaOH = 0,1.40 = 4(g)
Khối lượng dung dịch thu được:
Vậy
Câu 160:
b. Tính nồng độ mol/l dung dịch thu được (dung dịch có khối lượng riêng d = 1,08 g/ml).
 Xem đáp án
Xem đáp án
b. Thể tích dung dịch thu được:
Câu 161:
 Xem đáp án
Xem đáp án
Số phân tử gam NaOH có trong 200ml dung dịch 0,1M bằng:
0,01.0,2 = 0,002
Số ptg NaOH có trong 50ml dung dịch 1M bằng:
1.0,05 – 0,05
Tổng số ptg NaOH có trong dung dịch thu được:
0,002 + 0,05 = 0,052
Thể tích dung dịch thu được:
200 + 50 = 250ml = 0,25 l
Nồng độ ptg của dung dịch:
Câu 162:
Có 500ml dung dịch HNO3 20% (d = 1,2 g/ml) được làm bay hơi chỉ còn lại 200g dung dịch. Tính nồng độ % của dung dịch sau khi bay hơi.
 Xem đáp án
Xem đáp án
Khối lượng dung dịch HNO3 ban đầu:
500.1,2 = 600 (g)
Khối lượng HNO3 trong dung dịch ban đầu:
Vì làm bay hơi H2O nên khối lượng HNO3 không thay đổi, nồng độ % của dung dịch sau khi bay hơi:
Ghi nhớ: Khi pha loãng bằng nước hay khi làm bay hơi nước dung dịch thì lượng chất tan không thay đổi.
Câu 163:
 Xem đáp án
Xem đáp án
Phân tử khối của MgSO4.7H2O:
24 + 32 + 4.16 + 7.18 = 246 (đvc)
Trong 246g MgSO4.7H2O có 120g MgSO4.
100g MgSO4.7H2O có x g MgSO4.
Vậy khối lượng MgSO4 trong dung dịch là 48,78g.
Trong 100g dung dịch cần pha chế có 3g MgSO4 (3%)
y g dung dịch cần pha chế có 48,78g
Vậy khối lượng dung dịch pha chế được là 1626 gam.
Câu 164:
Tính thể tích nước cần thêm vào 250ml dung dịch HCl 1,25M để tạo thành dung dịch HCl 0,5M (giả sử sự hòa tan không làm thay đổi thể tích dung dịch thu được).
 Xem đáp án
Xem đáp án
Ta gọi dung dịch HCl 1,2M là dd1, dung dịch HCl 0,5M là dd2.
Ta có:
Số mol của chất tan trong 2 dung dịch không đổi nên:
Vậy thể tích nước cần thêm:
Câu 165:
 Xem đáp án
Xem đáp án
Các phản ứng:
Sau phản ứng (1) Ba(OH)2 dư (quỳ tím có màu xanh). Như vậy Ba(OH)2 tác dụng vừa đủ với cả 2 axit.
Do đó ta có:
Hoặc
Rút ra: x = 1 mol/l
Câu 166:
Cho thêm nước vào 400g dung dịch axit clohiđric (HCl) nồng độ 3,65% để tạo thành 2 lít dung dịch. Tính nồng độ phân tử gam của dung dịch thu được.
 Xem đáp án
Xem đáp án
Khối lượng HCl có trong 400g dung dịch 3,65%.
Số phân tử gam HCl:
Vì pha thêm nước nên 0,4 cũng là số phân tử gam HCl có trong 2 lít dung dịch mới.
Vậy nồng độ của dung dịch mới:
Câu 167:
a. Độ tan của muối ăn ở 20oC là 36g. Xác định nồng độ % của dung dịch bão hòa ở nhiệt độ đó.
 Xem đáp án
Xem đáp án
a. Ở 20oC độ tan bằng 36
Cứ 136g dung dịch có 36g muối ăn:
(Hay áp dụng tỉ lệ: (S là độ tan)
)
Câu 168:
b. Nồng độ dung dịch bão hòa muối ăn ở 20oC là 26,5%. Tính độ tan của muối ăn ở cùng nhiêt độ.
 Xem đáp án
Xem đáp án
b. Trong 100g dung dịch bão hòa có 26,5g muối và (100 – 26,5) = 7,5g H2O.
Vậy độ tan
Câu 169:
Phải thêm bao nhiêu gam nước vào 200g dung dịch KOH 20% để được dung dịch KOH 16%?
 Xem đáp án
Xem đáp án
Gọi x là khối lượng nước thêm vào.
Khối lượng KOH trong dung dịch đầu:
Khối lượng dung dịch sau: 200 + x (g).
Khối lượng KOH trong dung dịch sau:
Vì khối lượng chất tan không đổi nên:
Vậy khối lượng nước thêm vào là 50g.
Câu 170:
Hòa tan hoàn toàn 4g MgO bằng dung dịch H2SO4 19,6% (vừa đủ). Tính nồng độ % dung dịch muối tạo thành sau phản ứng.
 Xem đáp án
Xem đáp án
Số mol MgO: 4 : 40 = 0,1 (mol).
Phương trình phản ứng:
1 mol 1 mol 1 mol
0,1 mol 0,1 mol 0,1 mol
Khối lượng H2SO4 đã dùng:
Khối lượng dung dịch sau phản ứng có chứa 0,1 mol MgSO4 hay 0,1 . 120 = 12g MgSO4 là 50 + 4 = 54g.
Nồng độ % dung dịch muối này:
Câu 171:
Cần lấy bao nhiêu gam CaCl2.6H2O để khi hòa tan vào được thì thu được 200ml dung dịch canxi clorua 0% (d = 1,28 g/ml)?
 Xem đáp án
Xem đáp án
Khối lượng dung dịch:
mdd = VD = 200.1,28 = 256 (g)
Khối lượng chất tan CaCl2:
Từ CaCl2.6H2O ta có:
Cứ 100g CaCl2 ứng với 219g CaCl2.6H2O
Vậy 76,8g CaCl2 ứng với x ? g CaCl2.6H2O
CaCl2.6H2O
Câu 172:
Tính lượng tinh thể CuSO4. 5H2O cần dùng để điều chế 500ml dung dịch CuSO4 8% (D = 1,1 g/mol).
 Xem đáp án
Xem đáp án
Khối lượng dung dịch CuSO4 8%: 500.1,1=550 (g)
Khối lượng CuSO4 trong dung dịch:
Từ phản ứng:
160 (g) 250 (g)
44 (g) x (g)
Khối lượng tinh thể cần lấy:
Câu 173:
Để hòa tan 6,3g Zn thì tiêu tốn hết m (g) dung dịch HCl 30%.
a. Tính khối lượng m của dung dịch HCl đã dùng.
 Xem đáp án
Xem đáp án
a. PTHH:
63g 73g 134g 2g
Vậy 6,3g 7,3g 13,4g 0,2g
Khối lượng HCl cần 7,3g
Khối lượng dung dịch HCl 30% cần:
Câu 174:
b. Tính nồng độ % của dung dịch thu được sau phản ứng.
 Xem đáp án
Xem đáp án
b. Khối lượng dung dịch sau phản ứng:
Dung dịch sau phản ứng chỉ có ZnCl2:
Nồng độ % dung dịch thu được sau phản ứng 44%.
Câu 176:
Chất nào sau đây được coi là tinh khiết?
(1) Nước suối.
(2) Nước cất.
(3) Nước khoáng.
(4) Nước đá sản xuất từ nhà máy.
(5) Nước lọc.
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Câu 177:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Câu 181:
Cho các nguyên tử với các thành phần cấu tạo sau:
X (6n; 5p; 5e)
Y (10p; 10p; 10n)
Z (5e; 5p; 5n)
T (11p; 11e; 12n)
Ở đây có bao nhiêu nguyên tố hóa học? Xem đáp án
Xem đáp án
Đáp án đúng là: B
Câu 183:
Cho dãy kí hiệu các nguyên tố sau: O, Ca, N, Fe, S.
Theo thứ tự tên các nguyên tố lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Câu 187:
Câu sau đây gồm hai phần: “ Nước cất là một hợp chất vì nước cất sôi ở đúng 100oC”.
Hãy chọn phương án đúng trong số các phương án sau: Xem đáp án
Xem đáp án
Đáp án đúng là: D
Câu 189:
Từ công thức hóa học Na2CO3 cho biết ý nào đúng:
(1) Hợp chất trên do 3 đơn chất Na, C, O tạo nên.
(2) Hợp chất trên do 3 nguyên tố Na, C, O tạo nên.
(3) Hợp chất trên có PTK = 23 + 12 + 16 = 51.
(4) Hợp chất trên có PTK = . Xem đáp án
Xem đáp án
Đáp án đúng là: D
Câu 190:
Trong các công thức hóa học sau, công thức hóa hoạc nào là của hợp chất:
(1) CH4, K2SO4, Cl2, O3, NH3.
(2) O2, CO2, CaO, N2, H2O2.
(3) H2O, Ca(HCO3)2, Fe(OH)3, CuSO4.
(4) Br2, HBr, CO, Hg, Ni.
(5) PbO, HI, HNO3, Cr2O3, NO. Xem đáp án
Xem đáp án
Đáp án đúng là: B
Câu 191:
Trong các cách viết công thức hóa học sau, cách viết nào đúng:
(1) CH4; H2O2; O3; Ca(OH)2; MgO.
(2) CO; Fe2O2; CuO2; Hg2O; Ag2O.
(3) N2; N2O2; CH3; Cu3(SO4)2; Zn(OH)2.
(4) Fe3O4; Mg(OH)2Cl; Ca(HCO3)2; NaAlO2.
(5) Cr2O; AgOH; NaCl2; K2O; Al2O3. Xem đáp án
Xem đáp án
Đáp án đúng là: D
Câu 192:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Câu 193:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Câu 194:
Cho các chất sau: Cl2; H2SO4; Cu(NO3)2; Al2(SO4)3.
Khối lượng phân tử khối lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Câu 195:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Câu 198:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Đặt công thức hợp chất X là CxOy.
Ta có:
Công thức phân tử của hợp chất là CO2.
Câu 199:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Đặt công thức hợp chất Y là CxHy có phân tử khối MY.
Vì khối lượng mỗi nguyên tố tỉ lệ với thành phần phần trăm khối lượng của nó.
Ta có:
Công thức của Y là C4H10.
Câu 200:
Các hiện tượng sau đây, hiện tam giác nào có sự biến đổi hóa học?
a. Sắt được cắt nhỏ thành từng đoạn và tán thành đinh.
b. Vành xa đạp bằng sắt bị phủ một lớp gỉ là chất màu nâu đỏ.
c. Rượu để lâu trong không khí thường bị chua.
d. Đèn tín hiệu chuyển từ màu xanh sang màu đỏ.
e. Dây tóc trong bóng đèn điện nóng và sáng lên khi dòng điện chạy qua. Xem đáp án
Xem đáp án
Đáp án đúng là: C
Vành xe đạp bằng sắt (màu trắng hơi xám) bị gỉ là hiện tượng hóa học vì có tạo thành chất mới màu nâu đỏ.
Rượu (mùi thơm, vị cay) bị chua là hiện tượng hóa học vì có sự biến đổi thành chất khác vị chua (vị chua là vị của axit axetic).
Câu 201:
Những hiện tượng sau, hiện tượng nào là hiện tượng hóa học?
a. Về mùa hè thức ăn thường bị thiu.
b. Đun đường, đường ngả màu nâu rồi đen đi.
c. Các quả bóng bay trên trời rồi nổ tung.
d. Cháy rừng gây ô nhiễm lớn cho môi trường.
e. Nhiệt độ Trái đất nóng lên làm băng ở hai cực Trái đất tan dần. Xem đáp án
Xem đáp án
Đáp án đúng là: A
Câu 202:
Trong số những quá trình và sự việc dưới đây, đâu là hiện tượng vật lí:
a. Hòa tan muối ăn vào nước ta được dung dịch muối ăn.
b. Có thể lặp lại thí nghiệm với chất vừa dùng để làm thí nghiệm trước đó.
c. Cồn để trong lọ không kín bị bay hơi.
d. Nước bị đóng băng ở hai cực Trái đất.
e. Cho vôi sống CaO hòa tan vào nước.
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Câu 203:
Phản ứng của nguyên tố X với nguyên tố Y được biểu diễn trong sơ đồ dưới đây (nguyên tử X, Y kí hiệu lần lượt là (O) và ).
Phương trình nào dưới đây biểu diễn tốt nhất phản ứng này:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Câu 204:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Giả sử chất đem đốt là a gam.
CTHC: SO2.
Câu 205:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Số nguyên tử C: Số nguyên tử O
Phân tử X có 1 nguyên tử C và 2 nguyên tử O. Công thức phân tử của hợp chất là CO2.
Câu 206:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nguyên tố X với H có công thức XH2 suy ra X có hóa trị II.
Nguyên tố Y với Cl có công thức YCl3 suy ra Y có hóa trị III.
Do đó công thức của X và Y là X3Y2.
Câu 207:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Vì nguyên tố có hóa trị II và oxi cũng có hóa trị II nên công thức hóa học của oxit gồm 1 nguyên tử của nguyên tố đó và 1 nguyên tử oxi. Oxi có nguyên tử khối là 16 đvc. Ta lập luận như sau:
16 đvc bằng 20% khối lượng của phân tử oxit.
Gọi x đvc là nguyên tử khối của nguyên tố đó, x bằng 80% khối lượng của phân tử oxit.
đvc
Nguyên tố có nguyên tử khối bằng 64 là Cu.
Câu 208:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Trước hết tính % khối lượng oxi trong từng oxit.
Câu 209:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- Đầu tiên tính khối lượng từng oxit có trong từng quặng sắt (tính với cùng một lượng quặng sắt, thí dụ chọn 100g).
- Sau tính ra khối lượng sắt ở mỗi trường hợp.
- Kết luận.
Thí dụ: Trong 100 gam quặng hematit có 60g Fe2O3
Câu 210:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Hợp chất giữa Y và oxi có dạng Y2O3.
Vậy Y là Fe.
Câu 211:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Gọi hợp chất hữu cơ là A
Đặt A là CxHy
Ta có:
Chất A là C2H6.
Câu 212:
Một loại quặng sắt chứa 90% Fe3O4. Khối lượng sắt có trong một tấn quặng đó là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Khối lượng Fe3O4 có trong 1 tấn quặng tấn
Trong 232 tấn Fe3O4 có 168 tấn Fe.
Trong 0,9 tấn Fe3O4 có x tấn Fe:
tấn.
Câu 214:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Để có cùng số mol, phải là 0,2.18=3,6g
Để có cùng số mol phải là 0,2.64=12.8g
Câu 215:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Theo đầu bài để có số phân tử O2 = số phân tử CO2
Nghĩa là:
Câu 216:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Câu 217:
Cho biết 400cm3 một chất khí ở đktc có khối lượng 1,143g. Khối lượng mol phân tử của chất khí đó là:
 Xem đáp án
Xem đáp án
Lời giải
Đáp án đúng là: B
Khối lượng của 1 lít khí (1 dm3) tức là khối lượng của chất khí bằng:
Thay giá trị D vào công thức M = 22,4D ta có:
Câu 218:
Cho các chất sau:
a. Fe3O4.
b. KClO3.
c. KMnO4.
d. CaCO3.
e. Không khí.
g. H2O.
Những chất được dùng để điều chế oxi trong phòng thí nghiệm là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Để điều chế oxi trong phòng thí nghiệm (điều chế một lượng nhỏ oxi) cần:
- Dùng hóa chất có chứa oxi để phân hủy thành oxi (phản ứng xảy ra dễ dàng).
- Tiến hành điều chế với dụng cụ đơn giản.
Câu 219:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Câu 220:
Người ta còn thu khí oxi bằng cách đẩy không khí là nhờ dựa vào tính chất:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Câu 222:
Khi phân hủy có xúc tác 122,5g kali clorat KClO3, thể tích khí oxi thu được là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Tỉ lệ mol 2 : 3
Câu 223:
Số gam kali pemanganat KMnO4 cần dùng để điều chế được 2,24l khí oxi (đktc) là:
 Xem đáp án
Xem đáp án
Đáp án D
Tỉ lệ mol 2 : 1
Câu 224:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Những oxit hóa hợp với nước: SO3, Na2O, CaO, CO2.
Oxit hóa hợp với nước tạo thành axit tương ứng:
Oxit hóa hợp với nước tạo bazơ tương ứng:
Câu 225:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Những oxit vừa tác dụng với nước vừa tác dụng với axit chỉ những oxit tương ứng với kiềm tương ứng.
Câu 226:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Dựa vào tính tan của các oxit tạo axit hay dung dịch kiềm và giấy quỳ tím để khẳng định.
Câu 227:
 Xem đáp án
Xem đáp án
Câu 228:
Tỉ lệ khối lượng của nitơ và oxi trong một oxit là 7 : 20. Công thức của oxit là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Câu 229:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Viết phương trình phản ứng của P2O5 tác dụng với nước.
Theo phương trình phản ứng của P2O5 tác dụng với nước và từ đầu bài cho, xác định chất nào tác dụng hết, chất nào còn dư.
Tính khối lượng H3PO4 theo chất tác dụng hết.
Câu 230:
Cho các oxit có công thức hóa học sau: CO2, CO, Mn2O7, SiO2, P2O5, NO2, N2O5, CaO, Al2O3. Các oxit axit được sắp xếp như sau:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Câu 231:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cho giấy quỳ tím vào các mẫu thử đựng các dung dịch trên, mẫu thử nào làm giấy quỳ tím hóa xanh là dung dịch NaOH, quỳ tím hóa đỏ là dung dịch H2SO4.
Đem đun cạn hai mẫu thử còn lại, mẫu thử có cặn trắng là NaCl còn mẫu thử không có cặn trắng là H2O.
Câu 232:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Hóa tan 4 chất vào nước, nhận được MgO không tan
ít tan, vẫn đục như sữa.
Cho giấy quỳ tím vào 2 dung dịch trong suốt, nhận ra dung dịch NaOH làm xanh quỳ tím, H3PO4 làm đỏ quỳ tím.
Câu 233:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phương trình phản ứng:
1 mol 1 mol 1 mol
Theo đầu bài: 0,2 mol 0,125 mol
Qua phương trình trên ta nhận thấy số mol Fe dư, nên tính lượng H2 theo số mol H2SO4.
Câu 235:
Bột nhôm cháy theo phản ứng: Nhôm + khí oxi Nhôm oxit (Al2O3)
Cho biết khối lượng nhôm đã phản ứng là 54g và khối lượng nhôm oxit sinh ra là 102g. Vậy thể tích oxi đã dùng là thể tích nào dưới đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phương trình phản ứng:
Áp dụng định luật bảo toàn khối lượng ta có:
Câu 236:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Phương trình phản ứng đốt cháy chất Y
Áp dụng định luật bảo toàn khối lượng thì 1 mol chất Y phải có 4 mol C và 10 mol H và không chứa oxi. Vậy công thức phân tử của Y là C4H10.
Câu 237:
 Xem đáp án
Xem đáp án
Đáp án A
Số mol lưu huỳnh:
Số mol oxi:
1 mol 1 mol
0,05 mol 0,05 mol
Theo phương trình phản ứng trên ta nhận thấy lưu huỳnh còn dư:
0,1 – 0,05 = 0,05 (mol)
Câu 238:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phương trình phản ứng được biểu diễn như sau:
100g 56g
100T 56T
0,9T x T
x = 0,504T
Câu 239:
Trong các phản ứng hóa học sau, phản ứng nào là phản ứng hóa hợp, phản ứng phân hủy, phản ứng oxi hóa khử, phản ứng thế?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Câu 240:
Trong các phản ứng hóa học sau, phản ứng nào là phản ứng phân hủy?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Câu 241:
 Xem đáp án
Xem đáp án
Câu 245:
Cho sơ đồ phản ứng với các đặc điểm được ghi rõ như sau:
Cho biết phát biểu nào dưới đây là đúng:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Câu 248:
Các phương trình phản ứng sau, phản ứng nào là phản ứng oxi hóa khử?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Câu 249:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
SO2; CO2; Na2O vừa tác dụng với nước, vừa tác dụng với kiềm.
Na2O; CaO; K2O vừa tác dụng với nước, vừa tác dụng với axit.
Câu 250:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
(dung dịch CuCl2 có màu xanh)
Câu 251:
Trong số những chất có công thức hóa học dưới đây, chất nào làm quỳ tím hóa đỏ?
 Xem đáp án
Xem đáp án
Câu 252:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phương trình phản ứng điều chế H2:
Muốn điều chế 1,12 lít khí hiđro thì phải dùng kim loại magie và axit clohiđric. Theo các phương trình phản ứng trên thì khối lượng nguyên tử Mg nhỏ hơn khối lượng kim loại Zn. Khối lượng axit HCl nhỏ hơn khối lượng axit H2SO4.
Câu 253:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Câu 254:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Dẫn hỗn hợp qua dung dịch BaCl2, nếu có kết tủa trắng thì nhận được khí SO3.
Sau đó dẫn hỗn hợp 2 khí còn lại qua dung dịch nước vôi trong dư, nếu có kết tủa thì nhận được khí CO2.
Câu 255:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Nhận biết 6 dung dịch chỉ bằng quỳ tím:
- Hai dung dịch HCl và H2SO4 làm quỳ tím hóa đỏ nhóm (I).
- Hai dung dịch NaOH và Ba(OH)2 làm quỳ tím hóa xanh nhóm (II).
- Hai dung dịch BaCl2 và NaCl không làm quỳ tím đổi màu nhóm (III).
- Lấy dung dịch bất kì nhóm I đổ vào 2 dung dịch nhóm II. Nếu có kết tủa thì nhận ra cặp H2SO4 và BaCl2, cặp còn lại là NaOH và HCl.
- Dùng dung dịch H2SO4 đã nhận biết ở trên đổ vào 2 dung dịch nhóm III, nếu có kết tủa thì đó là dung dịch BaCl2, dung dịch không có phản ứng là NaCl.
Câu 256:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Câu 257:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Câu 262:
Đồng (II) sunfat tan vào nước tạo thành dung dịch có màu xanh lơ. Màu xanh càng đậm nếu nồng độ dung dịch càng cao. Có 4 dung dịch được pha chế như sau (thể tích dung dịch coi bằng thể tích nước).
Dung dịch I: 100ml H2O và 2,4g CuSO4.
Dung dịch II: 300ml H2O và 6,4g CuSO4.
Dung dịch III: 200ml H2O và 3,2g CuSO4.
Dung dịch IV: 400ml H2O và 8,0g CuSO4.
Hỏi: Dung dịch nào có màu xanh đậm nhất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Câu 267:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Vì cùng m nên M càng nhỏ, CM càng lớn.
Câu 268:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Chất tan là Na2CO3.
Câu 269:
 Xem đáp án
Xem đáp án
Đáp án C
nHCl trong 2 lít dung dịch 4M là 2.4 = 8 (mol)
nHCl trong 1 lít dung dịch 0,5M là 1.0,5 = 0,5 (mol)
Tổng số nHCl trong 3 lít sau khi trộn: 8 + 0,5 = 8,5 (mol)
Câu 270:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Khối lượng 10 lít dung dịch sau khi pha:
1,28.10 = 12,8 (kg)
Gọi thể tích nước cần thiết là x lít.
Suy ra khối lượng là x kg.
Gọi thể tích dung dịch axit là y lít.
Suy ra khối lượng là 1,84 kg:
Ta có hệ phương trình: