Giải SBT Hóa học 9 Bài 2: Một số oxit quan trọng
-
2461 lượt thi
-
10 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Kim loại M tác dụng với dung dịch HCl sinh ra khí hiđro. Dẫn khí hiđro đi qua oxit của kim loại N nung nóng. Oxit này bị khử cho kim loại N. M và N là
 Xem đáp án
Xem đáp án
Phương án C. Cặp kim loại kẽm và đồng (M là Zn, N là Cu)
Các phương trình hoá học :
Zn + 2HCl → ZnCl2 + H2
CuO + H2 to→ Cu + H2O
Câu 2:
Canxi oxit tiếp xúc lâu ngày với không khí sẽ bị giảm chất lượng. Hãy giải thích hiện tượng này và minh hoạ bằng phương trình hoá học.
 Xem đáp án
Xem đáp án
CaO là oxit bazơ tác dụng với oxit axit CO2 trong không khí, tạo ra CaCO3 (đá vôi).
Phương trình hóa học
CaO + CO2 → CaCO3
Câu 3:
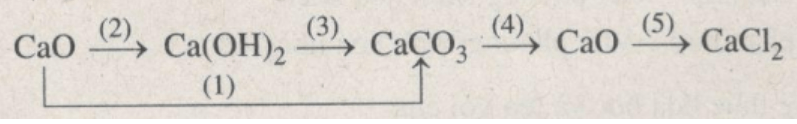
Viết các phương trình hoá học thực hiện những chuyển đổi hoá học theo sơ đồ sau :
 Xem đáp án
Xem đáp án
1. CaO tác dụng với CO2.
CaO + CO2 → CaCO3
2. CaO tác dụng với H2O.
CaO + H2O → Ca(OH)2
3. Ca(OH)2 tác dụng với CO2 hoặc Na2CO3.
Ca(OH)2 + CO2 → CaCO3 + H2O
4. Phân huỷ CaCO3 ở nhiệt độ cao.
CaCO3 → CaO + CO2
5. CaO tác dụng với dung dịch HCl.
CaO + 2HCl → CaCl2 + H2O
Câu 4:
CaO là oxit bazơ, P2O5 là oxit axit. Chúng đều là những chất rắn, màu trắng. Bằng những phương pháp hoá học nào có thể giúp ta nhận biết được mỗi chất trên ?
 Xem đáp án
Xem đáp án
Cho mỗi chất tác dụng với H2O, sau đó thử dung dịch bằng quỳ tím.
CaO tan trong nước tạo ra dung dịch Ca(OH)2 là dung dịch bazơ làm quỳ tím đổi sang màu xanh
P2O5 tan trong H2O tạo ra dung dịch H3PO4 là axit làm quỳ tím đổi sang màu đỏ
CaO + H2O → Ca(OH)2
P2O5 + 3H2O → 2H3PO4
Câu 5:
Một loại đá vôi chứa 80% CaCO3. Nung 1 tấn đá vôi loại này có thể thu được bao nhiêu kg vôi sống CaO, nếu hiệu suất là 85% ?
 Xem đáp án
Xem đáp án
Đáp số : 381 kg CaO
Hướng dẫn:
mCaCO3 = 80/100 x 1000 = 800(kg)
CaCO3 to→ CaO + CO2
Cứ 100kg CaCO3 thì tạo ra 56g CaO
⇒ Với 800kg CaCO3 tạo ra:
mCaO = 800 x 56/100 = 448(kg)
Khối lượng CaO thực tế: mCaO = 448x85/100 = 380,8 (kg)
Câu 6:
Để tôi vôi, người ta đã dùng một khối lượng nước bằng 70% khối lượng vôi sống. Hãy cho biết khối lượng nước đã dùng lớn hơn bao nhiêu lần so với khối lượng nước tính theo phương trình hoá học.
 Xem đáp án
Xem đáp án
Theo phương trình hoá học : 56 kg CaO tác dụng với 18 kg H2O.
Thực tế thì khối lượng H2O dùng để tôi vôi sẽ là : 56x70/100 = 39,2(kg)
Khối lượng nước đã dùng lớn hơn là : 39,2/18 ≈ 2,2 (lần)
Câu 7:
Cho 8 gam lưu huỳnh trioxit (SO3) tác dụng với H2O, thu được 250 ml dung dịch axit sunfuric (H2SO4).
a) Viết phương trình hoá học.
b) Xác định nồng độ mol của dung dịch axit thu được.
 Xem đáp án
Xem đáp án
a) Phương trình hoá học :
SO3 + H2O → H2SO4
b) Nồng độ mol của dung dịch H2SO4 :
nH2SO4 = nSO3 = 8/80 = 0,1 mol
Theo phương trình hoá học :
CMdd H2SO4 = 1000x0,1/250 = 0,4M
Câu 8:
Dẫn 1,12 lít khí lưu huỳnh đioxit (đktc) đi qua 700 ml dung dịch Ca(OH)2 0,1M.
a) Viết phương trình hoá học.
b) Tính khối lượng các chất sau phản ứng.
 Xem đáp án
Xem đáp án
a) Phương trình hoá học :
SO2 + Ca(OH)2 → CaSO3 + H2O
b) Khối lượng các chất sau phản ứng :
Số mol các chất đã dùng :
nSO2 = 1,12/22,4 = 0,05 mol; nCa(OH)2 = 0,1x700/1000 = 0,07 mol
Theo phương trình hoá học, lượng Ca(OH)2 đã dùng dư. Do đó khối lượng các chất sau phản ứng được tính theo lượng SO2.
0,05 mol SO2 tác dụng với 0,05 mol Ca(OH)2 sinh ra 0,05 mol CaSO3 và dư 0,07 - 0,05 = 0,02 (mol) Ca(OH)2 .
Khối lượng các chất sau phản ứng là :
mCaSO3 = 120 x 0,05 = 6 (gam)
mCa(OH)2 = 74 x 0,02 = 1,48 (gam)
Câu 9:
Có các chất sau :
A. CuO ; B. H2; C.CO; D. SO3; E. P2O5 ; G.H2O
Hãy chọn những chất thích hợp trong các chất trên điền vào chỗ trống trong các sơ đồ phản ứng sau :
... + H2O → H2SO4
H2O + ... H3PO4
... + HCl → CuCl2 + H2O
... + H2SO4 → CuSO4 + ...
CuO + ... Cu + H2O
 Xem đáp án
Xem đáp án
1. D. SO3 ; 4. A. CuO, G. H2O
2. E. P2O5 ; 5. B. H2.
3. A. CuO ;
Câu 10:
Nung nóng 13,1 gam một hỗn hợp gồm Mg, Zn, Al trong không khí đến phản ứng hoàn toàn thu được 20,3 gam hỗn hợp gồm MgO, ZnO, Al2O3 Hoà tan 20,3 gam hỗn hợp oxit trên cần dùng V lít dung dịch HCl 0,4M.
a) Tính V.
b) Tính khối lượng muối clorua tạo ra.
 Xem đáp án
Xem đáp án
Ta có sơ đồ chuyển hoá :
Mg, Zn, Al O2→ MgO, ZnO, Al2O3
MgO + 2HCl → MgCl2 + H2O
ZnO + 2HCl → ZnCl2 + H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
MgO, ZnO, Al2O3 HCl→ MgCl2, ZnCl2, AlCl3
a) Ta có khối lượng O2 đã phản ứng : mO2 = 20,3 - 13,1 = 7,2 (g)
Vậy khối lượng oxi trong hỗn hợp oxit là 7,2 gam.
Toàn bộ lượng oxi trong oxit đã chuyển vào H2O nên ta có mO(H2O) = 7,2g
Cứ 1 mol H2O thì chứa 1 mol nguyên tử O ⇒ nH2O = nO = 7,2 : 16 = 0,45 mol
Từ phương trình ta có:
nHCl = 2nH2O = 2.0,45 = 0,9 mol
⇒ VHCl = 0,9/0,4 = 2,25l
b) Bảo toàn khối lượng: moxit + mHCl = mmuối + mH2O
⇒ 20,3 + 0,9.36,5 = mmuối + 0,45.18
⇒ mmuối = 45,05g