Đề thi Hóa 9 giữa kì 1 có đáp án (Đề 2)
-
3357 lượt thi
-
9 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Hãy chọn dãy chất chỉ có oxit bazơ.
 Xem đáp án
Xem đáp án
Đáp án C
Dãy chất chỉ có oxit bazơ là: ZnO, Na2O, CaO.
Câu 2:
Không khí nếu bị ô nhiễm bởi những chất này sẽ gây hiện tượng mưa axit, theo em đó là những chất nào?
 Xem đáp án
Xem đáp án
Đáp án B
Không khí nếu bị ô nhiễm bởi những chất này sẽ gây hiện tượng mưa axit, đó là những chất là: SO3, SO2.
Câu 3:
Có năm chất đựng riêng biệt trong năm ống nghiệm như sau: CaO, SO3, Zn, Ba(OH)2, Ag. Thêm vào mỗi ống một lượng dung dịch H2SO4loãng. Các chất có phản ứng là
 Xem đáp án
Xem đáp án
Đáp án C
Các chất có phản ứng là CaO, Zn, Ba(OH)2.
Phương trình hóa học:
CaO + H2SO4→ CaSO4+ H2O
Zn + H2SO4→ ZnSO4+ H2↑
Ba(OH)2+ H2SO4→ BaSO4↓ + 2H2O.
Câu 4:
Có ba dung dịch đựng trong ba lọ mất nhãn là: NaOH, NaCl, H2SO4. Dùng thuốc thử nào sau đây có thể nhận biết được dung dịch đựng trong mỗi lọ?
 Xem đáp án
Xem đáp án
Đáp án A
- Đánh số thứ tự và trích mẫu thử
- Cho quỳ tím vào 3 mẫu thử:
+ Mẫu làm quỳ tím hóa đỏ là H2SO4
+ Mẫu làm quỳ tím hóa xanh là NaOH
+ Mẫu không làm đổi màu quỳ là NaCl.
Câu 5:
Cho sơ đồ phản ứng sau: NaOH + X → Y + Na2SO4
Biết Y là một chất kết tủa màu xanh lam. Vậy X, Y lần lượt là
 Xem đáp án
Xem đáp án
Đáp án B
Phương trình phản ứng: NaOH + X → Y + Na2SO4
Sản phẩm gồm: Y là một chất kết tủa màu xanh lam và Na2SO4
Suy ra X là CuSO4và Y là Cu(OH)2.
Câu 6:
Hãy chọn câu sai:
 Xem đáp án
Xem đáp án
Đáp án B
Ý B sai vì các nguyên tố dinh dưỡng cho cây trồng gồm:
+ Nhóm đa lượng: N, P, K.
+ Nhóm trung lượng: S, Ca, Mg, Si…
+ Nhóm vi lượng: Mn, Cu, B, Zn, Fe, Mo, Cl…
Câu 7:
Trong quá trình nung vôi, tạo ra rất nhiều khí CO2, SO2. Đây là những khí thải gây ô nhiễm môi trường. Theo em hóa chất nào nên được sử dụng để xử lí các khí thải trên? Giải thích và viết phương trình phản ứng?
 Xem đáp án
Xem đáp án
Trong quá trình nung vôi, tạo ra rất nhiều khí CO2, SO2. Đây là những khí thải gây ô nhiễm môi trường. Hóa chất nên được sử dụng để xử lí các khí thải trên là nước vôi trong.
Giải thích:
Khí CO2, SO2là oxit axit đều tác dụng được với dung dịch nước vôi trong. Dẫn khí thải qua dung dịch nước vôi trong trước khi thải ra môi trường thì các khí có hại này sẽ bị giữ lại không thoát thoát ra ngoài. Hơn nữa nước vôi trong còn là một hóa chất rẻ tiền.
Phương trình hóa học:
CO2+ Ca(OH)2→ CaCO3↓ + H2O
SO2+ Ca(OH)2→ CaSO3↓ + H2O
(CaSO3; CaCO3là các chất kết tủa màu trắng).
Câu 8:
Em hãy viết phương trình phản ứng cho mỗi chuyển đổi hóa học sau:
Na NaCl
NaCl NaOH
NaOH Na2SO3
Na2SO3 Na2SO4
Na2SO4
 Xem đáp án
Xem đáp án
Phương trình hóa học:
(1) 2Na + 2HCl → 2NaCl + H2↑
(2) 2NaCl + 2H2O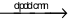 2NaOH + H2+ Cl2
2NaOH + H2+ Cl2
(3) 2NaOH + SO2→ Na2SO3+ H2O
(4) Na2SO3+ H2SO4→ Na2SO4+ SO2↑ + H2O
Câu 9:
Ngâm bột sắt dư trong 600 ml dung dịch HCl. Sau khi phản ứng kết thúc, thu 3,36 lít khí (đktc).
a) Mô tả hiện tượng và viết phương trình hóa học.
b) Tính khối lượng sắt tham gia phản ứng.
c) Tính nồng độ mol của dung dịch axit đã dùng.
d) Để trung hòa hết lượng axit HCl trên cần phải dùng bao nhiêu gam dung dịch NaOH 20%.
Cho biết: Fe = 56, Na = 23, O = 16, H = 1
 Xem đáp án
Xem đáp án
a) Hiện tượng: Fe tan, xuất hiện khí.
Phương trình hóa học:
Fe + 2HCl → FeCl2+ H2(1)
b) Số mol H2là: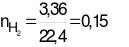 mol
mol
Phương trình phản ứng:

Suy ra mFe= 0,15.56 = 8,4 (g)
c) Theo phương trình phản ứng (1) ta có:
nHCl= 2 = 2.0,15 = 0,3 mol
= 2.0,15 = 0,3 mol
Suy ra = 0,5M
= 0,5M
d) Phương trình phản ứng:

Suy ra mNaOH= 0,3.40 = 12 gam
Vậy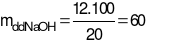 gam.
gam.
