Đề thi Hóa 9 giữa kì 1 có đáp án (Đề 4)
-
3354 lượt thi
-
12 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 2:
Chất nào sau đây được dùng để điều chế SO2trong PTN?
 Xem đáp án
Xem đáp án
Đáp án C
Trong phòng thí nghiệm, SO2 được điều chế bằng cách cho muối sunfit tác dụng với axit mạnh như HCl, H2SO4.
Ví dụ: Phương trình phản ứng:
Na2SO3 + 2HCl → 2NaCl + H2O + SO2
Câu 3:
CaO không phản ứng được với được với chất nào sau đây:
 Xem đáp án
Xem đáp án
Đáp án C
CaO phản ứng được với nước, dd HCl, dd H2SO4.
Phương trình phản ứng:
CaO + H2O → Ca(OH)2
CaO + 2HCl → CaCl2+ H2O
CaO + H2SO4→ CaSO4+ H2O
Câu 4:
Kim loại nào sau đây phản ứng với dung dịch HCl:
 Xem đáp án
Xem đáp án
Đáp án D
Những kim loại tác dụng với HCl là các kim loại đứng trước hiđro trong dãy hoạt động hóa học như Fe, Al, Mg, …
Phương trình phản ứng: 2Al + 6HCl → 2AlCl3+ 3H2
Câu 5:
Ứng dụng nào sau đây không phải là ứng dụng của H2SO4?
 Xem đáp án
Xem đáp án
Đáp án C
Ứng dụng của H2SO4là:
+ Sản xuất phân bón, thuốc trừ sâu, thuốc nhuộm, chất tẩy rửa tổng hợp, ...
+ Dùng trong công nghiệp sản xuất giấy, chất dẻo, tơ sợi
+ Dùng trong chế biến dầu mỏ, công nghiệp luyện kim
+ Sản xuất thuốc nổ, muối, axit
Và rất nhiều ứng dụng quan trọng khác.
Câu 6:
Bazơ nào sau đây dễ bị nhiệt phân hủy?
 Xem đáp án
Xem đáp án
Đáp án C
Phương trình hóa học:
Mg(OH)2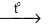 MgO + H2O
MgO + H2O
Câu 7:
Dung dịch NaOH có giá trị pH:
 Xem đáp án
Xem đáp án
Do NaOH là bazơ nên có giá trị pH lớn hơn 7.
Đáp án B
Câu 9:
Cho các oxit sau: Al2O3, MgO, CO, CO2, Fe2O3, NO. Hãy cho biết trong các oxit trên, oxit nào là oxit bazơ, oxit axit, oxit lưỡng tính, oxit trung tính.
 Xem đáp án
Xem đáp án
+ Oxit bazơ (là oxit của kim loại, tương ứng với 1 bazơ) gồm: MgO, Fe2O3.
+ Oxit axit (thường là oxit của phi kim, tương ứng với 1 axit) gồm: CO2
+ Oxit lưỡng tính (là những oxit tác dụng được với cả axit và dung dịch kiềm) gồm: Al2O3
+ Oxit trung tính (còn được gọi là oxit không tạo muối, là những oxit không tác dụng với axit, bazơ, nước) gồm: CO, NO.
Câu 10:
Có những chất: Ba, BaO, BaCO3, Ba(HCO3)2, Ba(OH)2, BaCl2. Dựa vào mối quan hệ giữa các chất, hãy sắp xếp thành một dãy chuyển đổi hóa học. Viết các PTHH.
 Xem đáp án
Xem đáp án
Ba BaO
BaO Ba(OH)2
Ba(OH)2 BaCO3
BaCO3 Ba(HCO3)2
Ba(HCO3)2 BaCl2
BaCl2
Phương trình hóa học:
(1) 2Ba + O2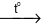 2BaO
2BaO
(2) BaO + H2O → Ba(OH)2
(3) Ba(OH)2+ Na2CO3→ BaCO3↓ + 2NaOH
(4) BaCO3+ H2O + CO2→ Ba(HCO3)2
(5) Ba(HCO3)2+ 2HCl → BaCl2+ 2CO2↑ + 2H2O
Câu 11:
Cho các chất sau: BaO, SO3, Fe3O4. Viết phương trình với:
a) Chất nào tác dụng được với dung dịch HCl?
b) Chất nào tác dụng được với dung dịch Ca(OH)2?
 Xem đáp án
Xem đáp án
a) Chất tác dụng được với dung dịch HCl là: BaO, Fe3O4
Phương trình hóa học:
BaO + 2HCl → BaCl2+ H2O
Fe3O4+ 8HCl → 2FeCl3+ FeCl2+ 4H2O
b) Chất tác dụng được với dung dịch Ca(OH)2là: SO3
Phương trình hóa học: Ca(OH)2+ SO3→ CaSO4+ H2O
Câu 12:
Cho một lượng sắt vào 100 ml dung dịch HCl. Phản ứng xong, thu được 3,36 lít khí (đktc).
a) Viết phương trình hóa học xảy ra.
b) Tính khối lượng Fe đã tham gia phản ứng.
c) Tính nồng độ mol của dung dịch HCl đã dùng.
d) Tính khối lượng muối sắt tạo thành.
(Cho: H = 1; Fe = 56; O = 16; Cl = 35,5)
 Xem đáp án
Xem đáp án
a) Phương trình hóa học:
Fe + 2HCl → FeCl2+ H2↑
b) Số mol H2là: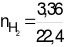 = 0,15 mol
= 0,15 mol
Phương trình phản ứng:

Số mol Fe là: nFe= 0,15 mol
Vậy khối lượng Fe đã tham gia phản ứng là:
mFe= 0,15.56 = 8,4 gam.
c) Phương trình phản ứng:
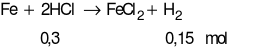
Số mol HCl là: nHCl= 0,3 mol
Vậy nồng độ mol của dung dịch HCl đã dùng là:
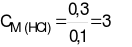 M
M
d) Phương trình phản ứng:
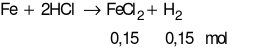
Theo phương trình phản ứng: = 0,15 mol
= 0,15 mol
Vậy khối lượng FeCl2là: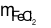 = 0,15.127 = 19,05 gam.
= 0,15.127 = 19,05 gam.
