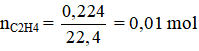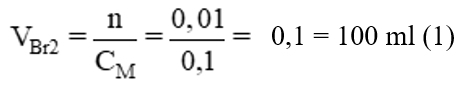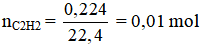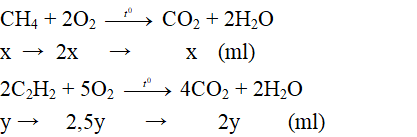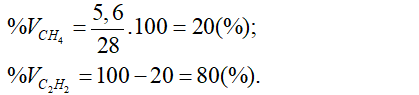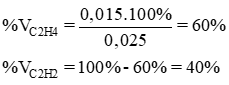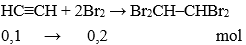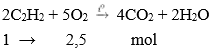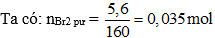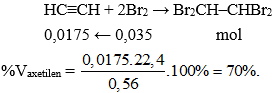Bài 38: Axetilen
-
5561 lượt thi
-
15 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Hãy cho biết trong các chất sau:
CH3 – CH3 ; CH≡ CH; CH2 = CH2; CH4; CH≡ C – CH3.
a) Chát nào có liên kết ba trong phân tử?
b) Chất nào làm mất màu dung dịch brom?
 Xem đáp án
Xem đáp án
a) Có hai chất: CH≡ CH và CH≡ C – CH3 có liên kết ba.
b) Có ba chất làm mất màu dung dịch brom: CH≡ CH; CH2 = CH2 và CH≡ C – CH3.
Câu 2:
Cần bao nhiêu ml dung dịch brom 0,1M để tác dụng vừa đủ với:
a) 0,224 lít etilen ở điều kiện tiêu chuẩn.
b) 0,224 lít axetilen ở điều kiện tiêu chuẩn.
 Xem đáp án
Xem đáp án
a)
C2H4 + Br2 → C2H4Br2
1 mol 1 mol 1 mol
0,01 mol ?
Theo pt: nBr2 = nC2H4 = 0,01 mol →
b)
С2H2 + 2Вr2 → C2H2Br4
1mol 2 mol 1 mol
0,01 mol ?
nBr2 = 2. nС2H2 = 0,02 (mol) →
Câu 3:
Biết rằng 0,1 lít khí etilen (đktc) làm mất màu 50ml dung dịch brom. Nếu dùng 0,1 lít khí axetilen (đktc) thì có thể làm mất màu bao nhiêu ml dung dịch brom trên?
 Xem đáp án
Xem đáp án
Phương trình phản ứng:
C2H4 + Br2 → C2H4Br2. (1)
C2H2 + 2Br2 → C2H2Br4. (2)
Từ phương trình (1) và (2) ta nhận thấy:
Tỉ lệ nC2H4 : nBr2 = 1:1
nC2H2 : nBr2 = 1:2
⇒ Số mol brom phản ứng tối đa với C2H2 gấp 2 lần C2H4 nên thể tích dung dịch brom cần dùng khi phản ứng với C2H2 cũng gấp 2 lần khi phản ứng với C2H4
VBr2 cần dung khi phản ứng với 0,1 l axeilen là: 50ml × 2 = 100ml.
Câu 4:
Đốt cháy 28ml hỗn hợp khí metan và axetilen cần phải dùng 67,2ml khí oxi.
a) Tính phần trăm thể tích của mỗi khí trong hỗn hợp.
b) Tính thể tích khí CO2 sinh ra.
(Các thể tích khí đo ở cùng điều kiện nhiệt độ và áp suất)
 Xem đáp án
Xem đáp án
Do các thể tích khí được đo ở cùng điều kiện nhiệt độ và áp suất nên tỉ lệ về thể tích cũng chính là tỉ lệ về số mol.
Gọi thể tích metan (CH4) là x (ml); thể tích axetilen (C2H2) là y (ml)
Theo bài ra: Vhh khí = 28 (ml)
→ x + y = 28 (1)
Phương trình phản ứng:
Theo bài ra thể tích khí oxi là 67,2 ml
→ 2x + 2,5y = 67,2 ml (2)
Từ (1) và (2) giải hệ phương trình được: x = 5,6 (ml) và y = 22,4 (ml).
a/ Phần trăm thể tích từng khí là:
b/ Theo phương trình phản ứng ở trên có:
Thể tích khí CO2 = x + 2y = 5,6 + 2.22,4 = 50,4 (ml).
Câu 5:
Cho 0,56 lít (đktc) hỗn hợp khí gồm C2H4, C2H2 tác dụng hết với dung dịch brom dư, lượng brom đã tham gia phản ứng là 5,6g
a) Hãy viết phương trình hóa học.
b) Tính phần trăm thể tích của mỗi khí trong hỗn hợp.
 Xem đáp án
Xem đáp án
a) Phương trình hóa học:
C2H4 + Br2 → C2H4Br2 (1)
C2H2 + 2Br2 → C2H2Br4 (2)
Gọi nC2H4 = x mol, nC2H2 = y.
nhh khí = x + y = 0,025.
Theo pt: nBr2(1) = nC2H4 = x mol, nBr2 (2) = 2. nC2H2= 2.y mol
⇒ nBr2 = x + 2y = 0,035.
b) Phần trăm thể tích mỗi khí:
Giải hệ phương trình ta có x = 0,015, y = 0,01.
Câu 10:
Một hiđrocacbon ở thể khí thường được dùng làm nhiên liệu để hàn cắt kim loại, đó là
 Xem đáp án
Xem đáp án
Đáp án: C
Câu 12:
Dẫn 0,1 mol khí axetilen qua bình đựng dung dịch nước brom dư. Khối lượng brom tham gia phản ứng là
 Xem đáp án
Xem đáp án
Đáp án: D
→ mBrom pư = 0,2.160 = 32 gam.
Câu 13:
Thể tích không khí cần dùng để đốt cháy hoàn toàn 1 mol axetilen là (các khí đo ở đktc, biết rằng oxi chiếm 20% thể tích không khí) ?
 Xem đáp án
Xem đáp án
Đáp án: B
→ VO2 pư = 2,5.22,4 = 56 lít → Vkk = 56.5 = 280 lít.
Câu 14:
Trong điều kiện thích hợp 1 mol khí axetilen tác dụng hoàn toàn với 2 mol khí hiđro, thu được chất khí là
 Xem đáp án
Xem đáp án
Đáp án: B
C2H2 + 2H2 → C2H6
Câu 15:
Cho 0,56 lít (đktc) hỗn hợp khí metan và axetilen tác dụng với dung dịch brom dư, lượng brom đã tham gia phản ứng là 5,6 gam. Thành phần phần trăm về thể tích của axetilen trong hỗn hợp ban đầu lần lượt là
 Xem đáp án
Xem đáp án
Đáp án: B
Cho hỗn hợp khí qua dung dịch brom dư chỉ có axetilen phản ứng