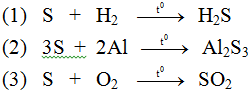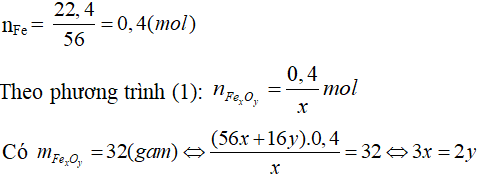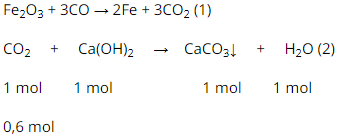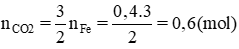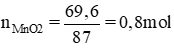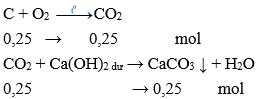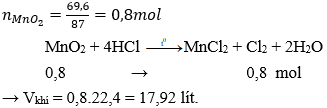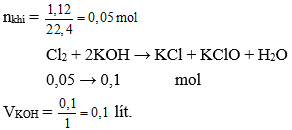Giải SGK Hóa học 9 Chương 3: Phi kim. Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Bài 32: Luyện tập chương 3: Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hóa học:
-
5039 lượt thi
-
21 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 3:
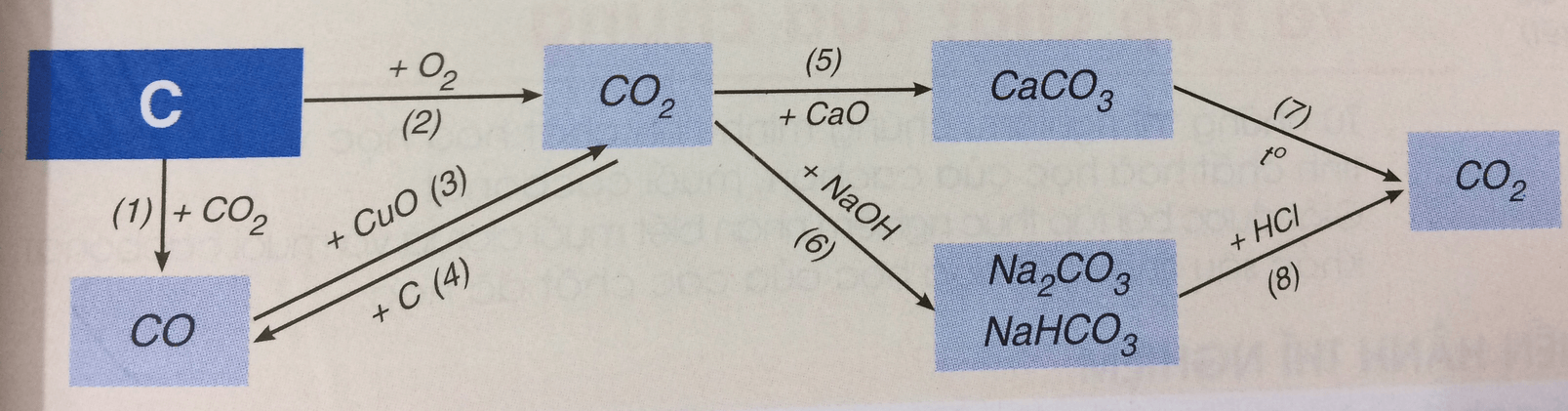
Hãy viết các phương trình hóa học biểu diễn tính chất hóa học của cacbon và một số hợp chất của nó theo sơ đồ 3. Cho biết vai trò của cacbon trong phản ứng đó.
 Xem đáp án
Xem đáp án
PTHH biểu diễn tính chất hóa học của cacbon và một số hợp chất khác:
(1) C(r) + CO2 (k) 2CO(k)
(2) C(r) + O2 (k) CO2
(3) CO + CuO 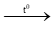
(4) CO2 (k) + C(r) 2CO(k)
(5) CO2 (k) + CaO(r) CaCO3 (r)
(6) CO2(k) + 2NaOH(dd) dư → Na2CO3 (r) + H2O(l)
CO2 (k) + NaOH (dd) đủ → NaHCO3
(7) CaCO3 (r) CaO(r) + CO2 (k)
(8) Na2CO3(r) + 2HCl(dd) → 2NaCl(dd) + CO2(k)↑ + H2O(l)
NaHCO3 (r) + HCl (dd) → NaCl(dd) + CO2(k) + H2O(l)
Vai trò của C trong phản ứng (1), (2) và (4) là chất khử (chất chiếm oxi).
Câu 4:
Nguyên tố A có số hiệu nguyên tử là 11, chu kì 3, nhóm I trong bảng hệ thống tuần hoàn. Hãy cho biết:
– Cấu tạo nguyên tử của A.
– Tính chất hóa học đặc trưng của A.
– So sánh tính chất hóa học của A với các nguyên tố lân cận.
 Xem đáp án
Xem đáp án
a) Cấu tạo nguyên tử của A:
Số hiệu nguyên tử của A là 11 cho biết: natri ở ô số 11, điện tích hạt nhân nguyên tử natri là 11+ có 11 electron trong nguyên tử natri, ở chu kì 3, nhóm I.
b) Tính chất hóa học đặc trưng của natri:
Nguyên tố natri ở đầu chu kì là hai kim loại mạnh, tròn phản ứng hóa học, natri là chất khử mạnh.
Tác dụng với phi kim:
4Na + O2 → 2Na2O
2Na + Cl2 → 2NaCl
Tác dụng với dung dịch axit:
2Na + 2HCl → 2NaCl + H2 ↑
Tác dụng với nước: Nguyên tố Na ngoài tính chất hóa học chung của kim loại còn có tính chất hóa học đặc trưng là tác dụng với H2O ở nhiệt độ thường.
2Na + 2H2O → 2NaOH + H2 ↑
Tác dụng với dung dịch muối: Na + dung dịch CuSO4
2Na + 2H2O → 2NaOH +H2 ↑
2NaOH + CuSO4 → Cu(OH)2 ↓ +Na2SO4
c) So sánh tính chất hóa học của Na với các nguyên tố lân cận:
Na có tính chất hóa hoc mạnh hơn Mg (nguyên tố sau Na), mạnh hơn Li (nguyên tố trên Na) nhưng yếu hơn K (nguyên tố dưới Na).
Câu 5:
a) Hãy xác định công thức của một loại oxit sắt, biết rằng khi cho 32g oxit sắt này tác dụng hoàn toàn với khí cacbon oxit thì thu được 22,4g chất rắn.
Biết khối lượng mol của oxit sắt là 160 gam.
b) Chất khí sinh ra được hấp thụ hoàn toàn trong dung dịch nước vôi trong có dư. Tính khối lượng kết tủa thu được.
 Xem đáp án
Xem đáp án
a) Gọi công thức của oxit sắt là: FexOy
PTHH:
Do đó x : y = 2 : 3.
Vậy CTHH của oxit sắt: Fe2O3.
b) Khí sinh ra CO2
PTHH:
Theo pt (1) :
Theo pt (2) ⇒ nCaCO3 = nCO2 = 0,6 (mol)
mCaCO3 = 0,6.100 = 60 (g).
Câu 6:
Cho 69,6g MnO2 tác dụng với dung dịch HCl đặc dư thu được một lượng khí X. Dẫn khí X vào 500ml dung dịch NaOH 4M thu được dung dịch A. Tính nồng độ mol của các chất trong dung dịch A. Giả thiết rằng thể tích dung dịch sau phản ứng thay đổi không đáng kể.
 Xem đáp án
Xem đáp án
VNaOH = 500ml = 0,5 lít ⇒ nNaOH = CM. V= 0,5 x 4 = 2 mol.
Phương trình phản ứng:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O.
Theo pt: nCl2 = nMnO2 = 0,8 mol.
Cl2 + 2NaOH → NaCl + NaClO + H2O.
Ta có tỉ lệ: 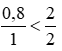
Theo pt: nNaCl = nNaClO = nCl2 = 0,8 mol.
CM(NaCl)= CM(NaClO) = = 1,6 mol/l.
Theo pt: nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6mol.
CM(NaOH) dư = 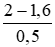
Câu 7:
Nguyên tố X có hiệu số nguyên tử là 9. Điều khẳng định nào sau đây không đúng ?
 Xem đáp án
Xem đáp án
Đáp án: D
Câu 8:
Cặp chất tác dụng được với dung dịch KOH là
 Xem đáp án
Xem đáp án
Đáp án: B
SO2 và SO3 là các oxit axit nên tác dụng được với dung dịch KOH
Phương trình hóa học:
SO2 + 2KOH → K2SO3 + H2O
SO3 + 2KOH → K2SO4 + H2O
Câu 9:
Chất khí nào sau đây có thể gây chết người vì ngăn cản sự vận chuyển oxi trong máu ?
 Xem đáp án
Xem đáp án
Đáp án: A
Câu 10:
Khi dẫn khí clo vào cốc đựng nước, sau đó cho vào cốc 1 mẩu quỳ tím. Hiện tượng xảy ra là
 Xem đáp án
Xem đáp án
Đáp án: D
Câu 11:
Phản ứng giữa Cl2 và dung dịch NaOH ở điều kiện thường dùng để điều chế
 Xem đáp án
Xem đáp án
Đáp án: B
Câu 12:
Trong thực tế, người ta có thể dùng cacbon để khử oxit kim loại nào trong số các oxit kim loại dưới đây để sản xuất kim loại ?
 Xem đáp án
Xem đáp án
Đáp án: D
Cacbon khử được oxit của những kim loại đứng sau nhôm trong dãy hoạt động hóa học
Câu 13:
Trong các chất sau chất nào có thể tham gia phản ứng với clo ?
 Xem đáp án
Xem đáp án
Đáp án: B
Cl2 + 2KOH → KCl + KClO + H2O
Câu 14:
Khí CO lẫn tạp chất là CO2 và SO2 có thể làm sạch CO bằng cách dẫn mẫu khí trên qua
 Xem đáp án
Xem đáp án
Đáp án: B
Dẫn hỗn hợp khí qua dung dịch Ca(OH)2 dư. Khí SO2 và CO2 phản ứng bị giữ lại, khí CO không phản ứng thoát ra khỏi dung dịch thu được CO tinh khiết.
SO2 + Ca(OH)2 → CaSO3 ↓ + H2O
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
Câu 15:
Đốt cháy hoàn toàn 3 gam C thành CO2. Cho toàn bộ sản phẩm hấp thụ vào dung dịch nước vôi trong dư. Khối lượng kết tủa tạo thành là
 Xem đáp án
Xem đáp án
Đáp án: B
Ta có: nC = 3 : 12 = 0,25 mol
Khối lượng kết tủa: m = 0,25.100 = 25 gam.
Câu 16:
Cho 69,6 gam MnO2 tác dụng với dung dịch HCl đặc, nóng, dư. Thể tích khí ở điều kiện tiêu chuẩn thu được là
 Xem đáp án
Xem đáp án
Đáp án: C
Câu 17:
Thể tích của dung dịch KOH 1M ở điều kiện thường cần dùng để tác dụng hoàn toàn với 1,12 lít khí Cl2 (đktc) là
 Xem đáp án
Xem đáp án
Đáp án: D
Câu 18:
Một nguyên tố X ở ô thứ 12 trong bảng tuần hoàn. Điện tích hạt nhân nguyên tử X là
 Xem đáp án
Xem đáp án
Đáp án: B