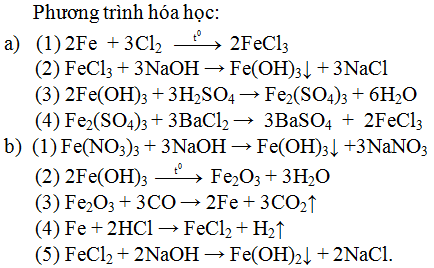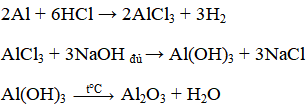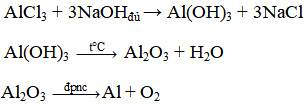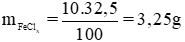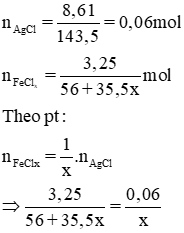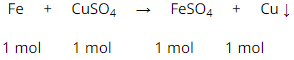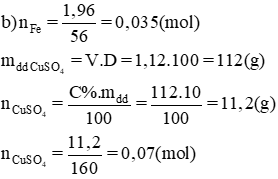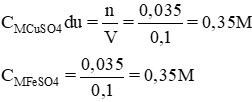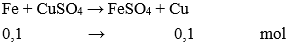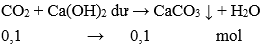Bài 24: Ôn tập học kì 1
-
4974 lượt thi
-
22 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 2:
Cho bốn chất sau: Al, AlCl3, Al(OH)3, Al2O3. Hãy sắp xếp bốn chất này thành hai dãy chuyển hóa (mỗi dãy đều gòm 4 chất) và viết các phương trình hóa học tương ứng để thực hiện dãy chuyển hóa đó.
 Xem đáp án
Xem đáp án
Các dãy chuyển hóa có thể có:
Dãy biến hóa 1: Al → AlCl3 → Al(OH)3 → Al2O3
PTHH:
Dãy biến hóa 2: AlCl3 → Al(OH)3 → Al2O3 → Al
PTHH:
Câu 3:
Có ba kim loại là nhôm, bạc, sắt. Hãy nêu phương pháp hóa học để nhận biết từng kim loại. Các dụng cụ hóa chất coi như có đủ. Viết các phương trình hóa học để nhận biết ba kim loại.
 Xem đáp án
Xem đáp án
Trích mẫu thử và đánh số thứ tự:
– Nhỏ dung dịch NaOH lần lượt vào 3 ống nghiệm chứa 3 kim loại trên
+ Kim loại nào tác dụng và có bọt khí bay lên là Al
+ 2 kim loại còn lại (Fe, Ag) không tác dụng.
PTHH: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 ↑
- Cho dung dịch HCl vào hai kim loại Fe và Ag:
+ Kim loại nào tác dụng và có khí bay lên là Fe
+ Kim loại nào không tác dụng là Ag.
PTHH: Fe + 2HCl → FeCl2 + H2 ↑
Câu 4:
Axit H2SO4 loãng phản ứng với tất cả các chất trong dãy chất nào dưới đây:
 Xem đáp án
Xem đáp án
Axit H2SO4 loãng phản ứng được với dãy chất: Al, Al2O3, Fe(OH)2, BaCl2 hay D đúng.
Đáp án A loại Cu, FeCl3
Đáp án B loại Ag
Đáp án C loại NaCl
Câu 5:
Dung dịch NaOH có phản ứng với tất cả các chất trong dãy nào sau đây:
 Xem đáp án
Xem đáp án
Dung dịch NaOH phản ứng được với dãy chất: H2SO4, SO2, CO2, FeCl2 hay B đúng.
Đáp án A loại CuO
Đáp án C loại KNO3
Đáp án D loại MgO, BaCl2.
Câu 6:
Sau khi làm thí nghiệm có những khí độc hại sau: HCl, H2S, CO2, SO2. Có thể dùng chất nào sau đây để loại bỏ chúng là tốt nhất?
 Xem đáp án
Xem đáp án
Dùng phương án A, nước vôi trong là tốt nhất, vì nước vôi trong có phản ứng với tất cả các chất khí thải tạo thành chất kết tủa hay dung dịch.
Ca(OH)2 + 2HCl → CaCl2 + 2H2O.
H2S + Ca(OH)2 dư → CaS ↓ + 2H2O.
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O.
SO2 + Ca(OH)2 → CaSO3 ↓ + H2O.
Câu 7:
Bạc (dạng bột) có lẫn tạp chất đồng, nhôm. Dùng phương pháp hóa học để thu được bạc tinh khiết.
 Xem đáp án
Xem đáp án
Cho hỗn hợp vào dung dịch AgNO3 dư, đồng và nhôm sẽ phản ứng, kim loại thu được là Ag.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag ↓
Al + 3AgNO3 → Al(NO3)3 + 3Ag ↓
Câu 8:
Trong phòng thí nghiệm, người ta làm khô các khí ẩm bằng cách dẫn khí này đi qua các bình có đựng các chất háo nước nhưng không có phản ứng với khí cần làm khô. Có các chất làm khô sau: H2SO4 đặc, CaO. Dùng hóa chất nào nói trên để làm khô mỗi khí ẩm sau đây: khí SO2, khí O2, khí CO2. Hãy giải thích sự lựa chọn đó.
 Xem đáp án
Xem đáp án
Có thể dùng H2SO4 đặc để làm khô các khí ẩm: SO2, CO2, O2 vì H2SO4 đặc có tính háo nước và không phản ứng với các khí này.
CaO khan có thể làm khô khí ẩm O2 vì không phản ứng với oxi nhưng CaO khan không dùng để làm khô khí ẩm SO2 và khí ẩm CO2 vì CaO khan tác dụng với khí ẩm SO2, CO2. Có thể xảy ra các phản ứng sau:
CaO + H2O → Ca(OH)2
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
SO2 + Ca(OH)2 → CaSO3 ↓ + H2O
Hoặc CaO + SO2 → CaSO3
CO2 + CaO → CaCO3
Câu 9:
Cho 10g dung dịch muối sắt clorua 32,5% tác dụng với dung dịch bạc nitrat dư thì tạo thành 8,61g kết tủa. Hãy tìm công thức hóa học của muối sắt đã dùng.
 Xem đáp án
Xem đáp án
Gọi hóa trị của sắt trong muối là x.
Phương trình phản ứng hóa học:
FeClx + xAgNO3 → xAgCl ↓ + Fe(NO3)x
Giải ra ta có x = 3. Vậy công thức hóa học của muối sắt clorua là FeCl3.
Câu 10:
Cho 1,96g bột sắt vào 100ml dung dịch CuSO4 10% có khối lượng riêng là 1,12 g/ml.
a) Viết phương trình hóa học.
b) Xác định nồng độ mol của chất trong dung dịch khi phản ứng kết thúc. Giả thiết rằng thể tích của dung dịch sau phản ứng thay đổi không đáng kể.
 Xem đáp án
Xem đáp án
a) PTHH:
Ta có tỉ lệ: 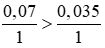
Theo pt nCuSO4 pư = nFeSO4 = 0,035 mol
⇒ nCuSO4 dư = 0,07 – 0,035 = 0,035 (mol)
Vdd = 100ml = 0,1 lít
Câu 13:
Cho 5,6g sắt vào dung dịch đồng sunfat dư. Khối lượng đồng thu được là:
 Xem đáp án
Xem đáp án
Đáp án: A
nFe = 5,6 : 56 = 0,1 mol
mCu = 0,1.64 = 6,4 gam.
Câu 15:
Có các chất đựng riêng biệt trong mỗi ống nghiệm sau đây: Al, Fe, CuO, FeSO4, H2SO4. Lần lượt cho dung dịch NaOH vào mỗi ống nghiệm trên. Dung dịch NaOH phản ứng với:
 Xem đáp án
Xem đáp án
Đáp án: A
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2
FeSO4 + 2NaOH → Fe(OH)2 ↓ + Na2SO4
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Câu 16:
Kim loại X có những tính chất hóa học sau:
- Phản ứng với oxi khi nung nóng.
- Phản ứng với dung dịch AgNO3.
- Phản ứng với dung dịch H2SO4 loãng giải phóng khí H2 và muối của kim loại hóa trị II. Kim loại X là:
 Xem đáp án
Xem đáp án
Đáp án: B
A loại vì Cu không phản ứng với H2SO4 loãng
C loại vì Al có hóa trị III trong hợp chất
D loại vì Na có hóa trị I trong hợp chất
Câu 17:
Dãy chất gồm các oxit bazơ là:
 Xem đáp án
Xem đáp án
Đáp án: B
Oxit bazơ là hợp chất tạo bởi kim loại và oxi → B đúng.
Câu 18:
Có một mẫu Fe bị lẫn tạp chất là nhôm, để làm sạch mẫu sắt này bằng cách ngâm nó với:
 Xem đáp án
Xem đáp án
Đáp án: A
Ngâm hỗn hợp kim loại vào dung dịch NaOH dư
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2
Lọc lấy kim loại, rửa sạch được mẫu sắt tinh khiết.
Câu 19:
Dãy phi kim tác dụng với oxi tạo thành oxit axit là:
 Xem đáp án
Xem đáp án
Đáp án: A
Chú ý: Cl2; Br2 không phản ứng trực tiếp với oxi.
Câu 20:
Cho 2,24 lít CO2 (đktc) tác dụng với dung dịch Ca(OH)2 dư. Khối lượng chất kết tủa thu được là:
 Xem đáp án
Xem đáp án
Đáp án: A
Số mol CO2 = 2,24 : 22,4 = 0,1 mol
Khối lượng kết tủa là: m = 0,1.100 = 10 gam.
Câu 21:
Nhóm chất tác dụng với dung dịch H2SO4 loãng sinh ra chất kết tủa màu trắng:
 Xem đáp án
Xem đáp án
Đáp án: C
Chất kết tủa màu trắng là BaSO4.
Câu 22:
Dung dịch A có pH < 7 và tạo ra kết tủa khi tác dụng với dung dịch Bari nitrat Ba(NO3)2. Chất A là:
 Xem đáp án
Xem đáp án
Đáp án: C
Dung dịch A có pH < 7 nên là axit → Loại B và D
A tác dụng với Ba(NO3)2 thu được kết tủa trắng → A là H2SO4