Nitric acid
-
682 lượt thi
-
20 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Dãy gồm tất cả các chất khi tác dụng với HNO3 mà HNO3 chỉ thể hiện tính axit là :
 Xem đáp án
Xem đáp án
Trả lời:
HNO3 chỉ thể hiện tính axit là không có phản ứng oxi hóa – khử =>các chất đều đã đạt số oxi hóa tối đa
Đáp án cần chọn là: C
Câu 2:
Để nhận biết ion NO3- người ta thường dùng Cu và dung dịch H2SO4 loãng và đun nóng, bởi vì :
 Xem đáp án
Xem đáp án
Trả lời:
Để nhận biết ion NO3- người ta thường dùng Cu và dung dịch H2SO4 loãng và đun nóng, bởi vì tạo ra khí không màu, hoá nâu trong không khí.
Đáp án cần chọn là: D
Câu 3:
Khi cho kim loại Fe phản ứng với HNO3 tạo thành khí độc hại. Biện pháp nào xử lý tốt nhất để chống ô nhiễm môi trường ?
 Xem đáp án
Xem đáp án
Trả lời:
Khí sinh ra là NO2 =>cần dung dịch kiềm để hấp thụ =>nút ống nghiệm bằng bông tẩm xút.
Đáp án cần chọn là: D
Câu 4:
Trong phòng thí nghiệm HNO3 được điều chế theo phản ứng sau :
NaNO3 (rắn) + H2SO4(đặc) → HNO3 + NaHSO4
Phản ứng trên xảy ra là vì :
 Xem đáp án
Xem đáp án
Trả lời:
Vì HNO3 dễ bay hơi =>làm giảm lượng HNO3 trong bình =>phản ứng làm tăng lượng HNO3 (chiều thuận)
Đáp án cần chọn là: B
Câu 5:
Thí nghiệm với dung dịch HNO3 thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, người ta nút ống nghiệm bằng
(a) bông khô
(b) bông có tẩm nước
(c) bông có tẩm nước vôi trong
(d) bông có tẩm giấm ăn
Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là:
 Xem đáp án
Xem đáp án
Trả lời:
Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là dùng bông có tẩm nước vôi trong để nút vào ống nghiệm.
2Ca(OH)2 + 4NO2 → Ca(NO3)2 + Ca(NO2)2 + 2H2O
Đáp án cần chọn là: D
Câu 6:
Những kim loại nào sau đây không tác dụng được với dung dịch HNO3 đặc, nguội
 Xem đáp án
Xem đáp án
Trả lời:
Al, Fe là những kim loại bị thụ động với HNO3 đặc nguội
Đáp án cần chọn là: A
Câu 7:
Cho sơ đồ phản ứng :
FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO + H2O
Sau khi cân bằng, hệ số cân bằng của HNO3 trong phản ứng là :
 Xem đáp án
Xem đáp án
Trả lời:
Coi Fe và S ban đầu có trong chất có số oxi hóa là 0
\[\mathop {Fe}\limits^0 {S_2} + H\mathop N\limits^{ + 5} {O_3} \to \mathop {Fe}\limits^{ + 3} {\left( {N{O_3}} \right)_3} + {H_2}\mathop S\limits^{ + 6} {O_4} + \mathop N\limits^{ + 2} O\]
\[1.\left| {\mathop {Fe}\limits^0 {S_2}} \right. \to \mathop {Fe}\limits^{ + 3} + 2\mathop S\limits^{ + 6} + 15e\]
\[5.\left| {\mathop N\limits^{ + 5} } \right. + 3e \to \mathop N\limits^{ + 2} \]
=>PTHH: FeS2 + 8HNO3 → Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
=>hệ số của HNO3 là 8
Đáp án cần chọn là: D
Câu 8:
HNO3 chỉ thể hiện tính oxi hóa khi tác dụng với các chất thuộc dãy nào dưới đây?
 Xem đáp án
Xem đáp án
Trả lời:
A đúng
B loại CuO, CaCO3
C loại CaO
D loại Fe2O3
Đáp án cần chọn là: A
Câu 9:
Cho 20 gam Fe tác dụng với HNO3 loãng thu được sản phẩm khử duy nhất NO. Sau khi phản ứng xảy ra hoàn toàn còn dư 3,2 gam Fe. Thể tích NO thu được ở đktc là :
 Xem đáp án
Xem đáp án
Trả lời:
Do Fe dư nên tạo thành muối Fe2+
nFe = (20 – 3,2)/56 = 0,3 mol
BTe ta có: 2nFe = 3nNO =>nNO = 2.0,3/3 = 0,2 mol
=>V = 4,48 lít
Đáp án cần chọn là: C
Câu 10:
Tỉ lệ số phân tử HNO3 đóng vai trò chất oxi hóa và môi trường trong phản ứng sau là :
FeO + HNO3 → Fe(NO3)3 + NO + H2O
 Xem đáp án
Xem đáp án
Trả lời:
\[\mathop {Fe}\limits^{ + 2} O + H\mathop N\limits^{ + 5} {O_3} \to \mathop {Fe}\limits^{ + 3} {\left( {N{O_3}} \right)_3} + \mathop N\limits^{ + 2} O + {H_2}O\]
\[3.\left| {\mathop {Fe}\limits^{ + 2} } \right. \to \mathop {Fe}\limits^{ + 3} + 1e\]
\[1.\left| {\mathop N\limits^{ + 5} } \right. + 3e \to \mathop N\limits^{ + 2} \]
=>PTHH: 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
=>trong 10 phân tử HNO3 phản ứng, có 1 phân tử là chất oxi hóa tạo NO, 9 phân tử làm môi trường tạo muối Fe(NO3)3
Đáp án cần chọn là: C
Câu 11:
Cho sơ đồ phản ứng : Al + HNO3 → Al(NO3)3 + N2 + N2O + H2O
Biết khi cân bằng tỉ lệ số mol giữa N2O và N2 là 3 : 2. Tỉ lệ mol nAl : nN2O : nN2 lần lượt là
 Xem đáp án
Xem đáp án
Trả lời:
\[\mathop {Al}\limits^0 + H\mathop N\limits^{ + 5} {O_3} \to \mathop {Al}\limits^{ + 3} {\left( {N{O_3}} \right)_3} + \mathop {{N_2}}\limits^0 + \mathop {{N_2}}\limits^{ + 1} O + {H_2}O\]
\[44.\left| {\mathop {Al}\limits^0 } \right. \to \mathop {Al}\limits^{ + 3} + 3e\]
\[3.\left| {10\mathop N\limits^{ + 5} } \right. + 44e \to 3{\mathop N\limits^{ + 1} _2}O + 2{\mathop N\limits^0 _2}\]
=>PTHH: 44Al + 162HNO3 → 44Al(NO3)3 + 6N2 + 9N2O + 81H2O
Đáp án cần chọn là: D
Câu 12:
Cho 0,05 mol Mg phản ứng vừa đủ với HNO3 giải phóng ra V lít khí N2 (đktc, là sản phẩm khử duy nhất). Giá trị của V là
 Xem đáp án
Xem đáp án
Trả lời:
Quá trình cho – nhận e:
\[\mathop {Mg}\limits^0 \to \mathop {Mg}\limits^{ + 2} + 2e\]
0,05 → 0,1
\[2\mathop N\limits^{ + 5} + 10e \to {\mathop N\limits^0 _2}\]
0,1 → 0,01
=>V = 0,01.22,4 = 0,224 lít
Đáp án cần chọn là: C
Câu 13:
Cho 19,2 gam kim loại M tan trong dung dịch HNO3 dư được 4,48 lít NO (đktc, là sản phẩm khử duy nhất). M là
 Xem đáp án
Xem đáp án
Trả lời:
nNO = 0,2 mol
Quá trình cho – nhận e:
\[\mathop M\limits^0 \to \mathop M\limits^{ + n} + ne\]
\[\frac{{0,6}}{n} \leftarrow 0,6\]
\[\mathop N\limits^{ + 5} + 3e \to \mathop N\limits^{ + 2} O\]
\[0,6 \leftarrow 0,2\]
\[ \Rightarrow \frac{{19,2}}{M} = \frac{{0,6}}{n}\]
\[ \Rightarrow M = 32n\]
Với n = 2 =>M = 64 =>M là Cu
Đáp án cần chọn là: B
Câu 14:
Cho 11 gam hỗn hợp gồm Al và Fe vào dung dịch HNO3 dư được 6,72 lít NO (đktc, là sản phẩm khử duy nhất). Khối lượng của Al và Fe lần lượt là
 Xem đáp án
Xem đáp án
Trả lời:
Gọi số mol của Al và Fe lần lượt là x và y mol
=>mhỗnhợp = 27x + 56y = 11 (1)
Quá trình cho – nhận e:
\[Al \to \mathop {Al}\limits^{ + 3} + 3e\]
\[\mathop N\limits^{ + 5} + 3e \to \mathop N\limits^{ + 2} O\]
\[Fe \to \mathop {Fe}\limits^{ + 3} + 3e\]
Bảo toàn e:
3.nAl + 3.nFe = 3.nNO
=>x + y = 0,3 (2)
Từ (1) và (2) =>x = 0,2; y = 0,1
=>mAl = 0,2.27 = 5,4 gam;
mFe = 0,1.56 = 5,6 gam
Đáp án cần chọn là: B
Câu 15:
Hỗn hợp X gồm Al và Fe có tỉ lệ số mol tương ứng là 1:1. Cho 2,49 gam X vào dung dịch chứa 0,17 mol HCl, thu được dung dịch Y. Cho 200 ml dung dịch AgNO3 1M vào Y, thu được khí NO và m gam chất rắn. Biết các phản ứng xảy ra hoàn toàn, NO là sản phẩm khử duy nhất của N+5. Giá trị của m gần nhất với giá trị nào sau đây
 Xem đáp án
Xem đáp án
Trả lời:
Đặt số mol Al và Fe trong X là x mol thì mX = 27x + 56x = 2,49
→ x = 0,03 mol
+) X + 0,17 mol HCl
2 Al + 6HCl → 2AlCl3 + 3H2
Fe + 2HCl → FeCl2 + H2
→ Dd Y thu được có AlCl3: 0,03 mol; FeCl2: 0,03 mol; HCl: 0,02 mol
+) Y + 0,2 mol AgNO3 thì :
3Fe2+ + 4H+ + NO3- → 3Fe3+ + 2H2O + NO
0,015 mol ← 0,02 mol
Ag+ + Cl- → AgCl
0,17 0,17 0,17 (mol)
\[{n_{F{e^{2 + }}}}\] còn lại = 0,015 mol
\[{n_{A{g^ + }}}\] còn lại = 0,03 mol
Fe2+ + Ag+ → Fe3+ + Ag
0,015 0,03
=> \[{n_{F{e^{2 + }}}}\]phản ứng hết trước
=> \[{n_{F{e^{2 + }}}}\] = nAg = 0,015 mol
→ mrắn = mAgCl + mAg = 0,17.143,5 + 0,015.108 = 24,395 + 1,62= 26,015 g
→ gần nhất với 26,0 g
Đáp án cần chọn là: D
Câu 16:
 Xem đáp án
Xem đáp án
Trả lời:
Chỉ có Cu phản ứng với HNO3 sinh ra khí.
Sử dụng định luật bảo toàn e ta có: 2nCu = nNO2 =>nNO2 = 2.0,1 = 0,2 mol
=>V = 4,48 lít
Đáp án cần chọn là: C
Câu 17:
Cho 6,4 gam Cu tan vừa đủ trong 200ml dung dịch HNO3 thu được khí X gồm NO và NO2, dX/H2 = 18 (không còn sản phẩm khử nào khác của N+5). Nồng độ mol/lít của dung dịch HNO3 đã dùng là
 Xem đáp án
Xem đáp án
Trả lời:
nCu = 0,1 mol
Gọi số mol của NO và NO2 lần lượt là x và y mol
Xét quá trình cho – nhận e:
\[Cu \to \mathop {Cu}\limits^{ + 2} + 2e\]
\[\mathop N\limits^{ + 5} + 3e \to \mathop N\limits^{ + 2} O\]
\[\mathop N\limits^{ + 5} + 1e \to \mathop N\limits^{ + 4} {O_2}\]
Bảo toàn e: 2.nCu = 3.nNO + nNO2 =>3x + y = 0,2 (1)
\[{\overline M _X} = \frac{{30x + 46y}}{{x + y}} = 18.2\] (2)
Từ (1) và (2) =>x = 1/18 mol; y = 1/30 mol
Bảo toàn nguyên tố N:
nHNO3phản ứng = nNO3 (trong muối) + nNO + nNO2 = 0,1.2 + 1/18 + 1/30 = 13/45 mol
=>CM HNO3 = 13/9 M
Đáp án cần chọn là: D
Câu 18:
Cho 1,35 gam hỗn hợp gồm Cu, Mg, Al tác dụng hết với dung dịch HNO3 thu được hỗn hợp khí gồm 0,01 mol NO và 0,04 mol NO2 (không còn sản phẩm khử nào khác của N+5). Khối lượng muối trong dung dịch là
 Xem đáp án
Xem đáp án
Trả lời:
Bước 1: Tính ne cho
Bảo toàn e: ne cho = ne nhận = 3.nNO + nNO2 = 3.0,01 + 0,04 = 0,07 mol
Bước 2: Tính mmuối
- n
NO3 (trong muối) = ne cho = 0,07 mol⟹ mNO3 = 62.0,07 = 4,34 gam
- mmuối = mkim loại + mNO3 = 1,35 + 4,34 = 5,69 gam
Đáp án cần chọn là: C
Câu 19:
Cho m gam hỗn hợp G gồm Mg và Al có tỉ lệ mol 4 : 5 vào dung dịch HNO3 20%. Sau khi các kim loại tan hết có 6,72 lít hỗn hợp X gồm NO, N2O, N2 bay ra (đktc) và được dung dịch T. Thêm một lượng O2 vừa đủ vào X, sau phản ứng được hỗn hợp khí Y. Dẫn Y từ từ qua dung dịch KOH dư, có 4,48 lít hỗn hợp khí Z đi ra (đktc). Tỉ khối của Z đối với H2 bằng 20. Nếu cho dung dịch NaOH vào dung dịch T thì lượng kết tủa lớn nhất thu được là (m + 39,1) gam. Biết HNO3 dùng dư 20% so với lượng cần thiết. Nồng độ phần trăm của Al(NO3)3 trong T gần nhất với
 Xem đáp án
Xem đáp án
Trả lời:
Khi thêm O2 vừa đủ vào Y thu được các khí NO2, N2O, N2. Dẫn qua dung dịch KOH dư thì NO2 bị hấp thụ khí còn lại là N2O và N2.
=>nNO = nNO2 = 0,3 – 0,2 = 0,1 mol
Áp dụng đường chéo cho hỗn hợp Z:
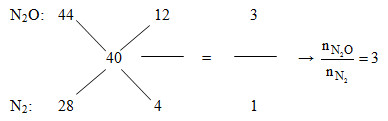
Mà nN2O + nN2 = nZ = 0,2 mol
=>nN2O = 0,15 và nN2 = 0,05
Đặt: nMg = 4x và nAl = 5x (mol)
=>nMg(OH)2 = 4x và mAl(OH)3 = 5x
m kết tủa max = mKL + mOH-
=>m + 39,1 = m + 17(4x.2 + 5x.3)
=>x = 0,1
=>nMg = 0,4 mol và nAl = 0,5 mol
Ta thấy:
2nMg + 3nAl >3nNO + 8nN2O + 10nN2
=>Có tạo muối NH4NO3
Bảo toàn e:
2nMg + 3nAl = 3nNO + 8nN2O + 10nN2 + 8nNH4NO3
=>2.0,4 + 3.0,5 = 3.0,1 + 8.0,15 + 10.0,05 + 8nNH4NO3
=>nNH4NO3 = 0,0375 mol
Công thức tính nhanh:
nHNO3pư = 4nNO + 10nN2O + 12nN2 + 10nNH4NO3 = 2,875 mol
=>nHNO3bđ = 2,875 + 2,875.(20/100) = 3,45 mol
=>m dd HNO3 = 3,45.63.(100/20) = 1086,75 gam
m dd sau pư = mMg + mAl + m dd HNO3 – mNO – mN2O – mN2
= 0,4.24 + 0,5.27 + 1086,75 – 0,1.30 – 0,15.44 – 0,05.28
= 1098,85 gam
Ta có: nAl(NO3)3 = nAl = 0,5 mol
→ %mAl = (0,5.213/1098,85).100% = 9,69% gần nhất với 9,7%
Đáp án cần chọn là: D
Câu 20:
Cho m gam hỗn hợp X (gồm Mg, Al, Zn và Cu) tác dụng hết với dung dịch HNO3 thu được dung dịch Y (không có muối amoni) và 11,2 lít (đktc) hỗn hợp khí Z (gồm N2, NO, N2O và NO2, trong đó N2 và NO2 có phần trăm thể tích bằng nhau) có tỉ khối đối với heli bằng 8,9. Số mol HNO3 phản ứng là
 Xem đáp án
Xem đáp án
Trả lời:
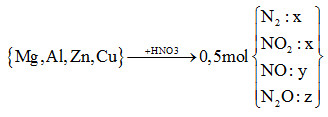
nHNO3 = 12nN2 + 2nNO2 + 4nNO + 10nN2O
= 12x + 2x + 4y + 10z = 14x + 4y +10z (*)
*nZ = 2x + y + z = 0,5 mol (1)
*mZ = nZ.MZ
=>28x + 44x + 30y + 44z = 0,5.8,9.4
=>74x + 30y + 44z = 17,8 (2)
\[\mathop \to \limits^{\frac{3}{7}\left( 2 \right) - \frac{{62}}{7}\left( 1 \right)} 14x + 14y + 10z = 3,2\left( {**} \right)\]
(*) và (**) =>nHNO3 = 3,2 mol
Đáp án cần chọn là: C
