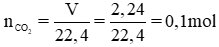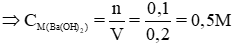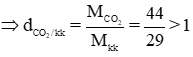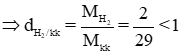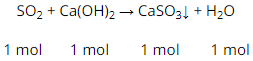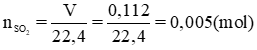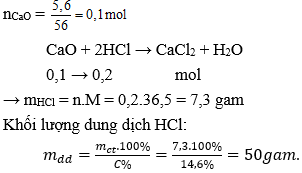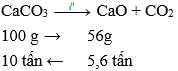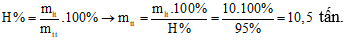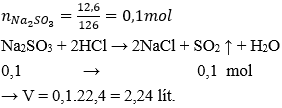Bài 2: Một số oxit quan trọng
-
5707 lượt thi
-
20 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Bằng phương pháp hóa học nào có thể nhận biết được từng chất trong mỗi dãy chất sau:
a) Hai chất rắn màu trắng là CaO và Na2O.
b) Hai chất khí không màu là CO2 và O2
Viết những phương trình phản ứng hóa học.
 Xem đáp án
Xem đáp án
a) Lấy một ít mỗi chất cho tác dụng với nước, sau đó đem lọc, nước lọc của các dung dịch này được thử bằng khí CO2 hoặc dung dịch Na2CO3. Nếu có kết tủa trắng thì chất ban đầu là CaO, nếu không có kết tủa thì chất ban đầu là Na2O. Phương trình phản ứng :
CaO + H2O → Ca(OH)2
Ca(OH)2 + CO2 → CaCO3 ↓ + H2O
Hoặc Ca(OH)2 + Na2CO3 → CaCO3 ↓ + 2NaOH
Na2O + H2O → 2NaOH
2NaOH + CO2 → Na2CO3 + H2O.
b) Sục hai chất khí không màu vào hai ống nghiệm chứa nước vôi Ca(OH)2 trong. Ống nghiệm nào bị vẩn đục, thì khí ban đầu là CO2, khí còn lại là O2.
PTPỨ: Ca(OH)2 + CO2 → CaCO3↓ + H2O
Câu 2:
Hãy nhận biết từng cặp chất trong mỗi nhóm chất sau bằng phương pháp hóa học:
a) CaO, CaCO3
b) CaO, MgO
Viết các phương trình phản ứng hóa học.
 Xem đáp án
Xem đáp án
Nhận biết từng chất trong mỗi nhóm chất sau:
a) CaO và CaCO3.
Lẫy mẫu thử từng chất cho từng mẫu thử vào nước khuấy đều.
Mẫu nào tác dụng mạnh với H2O là CaO.
Mẫu còn lại không tan trong nước là CaCO3.
PTPỨ: CaO + H2O → Ca(OH)2
b) CaO và MgO.
Lấy mẫu thử từng chất và cho tác dụng với H2O khuấy đều.
Mẫu nào phản ứng mạnh với H2O là CaO.
Mẫu còn lại không tác dụng với H2O là MgO.
PTPỨ: CaO + H2O → Ca(OH)2
Câu 4:
Biết 2,24 lit khí CO2 (đktc) tác dụng vừa đủ với 200ml dung dịch Ba(OH)2 sản phẩm sinh ra là BaCO3 và H2O.
a) Viết phương trình phản ứng.
b) Tính nồng độ mol của dung dịch Ba(OH)2 đã dùng.
c) Tính khối lượng chất kết tủa thu được.
 Xem đáp án
Xem đáp án
a) Phương trình phản ứng hóa học:
CO2 + Ba(OH)2 → BaCO3 ↓ + H2O
b) Dựa vào phương trình phản ứng trên ta nhận thấy:
nBa(OH)2 = nCO2 = 0,1 mol, VBa(OH)2 = 200ml = 0,2 lít
c) Dựa vào phương trình phản ứng trên ta có:
nBaCO3 = nCO2 = 0,1 mol.
⇒ mBaCO3 = 0,1 x 197 = 19,7 g.
Câu 5:
Viết phương trình hóa học cho mỗi biến đổi sau:
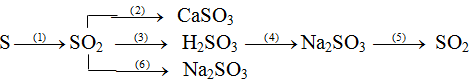
 Xem đáp án
Xem đáp án
(1) S + O2  SO2
SO2
(2) SO2 + CaO → CaSO3
Hay SO2 + Ca(OH)2(dd) → CaSO3↓ + H2O
(3) SO2 + H2O ⇆ H2SO3
(4) H2SO3 + 2NaOH → Na2SO3 + 2H2O
Hoặc H2SO3 + Na2O → Na2SO3 + H2O
(5) Na2SO3 + H2SO4 → Na2SO4 + SO2 ↑ + H2O
Không nên dùng phản ứng:
Na2SO3 + 2HCl → 2NaCl + SO2 ↑ + H2O vì HCl dễ bay hơi nên khí SO2 thu được sẽ không tinh khiết.
(6) SO2 + 2NaOH → Na2SO3 + H2O
Hoặc SO2 + Na2O → Na2SO3
Câu 6:
Hãy nhận biết từng chất trong mỗi nhóm chất sau bằng phương pháp hóa học:
a) Hai chất rắn màu trắng là CaO và P2O5.
b) Hai chất khí không màu là SO2 và O2.
Viết các phương trình hóa học.
 Xem đáp án
Xem đáp án
Nhận biết các chất sau:
a) CaO và P2O5
Lẫy mẫu từng chất và cho vào nước thu được 2 dung dịch Ca(OH)2 và H3PO4
Dùng quỳ tím cho vào các mẫu này.
Mẫu nào làm quỳ tím hóa xanh là Ca(OH)2 → chất rắn ban đầu là: CaO.
Mẫu nào làm quỳ tím hóa đỏ là H3PO4 ⇒ chất rắn ban đầu là P2O5
PTHH: CaO + H2O → Ca(OH)2
P2O5 + 3H2O → 2H3PO4
b) SO2 và O2.
Lấy mẫu thử từng khí.
Lấy quỳ tím ẩm cho vào từng mẫu thử. Mẫu nào làm quỳ tím hóa đỏ là SO2, còn lại là O2.
PTHH: SO2 + H2O → H2SO3
Câu 7:
Có những khí ẩm (khí có lẫn hơi nước): cacbon đioxit, hiđro, oxi, lưu huỳnh đioxit. Khí nào có thể làm khô bằng canxi oxit? Giải thích.
 Xem đáp án
Xem đáp án
Điều kiện chất có thể làm khô được những chất khác:
+ Phải hút ẩm được.
+ Không tác dụng với chất được làm khô.
Ta thấy CaO có tính hút ẩm (hơi nước) tạo thành Ca(OH)2, đồng thời là một oxit bazơ (tác dụng với oxit axit). Do đó CaO chỉ dùng làm khô các khí ẩm là hiđro ẩm, oxi ẩm.
Câu 8:
Có những chất khí sau: CO2, H2, O2, SO2, N2. Hãy cho biết chất nào có tính chất sau:
a) Nặng hơn không khí.
b) Nhẹ hơn khống khí.
c) Cháy được trong không khí.
d) Tác dụng với nước tạo thành dung dịch axit.
e) Làm đục nước vôi trong.
g) Đổi màu giấy quỳ tím ẩm thành đỏ.
 Xem đáp án
Xem đáp án
a) Những khí nặng hơn không khí: CO2, O2, SO2.
Vì Mkk = 29 g/mol.
MCO2 = 12 + 16.2 = 44 g/mol
⇒ CO2 nặng hơn kk
Tương tự: MO2 = 16.2 = 32 g/mol , MSO2 = 32 + 16.2 = 64g/mol
b) Những khí nhẹ hơn không khí: H2, N2.
Mkk = 29 g/mol.
MH2 = 1.2 = 2 g/mol
⇒ H2 nhẹ hơn kk
Tương tự: MN2 = 14.2 = 28g/mol
c) Những khí cháy được trong không khí: H2.
2H2 + O2 → 2H2O
d) Những khí tác dụng với nước tạo thành dung dịch axit: CO2, SO2.
PTHH: CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
e) Những khí làm đục nước vôi trong: CO2, SO2.
Ca(OH)2 + CO2 → CaCO3 ↓ + H2O
Ca(OH)2 + SO2 → CaSO3 ↓ + H2O
g) Những khí làm đổi màu quỳ tím ẩm thành đỏ: CO2, SO2.
Quỳ tím ẩm ⇒ xảy ra phản ứng với nước tạo axit làm quỳ tím chuyển đỏ
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
Câu 9:
Khí lưu huỳnh đioxit được tạo thành từ cặp chất nào sau đây:
a) K2SO3 và H2SO4.
b) K2SO4 và HCl.
c) Na2SO3 và NaOH.
d) Na2SO4 và CuCl2.
e) Na2SO3 và NaCl.
 Xem đáp án
Xem đáp án
Khí SO2 được tạo thành từ cặp chất: a
Phương trình hóa học minh họa:
K2SO3 + H2SO4 → K2SO4 + SO2 ↑ + H2O.
Câu 10:
Dẫn 112ml khí SO2 (đktc) đi qua 700ml dung dịch Ca(OH)2 có nồng độ 0,01 M, sản phẩm là muối canxi sunfit.
a) Viết phương trình phản ứng hóa học.
b) Tính khối lượng các chất sau phản ứng.
 Xem đáp án
Xem đáp án
a) PTHH:
b) VSO2 = 112ml = 0,112 l; VCa(OH)2 = 700ml = 0,7 l
nCa(OH)2 = CM . V = 0,01. 0,7 = 0,007 (mol)
Tỉ lệ:
Vậy SO2 hết Ca(OH)2 dư
Các chất sau phản ứng: Ca(OH)2 và CaSO3
Theo pt nCa(OH)2 = nSO2 = 0,005 mol
⇒ nCa(OH)2 dư = 0,007 – 0,005 = 0,002 (mol)
mCa(OH)2 dư = n . M = 0,002 × 74 = 0,148 (g)
nCaSO3 = nSO2 = 0,005 mol → mCaSO3 = n. M = 0,005 × 120 = 0,6 (g).
Câu 11:
Oxit được dùng làm chất hút ẩm (chất làm khô) trong phòng thí nghiệm là
 Xem đáp án
Xem đáp án
Đáp án: D
Câu 13:
Để phân biệt 2 lọ mất nhãn đựng CaO và MgO ta dùng:
 Xem đáp án
Xem đáp án
Đáp án: B
CaO + H2O → Ca(OH)2
Ca(OH)2 (dd) làm xanh quỳ tím.
- MgO không phản ứng với nước, không tan trong nước, không làm quỳ tím chuyển màu.
Câu 14:
Cặp chất tác dụng với nhau sẽ tạo ra khí lưu huỳnh đioxit là
 Xem đáp án
Xem đáp án
Đáp án: B
Na2SO3 + H2SO4 → Na2SO4 + SO2 ↑ + H2O
Câu 18:
Hòa tan hết 5,6 gam CaO vào dung dịch HCl 14,6% . Khối lượng dung dịch HCl đã dùng là:
 Xem đáp án
Xem đáp án
Đáp án: A
Câu 19:
Để thu được 5,6 tấn vôi sống với hiệu suất phản ứng đạt 95% thì lượng CaCO3 cần dùng là
 Xem đáp án
Xem đáp án
Đáp án: B
Do hiệu suất phản ứng là 95% nên lượng CaCO3 cần dùng là: