- Đề số 1
- Đề số 2
- Đề số 3
- Đề số 4
- Đề số 5
- Đề số 6
- Đề số 7
- Đề số 8
- Đề số 9
- Đề số 10
- Đề số 11
- Đề số 12
- Đề số 13
- Đề số 14
- Đề số 15
- Đề số 16
- Đề số 17
- Đề số 18
- Đề số 19
- Đề số 20
- Đề số 21
- Đề số 22
- Đề số 23
- Đề số 24
- Đề số 25
- Đề số 26
- Đề số 27
- Đề số 28
- Đề số 29
- Đề số 30
- Đề số 31
- Đề số 32
- Đề số 33
- Đề số 34
- Đề số 35
- Đề số 36
Bộ đề kiểm tra định kì học kì 1 Hóa 9 có đáp án (Mới nhất) - Đề 31
-
6657 lượt thi
-
20 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Cho các chất sau: CuO, BaCl2, Ag, C, NaHCO3. Số chất tác dụng được với dung dịch H2SO4 đặc nóng là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Tất cả các chất đã cho đều tác dụng với axit sunfuric đặc, nóng
Câu 2:
Thuốc thử để nhận biết ba lọ mất nhãn chứa các dung dịch riêng biệt H2SO4, BaCl2, NaCl là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Sử dụng quỳ tím để nhận biết axit H2SO4, H2SO4 làm quỳ tím hóa đỏ, hai dung dịch còn lại không làm quỳ tím đổi màu. Sau đó cho H2SO4 vào 2 dung dịch còn lại, dung dịch nào phản ứng tạo kết tủa trắng là BaCl2, còn lại là NaCl
Câu 5:
Cho các phản ứng sau:
(1) MnO2 + HCl đặc
(2) Cl2 + NaOH loãng
(3) Fe + HCl loãng
(4) CO + CuO
Các phản ứng tạo ra đơn chất là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Câu 6:
Các kim loại tan trong axit sunfuric đặc nóng nhưng không tan trong axit sunfuric loãng là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Các kim loại Ag, Cu đứng sau H trong dãy hoạt động hóa học của kim loại nên không tác dụng với H2SO4 loãng nhưng tác dụng với H2SO4 đặc nóng vì dung dịch H2SO4 đặc có tính oxi hóa mạnh
Câu 7:
Phương trình hóa học nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Khí clo không tác dụng trực tiếp với oxi
Câu 8:
Trộn lẫn 200ml dung dịch HCl 2M với 200ml dung dịch HCl 3M. Nồng độ mol/l của dung dịch thu được sau khi trộn là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
200ml = 0,2 lít
Số mol HCl trong các dung dịch đem trộn là:
Số mol HCl của dung dịch sau khi trộn là:
nHCl = nHCl(1) + nHCl(2) = 0,4 + 0,6 = 1 (mol)
Thể tích dung dịch sau khi trộn là:
V = V(1) + V(2) = 0,2 + 0,2 = 0,4 (l)
Nồng độ mol/l của dung dịch HCl sau khi trộn là:
Câu 9:
Trong điều kiện thích hợp, phản ứng nào sau đây xảy ra với dung dịch H2SO4 loãng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Dung dịch H2SO4 loãng không có tính oxi hóa như H2SO4 đặc nên đáp án C thỏa mãn.
Câu 10:
Cho các dung dịch sau: NaNO3, HCl, HNO3, KCl. Chỉ dùng quỳ tím và dung dịch AgNO3 thì số dung dịch có thể phân biệt là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phân biệt các chất như bảng dưới đây
|
|
NaNO3 |
HCl |
HNO3 |
KCl |
|
Quỳ tím |
Không đổi màu |
Hóa đỏ |
Hóa đỏ |
Không đổi màu |
|
AgNO3 |
Không hiện tượng |
Kết tủa trắng |
Không hiện tượng |
Kết tủa trắng |
Phương trình hóa học xảy ra:
Câu 11:
Cho dãy chuyển hóa . X, Y, Z, T theo thứ tự có thể là dãy chấy nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Câu 12:
Hấp thụ hoàn toàn 6,72 lít khí SO2 (đktc) vào 500ml dung dịch NaOH 0,9M. Khối lượng muối tạo thành sau phản ứng là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Số mol SO2 là:
Lập tỉ lệ:
Nên thu được hai muối là Na2SO3 và NaHSO3
Gọi x, y lần lượt là số mol của Na2SO3 và NaHSO3.
Từ phương trình
Khối lượng muối thu được là:
Câu 13:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Kim loại đồng chỉ tác dụng được với axit sunfuric đặc nóng, giải phóng khí SO2 vì H2SO4 đặc có tính oxi hóa mạnh. Đồng không tác dụng với axit sunfuric loãng giải phóng khí H2 vì đồng đứng sau hiđro trong dãy hoạt động hóa học của kim loại.
Câu 14:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Trong một nhóm đi theo chiều điện tích hạt nhân tăng dần thì tính phi kim của các nguyên tố giảm dần, vậy theo chiều tăng dần là I < Br < Cl < F
Câu 15:
Cho hình biểu diễn quá trình điều chế khí clo trong phòng thí nghiệm như sau:
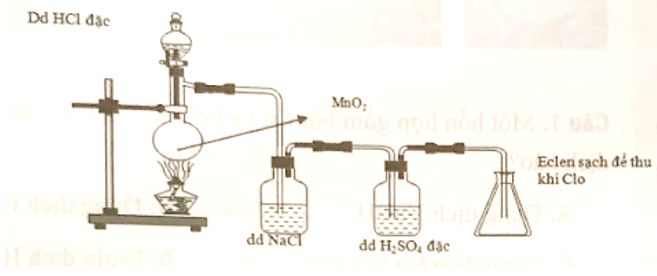
Vai trò của dung dịch H2SO4 đặc là giữ lại
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
H2SO4 đặc có tính háo nước mạnh và không tác dụng với khí Cl2 nên có thể dùng trong thí nghiệm này để giữ hơi nước lẫn trong khí Cl2.
Câu 16:
Từ quặng pirit sắt FeS2, O2 và nước, hãy viết các phương trình điều chế muối sắt (II) sunfat (cho các điều kiện phản ứng là đầy đủ)
 Xem đáp án
Xem đáp án
- Từ quặng pirit sắt, điều chế lưu huỳnh đioxit và sắt (III) oxit.
- Từ lưu huỳnh đioxit và khí oxi, điều chế lưu huỳnh trioxit.
- Từ lưu huỳnh trioxit điều chế axit sunfuric.
- Từ sắt (III) oxit và axit sunfuric điều chế được sắt (III) sunfat.
Câu 17:
Nêu hiện tượng xảy ra khi sục khí cacbonic vào nước vôi trong đến dư. Viết các phương trình hóa học minh họa
 Xem đáp án
Xem đáp án
- Khi bắt đầu dẫn khí cacbonic vào dung dịch nước vôi trong thấy nước vôi vẩn đục do xuất hiện kết tủa trắng là CaCO3.
- Khi kết tủa không tạo được nữa, tiếp tục sục khí cacbonic vào thì kết tủa tan dần lại đến hết, dung dịch thu được trong suốt không màu là dung dịch Ca(HCO3).
Câu 18:
Một bạn học sinh trong lúc làm thí nghiệm đã làm rơi vỡ nhiệt kế thủy ngân. Em hãy nêu cách giải quyết vấn đề.
 Xem đáp án
Xem đáp án
Thủy ngân trong nhiệt kế là thủy ngân ở dạng lỏng, dễ bay hơi, rất độc. Thủy ngân dạng hơi dễ dàng bị hấp thu ở phổi rồi vào máu và não trong quá trình hô hấp dẫn đến hủy hoại hệ thần kinh trung ương. Do đó nếu xảy ra trường hợp làm vỡ nhiệt kế thủy ngân phải ngay lập tức sơ tán mọi người khỏi phòng, dùng bột lưu huỳnh rắc lên chỗ có thủy ngân rơi vãi. Lưu huỳnh và thủy ngân tác dụng với nhau ngay ở nhiệt độ thường, tạo thành thủy ngân sunfua không bay hơi, hạn chế tối đa sự bay hơi của thủy ngân trong không khí.
Câu 19:
Cho m gam hỗn hợp X gồm Fe và Cu tác dụng với 800g dung dịch H2SO4 loãng (lấy dư 10% so với lượng tham gia phản ứng) thì thu được 4,48 lít khí (đktc) và dung dịch Y. Mặt khác, nếu cho m gam X trên tác dụng với dung dịch H2SO4 đặc nóng dư thì thu được 8,96 lít khí SO2 (đktc)
a) Tính khối lượng mỗi chất trong hỗn hợp X
 Xem đáp án
Xem đáp án
a) – Khi cho hỗn hợp X tác dụng với H2SO4 thì chỉ có Fe xảy ra phản ứng
1 1 1
Số mol khí H2 thoát ra là:
Từ phương trình
Khối lượng Fe trong hỗn hợp X là:
mFe = nFe . MFe = 0,2.56 = 11,2 (g)
- Khi cho hỗn hợp X tác dụng với H2SO4 đặc nóng thì cả 2 kim loại đều phản ứng.
2 6 3
1 2 1
Số mol SO2 thu được là:
Từ phương trình (1)
Từ phương trình (2)
Khối lượng Cu trong hỗn hợp X là: mCu = nCu . MCu = 0,1.64 = 6,4 (g)
Câu 20:
b) Tính nồng độ phần trăm của dung dịch H2SO4 loãng ban đầu.
 Xem đáp án
Xem đáp án
b) Từ phương trình, số mol H2SO4 loãng đã tham gia phản ứng là:
Khối lượng H2SO4 loãng đã tham gia phản ứng là:
Vì lượng H2SO4 ban đầu lấy dư 10% so với lượng tham gia phản ứng nên khối lượng H2SO4 ban đầu là:
Nồng độ phần trăm của dung dịch H2SO4 ban đầu là:
