Bộ đề kiểm tra định kì học kì 2 Hóa 9 có đáp án (Mới nhất) (Đề 14)
-
5834 lượt thi
-
16 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Phát biểu không đúng là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Đáp án D sai. Vì etilen không tham gia phản ứng thế.
Câu 2:
Thành phần % theo khối lượng của C trong C2H7N là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Thành phần % theo khối lượng của cacbon trong C2H7N là:
Câu 4:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Các đáp án B, C, D sai. Vì cacbon có hóa trị IV nên xung quanh nó phải có 4 liên kết, hiđro có hóa trị I nên xung quanh nó có 1 liên kết và brom có hóa trị I nên xung quanh nó có 1 liên kết (mỗi liên kết được biểu diễn bằng một nét gạch nối giữa hai nguyên tử).
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Đáp án A sai. Vì etilen không tham gia phản ứng thế với dung dịch brom.
Câu 7:
Cho các phát biểu sau:
(a) Than gầy là loại than già nhất (chứa trên 90% cacbon).
(b) Phản ứng đặc trưng của metan là phản ứng thế.
(c) Trong phân tử benzen có 3 liên kết đơn xen kẽ với ba liên kết đôi.
(d) Để nhận biết etilen và axetilen người ta dùng dung dịch brom.
(e) Các chất C3H9N, C2H4O, CaCO3, C2H5ONa đều là dẫn xuất của hidrocacbon.
(f) Trong hợp chất hữu cơ cacbon không nhất thiết phải có hóa trị IV.
Số phát biểu đúng là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
(a) Đúng.
(b) Đúng.
(c) Đúng.
(d) Sai. Vì cả etilen và axetilen đều làm mất màu dung dịch brom nên không thể nhận biết hai khí trên bằng dung dịch brom.
(e) Sai. Vì CaCO3 là hợp chất vô cơ, trong khi đó dẫn xuất hidrocacbon là hợp chất hữu cơ.
(f) Sai. Vì trong hợp chất hữu cơ cacbon luôn có hóa trị IV.
Vậy có 3 phát biểu đúng.
Câu 8:
Etilen không có ứng dụng
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Đáp án D sai. Vì metan mới là nguyên liệu để điều chế bột than.
Câu 9:
Dãy các chất đều là hidrocacbon:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Đáp án B sai. Vì C3H6O là dẫn xuất của hidrocacbon, CaC2 là hợp chất vô cơ, trong khi đó hidrocacbon là hợp chất hữu cơ.
Đáp án C sai. Vì C2H7N là dẫn xuất của hidrocacbon, CaC2 là hợp chất vô cơ.
Đáp án D sai. Vì C2H7N là dẫn xuất của hidrocacbon.
Câu 12:
Hidrocacbon mà trong phân tử chứa một liên kết đôi là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Vì công thức cấu tạo của etilen là:
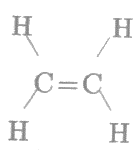 .
.
Ta thấy trong phân tử etilen có 1 liên kết đôi C=C.
Câu 13:
Cho 2,6 gam C2H2 tác dụng với dung dịch Br2 25% thu được C2H2Br4.
Tính khối lượng sản phẩm thu được.
 Xem đáp án
Xem đáp án
Phương trình phản ứng:
Số mol của C2H2 là:
Theo phương trình, ta có:
Vậy khối lượng của C2H2Br4 thu được là 34,6 gam.
Câu 14:
Cho 2,6 gam C2H2 tác dụng với dung dịch Br2 25% thu được C2H2Br4.
Tính khối lượng dung dịch Br2 cần dùng.
 Xem đáp án
Xem đáp án
Số mol của Br2 tham gia phản ứng là:
Ta có:
Vậy khối lượng dung dịch brom cần dùng là 128 gam.
Câu 15:
Viết công thức cấu tạo của các chất có công thức phân tử sau: C3H8O, C4H10, C2H5Br.
 Xem đáp án
Xem đáp án
Công thức cấu tạo có thể có của phân tử C3H8O là:
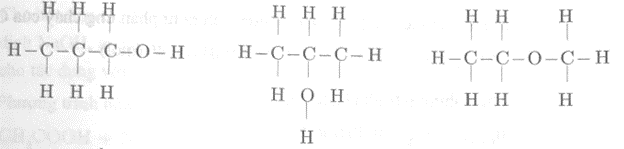
Công thức cấu tạo có thể có của phân tử C4H10 là:
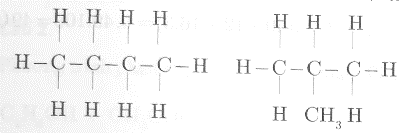
Công thức cấu tạo có thể có của phân tử C2H5Br là:
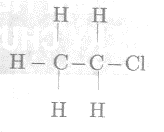
Câu 16:
Đốt cháy 11,2 lít khí thiên nhiên X chứa 96% CH4, 2% N2 và 2% CO2 về thể tích. Toàn bộ sản phẩm cháy được dẫn qua dung dịch Ca(OH)2 dư, tạo ra m gam kết tủa. Tính khối lượng kết tủa tạo thành. (Biết N2 và CO2 không cháy).
 Xem đáp án
Xem đáp án
Số mol khí thiên nhiên X là:
Thành phần % thể tích cũng chính là thành phần % số mol.
Ta có số mol của CH4 và CO2 lần lượt là:
Khi đốt X thì chỉ có CH4 cháy theo phương trình:
Số mol CO2 thu được từ phản ứng trên là:
Khi dẫn sản phẩm cháy qua dung dịch Ca(OH)2 dư thì chỉ có CO2 phản ứng với dung dịch Ca(OH)2 tạo kết tủa trắng.
Phương trình phản ứng:
Lượng CO2 phản ứng với dung dịch Ca(OH)2 dư bằng tổng lượng CO2 có trong khí thiên nhiên và lượng CO2 được sinh ra từ phản ứng cháy của CH4.
Theo phương trình (*), ta có:
Khối lượng kết tủa thu được là:
Vậy giá trị của m là 49 gam.
