Bộ đề kiểm tra định kì học kì 2 Hóa 9 có đáp án (Mới nhất) (Đề 34)
-
5838 lượt thi
-
22 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Thể tích khí oxi ở đktc cần dùng để đốt cháy hoàn toàn 8 gam khí metan là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phương trình phản ứng:
Câu 2:
Khi dẫn khí CO qua ống nghiệm đựng Fe2O3 nung nóng thì xảy ra phản ứng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Đáp án A sai. Vì cân bằng phương trình sai.
Đáp án B sai. Vì CO tác dụng với Fe2O3 không tạo ra FeCO3.
Đáp án D sai. Vì CO tác dụng với Fe2O3 không tạo ra FeO và C.
Câu 3:
Cho Cu(OH)2 vào hai ống nghiệm đựng CH3COOH và C2H5OH. Hiện tượng chứng tỏ ống nghiệm có chứa axit CH3COOH là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Vì Cu(OH)2 tác dụng với CH3COOH theo phương trình
Câu 4:
Khi đốt khí axetilen, số mol CO2 và H2O được tạo thành theo tỉ lệ là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Phương trình phản ứng:
Câu 5:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Câu 6:
Khí tác dụng với nước có xúc tác thích hợp tạo thành rượu etylic chỉ qua một giai đoạn là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phương trình điều chế ancol etylic từ etilen là:
Câu 7:
Trong phân tử metan có
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Công thức cấu tạo của CH4 là: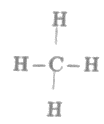
Ta thấy trong phân tử etilen có 4 liên kết đơn C – H.
Câu 8:
Cho 25,2 gam MgCO3 tác dụng với một lượng vừa đủ dung dịch HCl 1M. Thể tích dung dịch HCl đã dùng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phương trình phản ứng:
Ta có số mol của MgCO3 là:
Thể tích dung dịch HCl đã dùng là:
Câu 9:
Cặp chất cùng tồn tại trong một dung dịch là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Đáp án B sai. Vì KOH và HCl phản ứng được với nhau.
Đáp án C sai. Vì HCl và AgNO3 phản ứng được với nhau.
Đáp án D sai. Vì NaHCO3 và NaOH phản ứng được với nhau.
Câu 10:
Cho rượu etylic 90o tác dụng với natri. Số phản ứng hóa học có thể xảy ra là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Trong 100 ml rượu 90o có 90 ml rượu etylic nguyên chất và 10 ml nước. Vì vậy ngoài phản ứng giữa rượu etylic với natri còn có phản ứng giữa nước với natri.
Vậy có 2 phản ứng hóa học xảy ra.
Câu 11:
Biết tỉ khối hơi của X so với khí metan là 2,875. Công thức phân tử của X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Câu 12:
Cho 800 ml dung dịch CH3COOH a M tác dụng vừa đủ với Na2CO3 thu được 8,96 lít khí CO2 (ở đktc). Nồng độ của dung dịch CH3COOH là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phương trình phản ứng:
Ta có số mol của CO2 là:
Nồng độ của dung dịch CH3COOH là:
Câu 13:
Chất hữu cơ X có các tính chất sau:
- Ở điều kiện thường là chất rắn kết tinh.
- Tan nhiều trong nước.
Vậy X là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Đáp án A sai. Vì etilen là chất khí và ít tan trong nước.
Đáp án C sai. Vì chất béo không tan trong nước.
Đáp án D sai. Vì axit axetic là chất lỏng.
Câu 14:
Thủy phân 2 mol saccarozơ trong môi trường axit, số mol của sản phẩm thu được là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Phương trình phản ứng:
Câu 15:
Hóa chất dùng để nhận biết hai lọ khí mất nhãn đựng: CH4 và C2H4 là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Vì C2H4 làm mất màu dung dịch brom còn CH4 thì không tác dụng với dung dịch brom.
Phương trình phản ứng:
Câu 16:
Công thức phân tử của chất hữu cơ A là C2H6O và hữu cơ B là C2H4O2. Để chứng minh A là rượu etylic và B là axit axetic cần phải làm những thí nghiệm nào? Viết phương trình hóa học minh họa.
 Xem đáp án
Xem đáp án
Để chứng minh A là rượu etylic cần làm thí nghiệm.
Cho A tác dụng với natri nếu có hiện tượng sủi bọt khí thì chứng tỏ A là rượu etylic.
Phương trình phản ứng:
Để chứng minh B là axit axetic cần làm thí nghiệm:
Cho B tác dụng với quỳ tím khi đó quỳ tím chuyển sang màu đỏ thì đó là axit axetic.
Hoặc cho B tác dụng kim loại kẽm nếu có hiện tượng sủi bọt khí thì chứng tỏ B là axit axetic.
Phương trình phản ứng:
Câu 17:
Bằng phương pháp hóa học hãy nhận biết các chất sau: NaOH, KNO3, CaCO3, MgO, P2O5.
 Xem đáp án
Xem đáp án
Hòa tan các mẫu thử vào nước, ta chia thành hai nhóm:
Nhóm 1 tan trong nước: NaOH, KNO3, P2O5.
Nhóm 2 không tan trong nước: CaCO3, MgO.
Dùng quỳ tím thử các dung dịch ở nhóm 1:
Dung dịch làm quỳ tím hóa xanh là NaOH.
Dung dịch làm quỳ tím hóa đỏ là H3PO4.
Vậy chất ban đầu là P2O5.
Dung dịch không làm đổi màu quỳ tím là KNO3.
Cho các mẫu thử ở nhóm 2 tác dụng với dung dịch HCl:
Mẫu thử nào có hiện tượng sủi bọt khí là CaCO3.
Vậy mẫu thử còn lại là MgO.
Câu 18:
Một loại chất béo có công thức là (C17H33COO)3C3H5.
Đun nóng 91,5 kg chất béo này với NaOH dư tạo ra m gam glixerol. Tính giá trị của m.
 Xem đáp án
Xem đáp án
Phản ứng xà phòng:
Theo phương trình phản ứng, ta có khối lượng của glixerol là:
Câu 19:
Một loại chất béo có công thức là (C17H33COO)3C3H5.
 Xem đáp án
Xem đáp án
Theo phương trình phương trình, ta có khối lượng của muối thu được là:
Khối lượng xà phòng thu được là:
Câu 20:
Đốt chát 11,2 dm3 hỗn hợp X gồm hai khí etan (C2H6) và axetilen thu được 16,2 gam H2O.
Tính số mol của etan và axetilen có trong hỗn hợp X.
 Xem đáp án
Xem đáp án
Ta có: 11,2dm3 = 11,2 lít
Số mol của hỗn hợp X là:
Số mol của nước là:
Gọi x, y lần lượt là số mol của etan và axetilen có trong hỗn hợp X.
Theo phương trình (1) và (2), ta có:
Từ (*) và (**) ta có hệ phương trình:
Vậy số mol của etan và axetilen có trong hỗn hợp lần lượt là 0,2 mol và 0,3 mol.
Câu 21:
 Xem đáp án
Xem đáp án
Theo phương trình (1), ta có:
Theo phương trình (2), ta có:
Số mol oxi cần dùng để đốt cháy hỗn hợp X là:
Vậy khối lượng oxi cần dùng để đốt cháy hoàn toàn hỗn hợp X là:
Câu 22:
Đốt chát 11,2 dm3 hỗn hợp X gồm hai khí etan (C2H6) và axetilen thu được 16,2 gam H2O.
Tính tỉ khối hơi của hỗn hợp X đối với không khí (các thể tích đo ở đktc).
 Xem đáp án
Xem đáp án
Khối lượng mol trung bình của hỗn hợp khí là:
Tỉ khối hơi của hỗn hợp X đối với không khí là:
