Đề kiểm tra giữa học kì 2 môn Hoá 9 có đáp án (Mới nhất) (Đề 11)
-
5434 lượt thi
-
25 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Trong công nghiệp người ta sản xuất clo bằng cách điện phân dung dịch muối ăn bão hòa trong bình điện phân có màng ngăn.
2NaCl + 2H2O 2NaOH + H2 ↑ + Cl2 ↑
Câu 2:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
2Fe + 3Cl2 2FeCl3
Áp dụng định luật bảo toàn khối lượng, ta có:
mFe phản ứng + phản ứng =
⇒ phản ứng = − mFe phản ứng = 32,5 – 11,2 = 21,3 (g)
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Các dạng thù hình của cacbon là kim cương, than chì, cacbon vô định hìnhCâu 4:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Do có tính hấp phụ, nên cacbon vô định hình được dùng làm trắng đường, mặt nạ phòng hơi độc.
Câu 5:
Đốt cháy hoàn toàn 24 gam C thì thể tích tối đa của khí CO2 thu được ở đktc là (C: 12)
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
C + O2 CO2
= = 2 (mol)
Theo phương trình: = = 2 (mol)
Thể tích tối đa của khí CO2 thu được ở đktc là = 2.22,4 = 44,8 (l)
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Dãy các chất là muối axit: Ba(HCO3)2, NaHCO3, Ca(HCO3)2.
Câu 7:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Na, Mg, Al theo thứ tự từ trái sang phải cùng thuộc chu kì 3 có tính kim loại giảm dần.
Hay tính kim loại: Na > Mg > Al
Na, K theo thứ tự từ trên xuống dưới cùng thuộc nhóm IA có tính kim loại tăng dần.
Hay tính kim loại K > Na
Do đó tính kim loại tăng dần theo chiều từ: Al < Mg < Na < K.
Câu 8:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Vì số thứ tự chu kì bằng số lớp electron. Số thứ tự nhóm bằng số eletron lớp ngoài cùng của nguyên tử nên:
X thuộc chu kì 3, nhóm VII. Nhóm VII gần cuối chu kì gồm các nguyên tố phi kim hoạt động mạnh nên X là phi kim mạnh.
Câu 9:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Cacbon oxit (CO) có thể kết hợp với hemoglobin trong máu ngăn không cho máu nhận oxi và cung cấp oxi cho các tế bào do đó nếu nồng độ CO quá mức cho phép có thể gây tử vong cho con người.
Câu 10:
Trong thực tế, người ta có thể dùng cacbon để khử oxit kim loại nào trong số các oxit kim loại dưới đây để sản xuất kim loại?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Trong thực tế, người ta có thể dùng cacbon để khử oxit sắt.
2C + Fe3O4 3Fe + 2CO2 ↑
Câu 11:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Khí hiđro không tan trong nước và nhẹ hơn không khí () nên có thể thu khí hiđro vào ống nghiệm bằng cách đẩy nước hoặc đẩy không khí để úp bình thu.
Không dùng cách đẩy không khí để ngửa bình thu.
Câu 12:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
FexOy + yH2 xFe + yH2O
= = 0,6 (mol)
Bảo toàn nguyên tố O: = = 0,6 = 0,6 (mol)
⇒ = 0,6.16 = 9,6 (g)
Vì trong FexOy chỉ có hai nguyên tố Fe và O nên:
= = 34,8 – 9,6 = 25,2 (g)
Ta có tỉ lệ:
x : y = =
⇒ Công thức hóa học của oxit sắt là: Fe3O4
Câu 13:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Hợp chất hữu cơ là hợp chất của cacbon. Nên trong thành phần phân tử hợp chất hữu cơ nhất thiết phải có nguyên tố cacbon.
Câu 14:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Hiđrocacbon là hợp chất hữu cơ trong phân tử chỉ có hai nguyên tố cacbon và hiđro.
Dãy các chất nào sau đây đều là hiđrocacbon: C2H6, C4H10, CH4
Câu 15:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
%mC = = = 60%
Câu 16:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nguyên tử cacbon có thể liên kết trực tiếp với nhau tạo thành các dạng mạch cacbon là mạch vòng, mạch thẳng, mạch nhánh.
Câu 17:
Phân tử chất hữu cơ X có hai nguyên tố C, H. Tỉ khối hơi của X so với hiđro là 22. Công thức phân tử của X là (C:12; H: 1)
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Ta có = 22 ⇒ MX = 22. = 22.2 = 44 (g/mol)
= 56 (g/mol)
= 44 (g/mol)
= 42 (g/mol)
= 78 (g/mol)
Vậy X là C3H8
Câu 18:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Khí metan phản ứng được với Cl2, O2
CH4 (k) + Cl2 (k) CH3Cl (k) + HCl (k)
CH4 + 2O2 CO2 + 2H2O
Câu 19:
Khi đốt cháy hoàn toàn 0,5 mol metan người ta thu được một lượng khí CO2 (đktc) có thể tích là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
CH4 + 2O2 CO2 + 2H2O
Theo phương trình: = = 0,5 (mol)
= 0,5.22,4 = 11,2 (l)
Câu 20:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Công thức cấu tạo của etilen (C2H4):
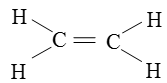
Trong phân tử etilen giữa hai nguyên tử cacbon có một liên kiết đôi.
Câu 21:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
C2H4 + 3O2 2CO2 + 2H2O
= = 0,5 (mol)
Theo phương trình: = 3 = 1,5 (mol)
= 1,5.22,4 = 33,6 (l)
Câu 22:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Công thức cấu tạo của axetilen (C2H2)

Trong phân tử axetilen, giữa hai nguyên tử cacbon có một liên kết ba.
Câu 23:
Cho 0,56 lít (ở đktc) hỗn hợp khí metan và axetilen tác dụng với dung dịch brom dư, lượng brom đã tham gia phản ứng là 6,4 gam. Thành phần phần trăm về thể tích của axetilen trong hỗn hợp ban đầu là (Br: 80)
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
CH ≡ CH + 2Br2 (dư) → CHBr2 – CHBr2
= = 0,04 (mol)
Theo phương trình: = = 0,02 (mol)
= 0,02.22,4 = 0,448 (l)
% = = 80%
Câu 24:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phân tử khối của C2H2 = 12.2 +1.2 = 26 (đvC)
Phân tử khối của CH4 = 12 +1.4 = 16 (đvC)
Phân tử khối của C2H4 = 12.2 +1.4 = 28 (đvC)
Phân tử khối của C6H6 = 12.6 +1.6 = 78 (đvC)
Vậy A là benzen (C6H6)
Câu 25:
Đốt hoàn toàn V lít (ở đktc) khí thiên nhiên có chứa 96% CH4, 2% N2 và 2% CO2 rồi dẫn toàn bộ toàn bộ sản phẩm qua dung dịch nước vôi trong dư ta thu được 294 gam kết tủa. Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Khi đốt khí thiên nhiên chỉ có CH4 tham gia phản ứng cháy với oxi.
CH4 + 2O2 CO2 + 2H2O (1)
Gọi số mol khí thiên nhiên trên là x (mol)
Tỉ lệ % về thể tích cũng bằng tỉ lệ % về số mol trong cùng một điều kiện nên:
= 0,96x (mol)
= 0,02x (mol)
Theo phương trình (1): = = 0,96x (mol)
Lượng CO2 thoát ra bao gồm CO2 có trong khí thiên nhiên ban đầu và CO2 sinh ra ở phản ứng (1)
⇒ = + = 0,02x + 0,96x (mol)
CO2 + Ca(OH)2 dư → CaCO3 ↓ + H2O (2)
= = 2,94 (mol)
Theo phương trình (2): = = 2,94 (mol)
⇒ 0,02x + 0,96x = 2,94
⇒ x = 3
⇒ V = 3.22,4 = 67,2 (l)
