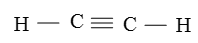Đề kiểm tra giữa học kì 2 môn Hoá 9 có đáp án (Mới nhất) (Đề 17)
-
5430 lượt thi
-
15 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Nhiều muối cacbonat (trừ muối cacbonat của kim loại kiềm) dễ bị nhiệt phân giải phóng khí cacbonic (CO2)
Ví dụ: CaCO3 CaO + CO2 ↑
Câu 2:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Axit flohiđric (HF) hòa tan dễ dàng SiO2 (thành phần chính của thủy tinh) theo phản ứng: 4HF (dd) + SiO2 (r) → SiF4 (k) + 2H2O (l)
Do đó HF không đựng được trong lọ thủy tinh.
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phần trăm về khối lượng của cacbon trong phân tử CH4 là:
= = = 75%
Câu 4:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Dẫn xuất của hiđrocacbon là hợp chất hữu cơ trong phân tử ngoài cacbon và của hiđro còn có các nguyên tố khác như: oxi, nitơ, clo, …
Phương án A: Tất cả các chất đều là dẫn xuất của hiđrocacbon ⇒ A đúng
Phương án B: Có HNO3 là hợp chất vô cơ; C6H6 là hiđrocacbon ⇒ B sai
Phương án C: Tất cả các chất đều là hiđrocacbon ⇒ C sai
Phương án D: FeCl3; NaHCO3 là hợp chất vô cơ. CH4 là hiđrocacbon.⇒ D sai.
Câu 5:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Công thức cấu tạo của phân tử axetilen: H−C≡C−H
Giữa hai nguyên tử cacbon có một liên kết ba.
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Etilen tham gia phản ứng cộng với dung dịch nước brom còn metan thì không phản ứng.
C2H4 + Br2 (dd) → C2H4Br2
Hiện tượng: Dung dịch nước brom bị mất màu.
CH4 + Br2 (dd) → Không phản ứng.
Không hiện tượng.
Câu 7:
Lượng oxi cần dùng để đốt cháy 4,48 lít khí etilen là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phương trình: C2H4 + 3O2 2CO2 + 2H2O
= = 0,2 (mol)
Theo phương trình: = 3 = 3.0,2 = 0,6 (mol)
Thể tích Oxi cần dùng: = 0,6.22,4 = 13,44 (l)
Câu 8:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Số thứ tự chu kì trong bảng hệ thống tuần hoàn cho biết số lớp electron.
Số tứ tự chu kì = số lớp electron của nguyên tử nguyên tố.
Câu 9:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Na, Mg, Al theo thứ tự từ trái sang phải cùng thuộc chu kì 3 có tính khi loại giảm dần.
Hay tính kim loại: Na > Mg > Al
Na, K theo thứ tự từ trên xuống dưới cùng thuộc nhóm IA có tính kim loại tăng dần.
Hay tính kim loại K > Na
Do đó tính kim loại giảm dần theo chiều từ: K > Na > Mg > Al.
Câu 10:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Chu kì 1 có 2 nguyên tố; chu kì 2 và 3 mỗi chu kì có 8 nguyên tố.
Mà: 13 = 2 + 8 + 3
Vậy nguyên tố M có số hiệu nguyên tử là 13 thuộc nhóm IIIA.
Câu 11:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Hợp chất hữu cơ là hợp chất của Cabon (trừ CO; CO2; H2CO3; muối cacbonat kim loại, muối cacbua, …)
Câu 12:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Etilen là chất khí, không màu, không mùi, ít tan trong nước và nhẹ hơn không khí.
Câu 13:
Kết luận đúng ghi chữ “Đ”, kết luận sai ghi chữ “S”:
|
Câu |
Nội dung |
Đ - S |
|
13.13 |
Etilen và Axetilen làm mất màu dung dịch brom vì phân tử có liên kết đôi và liên kết ba, trong đó có liên kết kém bền. |
|
|
13.14 |
Metan cũng có phản ứng cộng với brom dù phân tử không có liên kết đôi. |
|
|
13.15 |
Etilen cũng có phản ứng thế với clo giống metan. |
|
|
13.16 |
Cả metan, etilen và axetilen cháy đều toả nhiều nhiệt. |
|
 Xem đáp án
Xem đáp án
13.13: Đ
Etilen và axetilen làm mất màu dung dịch brom vì phân tử có liên kết đôi và liên kết ba, trong đó có liên kết kém bền.
13.14: S
Metan không có phản ứng cộng với brom.
13.15: S
Etilen có liên kết đôi trong phân tử nên ưu tiên phản ứng cộng.
13.16: Đ
Cả metan, etilen và axetilen cháy đều toả nhiều nhiệt.
Câu 14:
Lập PTHH cho phương trình sau, ghi điều kiện của phản ứng (nếu có):
C CO2 CaCO3 CO2 H2CO3
 Xem đáp án
Xem đáp án
1) C + O2 CO2 ↑
2) CO2 + CaO → CaCO3
3) CaCO3 CaO + CO2 ↑
4) CO2 + H2O ⇄ H2CO3
Câu 15:
Đốt cháy hoàn toàn 2,24 lít khí metan.
a. Viết phương trình hóa học của phản ứng.
b. Tính thể tích khí oxi và thể tích khí cacbonic tạo thành (ở đktc).
c. Viết công thức cấu tạo của khí CH4, C2H6, C2H4, C2H2.
 Xem đáp án
Xem đáp án
a. CH4 + 2O2 CO2 + 2H2O
b. = = 0,1 (mol)
Theo phương trình: = 2. = 2.0,1 = 0,2 (mol)
= 0,2.22,4 = 4,48 (l)
Theo phương trình: = = 0,1 (mol)
= 0,1.22,4 = 2,24 (l)
Vậy ở đktc = 4,48 lít; = 2,24 lít.
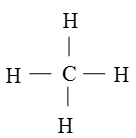
c. Công thức cấu tạo của CH4
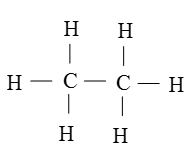
Công thức cấu tạo của C2H6
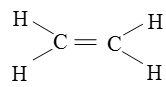
Công thức cấu tạo của C2H4
Công thức cấu tạo của C2H2