Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 8)
-
9456 lượt thi
-
23 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Nêu hiện tượng xảy ra, viết phương trình hóa học khi cho:
1. Một mẩu kim loại Na vào dung dịch CuSO4.
 Xem đáp án
Xem đáp án
1. Một mẩu kim loại Na vào dung dịch CuSO4:
Hiện tượng: Na tan dần trong dung dịch muối đồng sunfat, có kết tủa màu xanh tạo thành và có khí thoát ra.
Phương trình hóa học:
2Na + 2H2O → 2NaOH + H2↑
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
Câu 2:
2. Một dây kim loại Cu vào dung dịch AgNO3.
 Xem đáp án
Xem đáp án
2. Một dây kim loại Cu vào dung dịch AgNO3:
Hiện tượng: Có chất rắn màu xám (Ag) bám vào dây đồng, một phần dây đồng tan vào dung dịch, dung dịch ban đầu trong suốt chuyển sang màu xanh (Đồng (II) nitrat).
Phương trình hóa học:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
Câu 3:
3. Dung dịch CH3COOH vào Cu(OH)2.
 Xem đáp án
Xem đáp án
3. Dung dịch CH3COOH vào Cu(OH)2:
Hiện tượng: Chất rắn màu xanh tan dần, tạo thành dung dịch màu xanh.
Phương trình hóa học:
Cu(OH)2 + 2CH3COOH → (CH3COO)2Cu + 2H2O
Câu 4:
4. Cho mẩu Na vào cốc đựng rượu etylic khan.
(Biết Drượu etylic = 0,8 g/ ml; DNa = 0,97 g/cm3)
 Xem đáp án
Xem đáp án
4. Cho mẩu Na vào cốc đựng rượu etylic khan:
(Biết Drượu etylic = 0,8 g/ ml; DNa = 0,97 g/cm3)
Hiện tượng: Mẫu Na lơ lửng trong rượu, tan dần và có bọt khí không màu thoát ra
- Giải thích: Do: Drượu < DNa, nên Na chìm trong rượu, phản ứng với rượu làm Na tan dần, khí H2 tạo ra lực đẩy làm Na lơ lửng trong rượu.
Phương trình hóa học:
2Na(r) + 2C2H5OH → 2C2H5ONa + H2 ↑
Câu 5:
Hãy giải thích:
1. Vì sao khi cho một sợi đây đồng đã cạo sạch vào bình cắm hoa thì hoa sẽ tươi lâu hơn?
 Xem đáp án
Xem đáp án
1. Khi cho một sợi đây đồng đã cạo sạch vào bình cắm hoa thì hoa sẽ tươi lâu hơn vì: Đồng kim loại sẽ tạo nên một số ion Cu2+ tan vào trong nước sẽ có tác dụng diệt khuẩn, làm cho các cuống hoa đỡ bị thối trong nước. Do đó đỡ làm tắc các mao quản dẫn nước lên cánh hoa nên hoa tươi hơn.
Câu 6:
2. Vì sao các đồ vật làm bằng nhôm khó bị ăn mòn trong không khí?
 Xem đáp án
Xem đáp án
2. Các đồ vật làm bằng nhôm khó bị ăn mòn trong không khí vì: Trong không khí, Al tiếp xúc với khí O2, với H2O tạo ra lớp màng oxit nhôm Al2O3 mỏng nhưng rất bền vững. Lớp màng oxit nhôm bảo vệ nhôm tiếp xúc với môi trường bên ngoài, ngăn ngừa quá trình oxi hóa khử.
Câu 7:
3. Vì sao khi hạ đường huyết người ta cho uống nước đường thay vì ăn các loại thức ăn khác?
 Xem đáp án
Xem đáp án
3. Khi hạ đường huyết người ta cho uống nước đường thay vì ăn các loại thức ăn khác vì: Nước đường chứa đường đôi, khi cho bệnh nhân uống nhanh chóng chuyển hoá thành đường đơn trong cơ thể và được ấp thụ giúp tăng lại mức đường huyết. Các loại thức ăn khác thường chứa đường đa, tinh bột, béo, protein,.. nhiều chất khác nhau, quá trình phân giải và hấp thu sẽ rất lâu và không hiệu quả nhanh cho bệnh nhân.
Câu 8:
4. Vì sao trên thực tế người ta không dùng nước để dập tắt các đám cháy do xăng dầu? Nêu biện pháp xử lí các đám cháy do xăng dầu?
 Xem đáp án
Xem đáp án
4. Trên thực tế người ta không dùng nước để dập tắt các đám cháy do xăng dầu do:
Xăng dầu nhẹ hơn nước, nếu ta dập đám cháy gây ra bởi xăng dầu bằng nước thì nước lan tỏa đến đâu xăng dầu lan tỏa đến đó khiến đám cháy còn lan rộng lớn và khó dập tắt hơn.
Do đó khi ngọn lửa do xăng dầu cháy người ta hay thường dùng vải dày ướt trùm hoặc phủ cát lên ngọn lửa để cách li ngọn lửa với oxi (với các đám cháy nhỏ). Ngoài ra, còn dùng các hóa chất chuyên dụng để xử lý (với các đám cháy lớn).
Câu 9:
Cho biết A là hỗn hợp gồm Mg và Cu, hãy viết phương trình phản ứng theo sơ đồ sau:
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
A: Mg và Cu
Các phương trình hóa học xảy ra theo sơ đồ:
B: MgO; CuO;
MgO + 2HCl → MgCl2 + H2O
CuO + 2HCl → CuCl2 + H2O
C: MgCl2, CuCl2
2Na + 2H2O → 2NaOH + H2↑ (D)
2NaOH + MgCl2 → Mg(OH)2↓ + 2NaCl
2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl
E: NaCl
F: Mg(OH)2, Cu(OH)2
G: MgO, CuO.
Câu 10:
Quan sát hình vẽ điều chế khí X dưới đây và trả lời các câu hỏi:
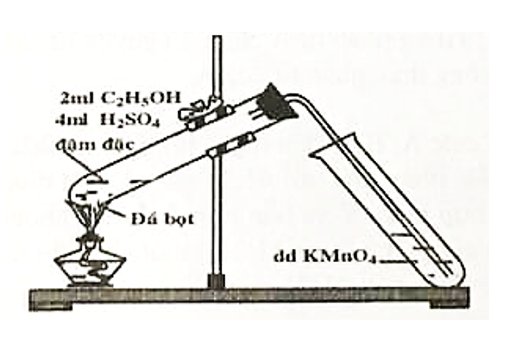
a) Khí X là gì? Nêu hiện tượng và viết phương trình hóa học khi dẫn khí X vào ống nghiệm đựng dung dịch KMnO4.
 Xem đáp án
Xem đáp án
a. Khí X là C2H4.
Khi dẫn khí X vào ống nghiệm đựng dung dịch KMnO4, màu tím của KMnO4 chuyển dần sang không màu và có vẩn đục màu đen.
3C2H4 + 4H2O + 2KMnO4 → 3C2H4(OH)2 + 2MnO2↓ + 2KOH
Câu 11:
b) Nêu vai trò của đá bọt trong thí nghiệm trên? Nếu khi làm thí nghiệm không có đá bọt em có thể thay bằng chất gì?
 Xem đáp án
Xem đáp án
b. Đá bọt giúp cho chất lỏng sôi êm dịu, có thể thay đá bọt bằng mảnh thủy tinh, vụn sứ…
Câu 12:
 Xem đáp án
Xem đáp án
Hai phương pháp để điều chế Na2CO3 tinh khiết:
Phương pháp 1:
Sục CO2 dư vào bình đựng dung dịch NaOH:
CO2 dư + NaOH → NaHCO3
Đun nóng dung dịch thu được Na2CO3:
2NaHCO3 Na2CO3 + CO2 + H2O
Phương pháp 2:
Lấy dung dịch NaOH vào 2 bình tam giác đến vạch chia (hai dung dịch có cùng thể tích ⇒ cùng số mol)
Sục CO2 đến dư vào bình thứ nhất, thu được dung dịch NaHCO3.
Sau đó đổ bình 2 (dung dịch NaOH) vào dung dịch thu được ở bình 1 ta sẽ thu được Na2CO3. Phương trình hóa học minh họa:
CO2 dư + NaOH → NaHCO3
NaHCO3 + NaOH → Na2CO3 + H2O
Câu 13:
Hỗn hợp X gồm 4 chất khí sau CO2, SO3, SO2 và H2. Trình bày phương pháp hóa học nhận biết từng khí trong hỗn hợp X. Viết các phương trình phản ứng xảy ra.
 Xem đáp án
Xem đáp án
Nhận biết từng khí trong hỗn hợp: CO2, SO3, SO2 và H2
Lấy một mẫu khí X làm thí nghiệm:
Bước 1: Dẫn hỗn hợp X qua dung dịch BaCl2 dư, nhận ra SO3 và loại bỏ được SO3.
Hiện tượng: có BaSO4↓ (màu trắng, không tan trong HCl)
Phương trình hóa học:
SO3 + H2O + BaCl2 → BaSO4↓ + 2HCl
Bước 2: Dẫn hỗn hợp khí sau khi đi ra khỏi bình dd BaCl2 vào dung dịch Br2 dư, nhận ra và loại bỏ khí SO2.
Hiện tượng: mất màu nâu đỏ của nước brom.
Phương trình hóa học:
SO2 + H2O + Br2 → H2SO4 + 2HBr
Bước 3: Dẫn hỗn hợp khí sau khi đi ra khỏi bình dung dịch brom, vào dung dịch nước vôi trong dư, nhận ra và loại bỏ CO2.
Hiện tượng: dung dịch nước vôi trong hóa đục do có CaCO3↓
Phương trình hóa học:
CO2 + Ca(OH)2 dư → CaCO3↓ + H2O
Bước 4: Khí còn lại dẫn qua ống đựng CuO nung nóng nhận ra H2.
Hiện tượng: Chất rắn ban đầu có màu đen (CuO) sau một thời gian chuyển sang màu đỏ (Cu).
Phương trình hóa học:
H2 + CuO Cu + H2O
Câu 14:
Một hỗn hợp X gồm các chất: K2O, KHCO3, NH4Cl, BaCl2 có số mol mỗi chất bằng nhau. Hoà tan hỗn hợp X vào nước, rồi đun nhẹ thu được khí Y, dung dịch Z và kết tủa M. Xác định các chất trong Y, Z, M và viết phương trình phản ứng xảy .
 Xem đáp án
Xem đáp án
Xác định Y, Z, M:
Đặt số mol mỗi chất là a
Các phương trình hóa học xảy ra như sau:
K2O + H2O → 2KOH
a → 2a mol
KOH + KHCO3 → K2CO3 + H2O
a → a → a mol
NH4Cl + KOH → KCl + NH3 ↑+ H2O
a ← a → a mol
BaCl2 + K2CO3 → BaCO3 ↓ + 2KCl
a → a → a mol
Vậy Y là NH3; dung dịch Z là KCl; M là BaCO3.
Câu 15:
Hòa tan hoàn toàn a gam kim loại R (hóa trị không đổi) vào dung dịch HCl được dung dịch X. Để trung hỏa lượng axit còn dư trong dung dịch X cần dùng 64 gam dung dịch NaOH 12,5%. Phản ứng xong thu được dung dịch ![]() chứa 4,68% NaCl và 13,33% RCl2. Cho tiếp lượng dư NaOH vào Y, lọc tách kết tủa tạo thành rồi đem nung đến khối lượng không đối được 14 gam chất rắn.
chứa 4,68% NaCl và 13,33% RCl2. Cho tiếp lượng dư NaOH vào Y, lọc tách kết tủa tạo thành rồi đem nung đến khối lượng không đối được 14 gam chất rắn.
1. Viết phương trình phản ứng.
 Xem đáp án
Xem đáp án
Các phương trình phản ứng xảy ra:
2R + 2xHCl → 2RClx + xH2 ↑ (1)
NaOH + HCl → NaCl + H2O (2)
RClx + xNaOH → R(OH)x + xNaCl (3)
R(OH)x R2Ox + H2O (4)
Câu 16:
2. Xác định R, tìm a và nồng độ phần trăm dung dịch HCl.
 Xem đáp án
Xem đáp án
Gọi hóa trị R là x, theo bài ra có:
Theo phương trình có mNaCl = 11,7 gam.
Từ 2 nồng độ xác định được:
m dung dịch Y = 250 gam và khối lượng RClx = 33,25 gam.
Ta có quá trình:
RClx → R(OH)x → R2Ox (14 gam).
Nhận thấy:
2RClx → R2Ox
Suy ra: R = 12 thỏa mãn x = 2 ⇒ R = 24, là Mg.
Thay số
Theo phương trình:
nHCl = 0,2 + 0,7 = 0,9 mol
⇒ mHCl = 32,85 gam ⇒ C%HCl = 18,24%.
Câu 17:
Cho hỗn hợp khí X gồm 3 hiđrocacbon A, B, C (với B, C là 2 chất kế tiếp nhau trong cùng một dãy đồng đẳng). Đốt cháy hoàn toàn 672ml hỗn hợp X rồi cho toàn bộ sản phầm cháy vào bình chứa 437,5ml dung dịch Ba(OH)2 0,08M, phản ứng xong thu được 4,925 gam kết tủa. Mặt khác, dẫn 1209,6ml hỗn hợp X qua bình chứa nước brom dư. Sau phản ứng thấy khối lượng bình brom tăng 0,468 gam và có 806,4ml hỗn hợp khí thoát ra. Biết các thể tích khí đo ở điều kiện tiêu chuẩn và các phản ứng xảy ra hoàn toàn.
1. Tìm công thức phân tử của A, B, C. Biết A, B, C thuộc trong các dãy ankan, anken, ankin.
 Xem đáp án
Xem đáp án
1. Khí A bị hấp thụ bởi dung dịch brom là anken hoặc ankin
, mà mA = 0,468 gam.
⇒ MA = 26 ⇒ A là C2H2.
Hỗn hợp khí thoát ra khỏi bình brom là 2 ankan B và C
Đặt CTTB của B và C là
Ta có: (trong 672ml hhX) = 0,01 mol
⇒
Sản phẩm cháy tác dụng với dung dịch Ba(OH)2
TH1: Chỉ tạo muối trung hòa, Ba(OH)2 dư
⇒ 0,01.2 + 0,02. = 0,025 ⇒ = 0,25 (loại)
TH2: Tạo 2 muối:
BaCO3 (0,025 mol) và Ba(HCO3)2 (0,035 – 0,025 = 0,01 mol).
⇒
⇒ B, C là CH4 (x mol) và C2H6 (y mol)
Câu 19:
Cho 9,2 gam hỗn hợp X gồm Mg và Fe vào dung dịch hỗn hợp AgNO3 và Cu(NO3)2 thu được chất rắn Y và dung dịch Z. Hòa tan hết Y bằng dung dịch H2SO4 đặc, nóng, dư thu được 6,384 lít khí SO2 (sản phẩm khử duy nhất, ở điều kiện tiêu chuẩn). Cho dung dịch NaOH dư vào Z, thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi, thu được 8,4 gam hỗn hợp rắn. Tính thành phần phần trăm theo khối lượng của mỗi kim loại trong X? (Biết các phản ứng xảy ra hoàn toàn).
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
Vì mhh oxit = 8,4 gam < mX = 9,2 gam nên kim loại dư ⇒ 2 muối hết.
Mặt khác chất rắn thu được là hỗn hợp và Mg hoạt động hóa học mạnh hơn Fe
⇒ Mg hết, Fe đã phản ứng một phần.
- Gọi a, b lần lượt là số mol của Mg và Fe phản ứng, c là số mol Fe dư
Bảo toàn e với SO2 ⇒ 2a + 2b + 3c = 0,57
(Giải thích: )
Khối lượng hỗn hợp X = 9,2 ⇒ 24a + 56b + 56c = 9,2
Khối lượng hỗn hợp rắn = 8,4 gam ⇒ 40a + 80b = 8,4
Giải các hệ phương trình được: a = 0,15 mol; b = 0,03 mol; c = 0,07 mol
Câu 20:
Cho một hợp chất A có chứa các nguyên tố C, H, O và nguyên tố X. Kết quả phân tích cho thấy % khối lượng các nguyên tố C, H, O trong A lần lượt là 44,72%; 1,24%; 9,94% và còn lại là % khối lượng của X. Trong phân tử A chứa 2 nguyên tử oxi và số nguyên tử X gấp 2 lần số nguyên tử oxi. Xác định công thức phân tử của A.
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
A chứa 2O và số nguyên tử X gấp 2 lần O nên có 4 nguyên tử X.
Vậy công thức của A có dạng CaHbO2X4
⇒
⇒
⇒
⇒ MA = 12.12 + 4.1 + 16.2 + 4.MX = 322
⇒ MX = 35,5 ⇒ X: Cl
Vậy công thức của A là C12H4O2Cl4.
Câu 21:
Hỗn hợp X chứa 3 este A, B, C đều mạch hở, không phân nhánh (không chứa nhóm chức khác) và . Để phản ứng với 41,24 gam X cẩn dùng 280 ml dung dịch NaOH 2M (đun nóng), thu được hỗn hợp muối Y và hỗn hợp Z chứa 3 ancol no. Trộn hỗn hợp Y với vôi tôi xút ( CaO, NaOH) dư, đun nóng, thu được 11,2 lít một chất khí duy nhất là metan (đo ở điều kiện tiêu chuẩn). Mặt khác, để đốt cháy 41,24 gam X cần dùng 42,784 lít O2 (đo ở điều kiện tiêu chuẩn).
1. Xác định công thức phân tử của các muối trong Y.
 Xem đáp án
Xem đáp án
1. Khí duy nhất thoát ra từ phản ứng vôi tôi xút và là hiđrocacbon no đơn giản nhất ⇒ X là CH4
X chứa 3 este mạch hở, không phân nhánh và Y là hỗn hợp muối tham gia phản ứng với vôi tôi xút tạo ra CH4
Y có chứa CH3COONa và CH2(COONa)2.
Câu 22:
2. Xác định công thức phân tử của A.
 Xem đáp án
Xem đáp án
2. Gọi x, y lần lượt là số mol của CH3COONa và CH2(COONa)2
Theo đề bài ta có: nX = x + y = 0,5 (I); (II)
⇒ x = 0,44; y = 0,06
Gọi a, b lần lượt là số mol CO2, H2O khi đốt 41,24 gam X
Áp dụng ĐLBTKL:
⇒ 44a + 18b = 41,24 + 1,91.32 (*)
BTNT với O: 2a + b = (0,44.2 + 0,06.4) + 1,91.2 (**)
Từ (*) và (**) ⇒ a = 1,68; b = 1,58
⇒
⇒ Số nguyên tử C trung bình của X =
⇒ Phải có 1 este là CH3COOCH3 (0,36 mol)
Vì ⇒ A là CH3COOCH3 (C3H6O2).
Câu 23:
3. Tính thành phần phần trăm về khối lượng của các ancol có trong hỗn hợp Z.
 Xem đáp án
Xem đáp án
⇒ Trong X có chứa: 1 este 2 chức axit và 1 este 2 chức ancol
Bảo toàn khối lượng cho phản ứng xà phòng hóa ta có:
mX + mNaOH = mmuối + mancol
⇒ = 18,68 gam
- Trường hợp 1: 2 este 2 chức là (CH3COO)2A và CH2(COOB)2
⇒ Các ancol gồm:
⇒ (A+34).0,04 + (B+17).0,12 + 32.0,36 = 18,68
⇒ A + 3B = 94
Vì B = 29 (C2H5-) ⇒ A = 7 (loại)
- Trường hợp 2: hai este đa chức là (CH3COO)2A: 0,04 mol và CH3OOC – CH2- COOB (0,06 mol)
⇒ Các ancol gồm:
⇒ 2A + 3B = 143
⇒ Cặp giá trị phù hợp là A = 28 (-C2H4-) và B = 29 (C2H5-)
Các ancol là C2H4(OH)2; CH3OH; C2H5OH
