Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 6)
-
9408 lượt thi
-
18 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Viết phương trình hóa học của phản ứng (nếu có) khi cho lần lượt: Na, NaOH, Na2CO3 vào chất lỏng nguyên chất sau:
a) Rượu etylic.
 Xem đáp án
Xem đáp án
Phương trình hóa học:
a) 2Na + 2C2H5OH ⟶ 2C2H5ONa + H2
Câu 2:
b) Axit axetic.
 Xem đáp án
Xem đáp án
b) 2Na + 2CH3COOH ⟶ 2CH3COONa + H2
NaOH + CH3COOH ⟶ CH3COONa + H2O
Na2CO3 + 2CH3COOH ⟶ 2CH3COONa + CO2 + H2O
Câu 3:
Viết phương trình hóa học thực hiện dãy chuyển hóa sau, ghi rõ điều kiện phản ứng (nếu có):
Tinh bột Glucozơ Rượu Etylic Axit axetic Etyl axetat
 Xem đáp án
Xem đáp án
Phương trình hóa học:
(C6H10O5)n + nH2O nC6H12O6
C6H12O6 2C2H5OH + 2CO2
C2H5OH + O2 CH3COOH
CH3COOH + C2H5OH CH3COOC2H5 + H2O
Câu 4:
Hòa tan hoàn toàn a mol Ba vào dung dịch chứa a mol HCl, thu được dung dịch X. Cho lượng dư dung dịch X lần lượt vào ống nghiệm riêng biệt đựng các chất sau: dung dịch Na2SO4, Al (rắn), dung dịch (NH4)2CO3, dung dịch AlCl3. Viết phương trình hóa học của phản ứng (nếu có) trong các ống nghiệm trên.
 Xem đáp án
Xem đáp án
Phương trình hóa học:
Dung dịch X:
* Tác dụng với dung dịch Na2SO4:
Na2SO4 + BaCl2 ⟶ BaSO4 + 2NaCl
Na2SO4 + Ba(OH)2 ⟶ BaSO4 + 2NaOH
* Tác dụng với Al:
2Al + 2H2O + Ba(OH)2 ⟶ Ba(AlO2)2 + 3H2
* Tác dụng với dung dịch (NH4)2CO3:
(NH4)2CO3 + BaCl2 ⟶ BaCO3 + 2NH4Cl
(NH4)2CO3 + Ba(OH)2 ⟶ BaCO3 + 2NH3 + 2H2O
* Tác dụng với dung dịch AlCl3:
2AlCl3 + 3Ba(OH)2 3BaCl2 + 2Al(OH)3
2Al(OH)3 + Ba(OH)2 Ba(AlO2)2 + 4H2O
Câu 5:
Nung 82,4 gam hỗn hợp X gồm Na2CO3 và NaHCO3 đến khối lượng không đổi, thu được 70 gam chất rắn. Tính thành phần phần trăm khối lượng các chất trong hỗn hợp X.
 Xem đáp án
Xem đáp án
Gọi số mol NaHCO3 là 2a. Phương trình hóa học:
Theo phương trình khối lượng giảm do H2O và CO2 thoát ra:
mchất rắn ban đầu - mchất rắn sau phản ứng = = 82,4 – 70 = 12,4 gam.
⇔ (18 + 44)a = 12,4
⇔ a = 0,4 mol
Phần trăm khối lượng các chất:
Câu 6:
Lấy hai ví dụ minh họa điều chế khí Y từ chất rắn X theo mô hình thí nghiệm sau:
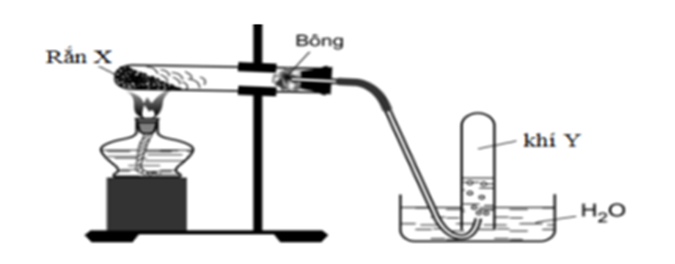
Cho biết X, Y là chất nào? Viết phương trình hóa học của phản ứng xảy ra trong ống nghiệm được đun nóng?
 Xem đáp án
Xem đáp án
Các chất tương ứng:
|
X |
Y |
PTHH |
|
KMnO4 |
O2 |
2KMnO4 K2MnO4 + MnO2 + O2 |
|
CH3COONa |
CH4 |
CH3COONa + NaOH CH4 + Na2CO3 |
Câu 7:
Cho m gam Al và 300 ml dung dịch X gồm Fe(NO3)3 2M và Cu(NO3)2 1M, sau khi phản ứng xảy ra hoàn toàn thu được 36 gam kim loại. Mặt khác hòa tan hết m gam Al ở trên bằng dung dịch HNO3 loãng (vừa đủ) thu được 267,12 gam dung dịch Y và khí NO (sản phẩm khử duy nhất). Làm lạnh Y đến 200C thì có x gam tinh thể Al(NO3)3.9H2O tách ra khỏi dung dịch. Biết độ tan của Al(NO3)3 ở 200C là 75,44 gam. Xác định giá trị của m và x.
 Xem đáp án
Xem đáp án
- Số mol: Fe(NO3)3: 0,6 mol; Cu(NO3)2: 0,3 mol
- Phương trình hóa học:
- Sau phản ứng (2), khối lượng Cu tạo ra = 0,3.64 = 19,2 gam nên có Fe tạo ra;
= 0,3 mol
- Theo phương trình hóa học (1), (2), (3): nAl = 0,6 mol
- Khi tác dụng với dung dịch HNO3:
- Trong 267,12 gam dung dịch Y có:
- Giả sử sau khi hạ nhiệt độ có a mol Al(NO3)3.9H2O tách ra
(gam)
- Dung dịch thu được sau khi hạ nhiệt độ gồm:
- Có thể tính giá trị của a như sau:
Câu 8:
Cho hỗn hợp X gồm: O2, HCl, SO2. Trình bày phương pháp tách riêng từng khí trong X mà không làm giảm khối lượng các chất. Viết phương hóa học phản ứng xảy ra.
 Xem đáp án
Xem đáp án
Phương pháp tách riêng từng khí trong X:
* Cách 1:
- Dẫn hỗn hợp X qua dung dịch NaCl (bão hòa) dư thu được dung dịch A gồm NaCl, HCl và khí B thoát ra gồm O2, SO2. Đun nóng dung dịch A thu được khí HCl thoát ra.
- Dẫn khí B qua dung dịch Ca(OH)2 dư, thu được khí thoát ra là O2, kết tủa CaSO3. Lọc kết tủa, cho tác dụng với H2SO4 thu được SO2 thoát ra.
SO2 + Ca(OH)2 ⟶ CaSO3 + H2O
CaSO3 + H2SO4 ⟶ CaSO4 + SO2 + H2O
* Cách 2:
- Dẫn hỗn hợp khí vào dung dịch Ba(OH)2 dư, thu được oxi không phản ứng thoát ra khỏi dung dịch.
Ba(OH)2 + SO2 ⟶ BaSO3 + H2O
Ba(OH)2 +2HCl ⟶ BaCl2 + 2H2O
- Lọc kết tủa rồi cho phản ứng với dung dịch H2SO4 dư thu được khí SO2.
BaSO3 + H2SO4 ⟶ BaSO4 + SO2 + H2O
- Phần dung dịch còn lại ở trên gồm BaCl2 và Ba(OH)2 dư cho tác dụng với dung dịch H2SO4 dư
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
BaCl2 + H2SO4 → BaSO4 + 2HCl
- Lọc kết tủa, đem cô cạn dung dịch thu được HCl có lẫn hơi nước được dẫn qua bình chứa H2SO4 đặc (dư) thu được khí HCl tinh khiết.
Câu 9:
Cho hỗn hợp X ở điều kiện thường gồm ba hiđrocacbon mạch hở, không có liên kết ba và trong phân tử mỗi chất có không quá một liên kết đôi. Trộn m gam hỗn hợp X với 4,032 lít khí O2 thu được 4,704 lít hỗn hợp khí Y (các thể tích khí đều đo ở đktc). Đốt cháy hoàn toàn hỗn hợp Y, hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ca(OH)2 0,02M, sau phản ứng thu được 3 gam kết tủa và dung dịch Z. Khối lượng dung dịch Z so với dung dịch Ca(OH)2 ban đầu giảm 0,282 gam. Đun nóng dung dịch Z, thu được thêm 0,3 gam kết tủa (cho biết các phản ứng hóa học đều xảy ra hoàn toàn).
a) Xác định giá trị của m và thể tích dung dịch Ca(OH)2 đã dùng.
 Xem đáp án
Xem đáp án
Ta có: ;
- Sản phẩm cháy hỗn hợp X là CO2 và H2O hấp thụ vào dung dịch Ca(OH)2 thu được 3 gam kết tủa và dung dịch Z. Đun nóng Z thu thêm 0,3 gam kết tủa nên Z chứa Ca(HCO3)2.
- Phương trình hóa học
- Theo phương trình hóa học:
+ (lít)
+
- Khối lượng dung dịch Z giảm 0,282 gam so với dung dịch Ca(OH)2:
⇒
(gam)
- Bảo toàn khối lượng các nguyên tố trong X:
(gam)
Câu 10:
b) Xác định công thức phân tử của 3 hiđrocacbon trong X.
 Xem đáp án
Xem đáp án
b) Ta có: nên X là hỗn hợp của ankan và anken.
Số nguyên tử C trung bình: nên trong X có CH4.
*TH1:
Nếu cả 3 chất là ankan
nankan = (loại)
*TH2:
2 hiđrocacbon còn lại đều là anken: CnH2n
Bảo toàn C trong X:
X: {CH4, C2H4, C4H8}
*TH3: 2 hiđrocacbon còn lại là ankan (CnH2n+2) và anken (CmH2m)
(anken: C2H4)
Với ta có:
|
n |
2 |
3 |
4 |
|
ankan |
C2H6 |
C3H8 |
C4H10 |
Vậy hỗn hợp X:
Vậy có bốn cặp nghiệm thỏa mãn:
Câu 11:
Hỗn hợp A gồm rượu etylic và 2 axit hữu cơ có dạng CnH2n+1COOH và Cn+1H2n+3COOH. Chia A thành 2 phần bằng nhau:
- Phần 1 tác dụng hết với Na dư, thu được 3,92 lít khí H2 (đktc).
- Phần 2 đem đốt cháy hoàn toàn, dẫn toàn bộ sản phẩm lần lượt qua bình 1 đựng dung dịch H2SO4 đặc (dư), bình 2 đựng dung dịch Ba(OH)2 dư. Sau khi các phản ứng xảy ra hoàn toàn thì khối lượng bình 1 tăng 17,1 gam, bình 2 thu được 147,75 gam kết tủa.
Xác định công thức cấu tạo và khối lượng của 2 axit trong A.
 Xem đáp án
Xem đáp án
Gọi công thức tổng quát của 2 axit: hay
- Gọi số mol trong ;
- Số mol: ;
;
- Phương trình hóa học:
C2H5OH + Na ⟶ C2H5ONa + H2 (1)
+ Na ⟶ + H2 (2)
C2H5OH + 3O2 2CO2 + 3H2O (3)
(4)
CO2 + Ba(OH)2 ⟶ BaCO3 + H2O (5)
- Theo phương trình hóa học:
- Công thức hóa học của 2 axit: CH3COOH (c mol) và C2H5COOH (d mol)
- Khối lượng mỗi axit trong A:
Câu 12:
Hỗn hợp Y gồm Na, Al, Fe. Lấy 3 lượng bằng nhau của Y khi thực hiện các thí nghiệm:
Thí nghiệm 1: Cho Y tác dụng với nước dư, thu được V lít khí.
Thí nghiệm 2: Cho Y tác dụng với dung dịch NaOH dư, thu được 7V/4 lít khí.
Thí nghiệm 3: Cho Y tác dụng với dung dịch HCl dư, thu được 9V/4 lít khí.
Xác định thành phần phần trăm khối lượng mỗi chất trong hỗn hợp Y (biết thể tích các khí đo ở cùng điều kiện, các phản ứng xảy ra hoàn toàn).
 Xem đáp án
Xem đáp án
Hỗn hợp Y:
(Trong cùng điều kiện phản ứng thì tỉ lệ thể tích bằng tỉ lệ số mol các chất khí)
- Thí nghiệm 1: Tác dụng H2O dư
- Thí nghiệm 2: Tác dụng dung dịch NaOH dư
- Thí nghiệm 3: Tác dụng dung dịch HCl dư
- Lượng H2 thoát ra ở thí nghiệm 2 lớn hơn ở thí nghiệm 1 nên sau thí nghiệm 1 kim loại Al còn dư.
- Theo phương trình hóa học xảy ra ở các thí nghiệm ta có:
Câu 13:
Cho các phương trình hóa học sau:
(X) (A) + (B)
(X) + HCl (đặc) (A) + (E) + H2O
(X) + (D) (A) + (F)
(X) + (Z) (A) + (G)
Biết (B), (E), (F), (G) là các chất khí ở điều kiện thường, tỷ khối hơi của (F) so với (G) bằng 0,6875; (X), (A), (Y), (D), (Z) là các chất rắn, (D) và (Z) là các đơn chất.
a) Xác định các chất (X), (Y), (A), (B), (E), (F), (D), (Z), (G).
 Xem đáp án
Xem đáp án
a) Các chất tương ứng:
|
X |
Y |
A |
B |
E |
F |
D |
Z |
G |
|
KClO3 |
MnO2 |
KCl |
O2 |
Cl2 |
CO2 |
C |
S |
SO2 |
Câu 14:
b) Hoàn thành các phương trình hóa học trên.
 Xem đáp án
Xem đáp án
b) Phương trình hóa học:
2KClO3 2KCl + 3O2
KClO3 + 6HClđặc KCl + 3Cl2 + 3H2O
2KClO3 + 3C 2KCl + 3CO2
2KClO3 + 3S 2KCl + 3SO2
Câu 15:
c) Trình bày phương pháp nhận biết các chất khí (B), (E), (F), (G) đựng trong các lọ mất nhãn. Viết phương trình hóa học của các phản ứng xảy ra.
 Xem đáp án
Xem đáp án
c) Nhận biết 4 chất khí O2, Cl2, CO2, SO2:
- Đánh số thứ tự và trích mẫu thử trên các lọ mất nhãn.
- Dẫn từng mẫu khí qua dung dịch brom, nếu khí nào làm nhạt màu dung dịch brom thì khí đó là SO2.
SO2 + Br2 + 2H2O → 2HBr + H2SO4
- Dẫn 3 khí còn lại vào dung dịch nước vôi trong dư, nếu khí nào phản ứng làm vẩn đục dung dịch thì khí đó là CO2.
CO2 + Ca(OH)2 → CaCO3 ↓+ H2O
- Cho quỳ tím ẩm vào 2 mẫu khí còn lại, nếu quỳ tím chuyển đỏ rồi mất màu thì mẫu thử là Cl2 vì sinh ra HClO có tính tẩy màu
Cl2 + H2O ⇄ HCl + HClO
+ Khí còn lại (làm tàn đóm đỏ bùng cháy trở lại) là O2.
Câu 16:
Hỗn hợp X gồm Cu, CuO, Fe và FexOy. Hòa tan hết m gam X trong dung dịch chứa 0,72 mol HCl (dùng dư 20% so với lượng cần phản ứng), thu được 0,06 mol khí H2 và 270,8 gam dung dịch Y (có chứa muối sắt III). Mặt khác hòa tan hết m gam X trong dung dịch H2SO4 đặc, nóng thu được dung dịch Z (chứa 3 chất tan) và 2,016 lít khí SO2 (sản phẩm khử dung nhất của H2SO4 ở đktc). Cho Z tác dụng với dung dịch Ba(OH)2 dư thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi thu được 99,29 gam chất rắn. Xác định nồng độ phần trăm của FeCl3 trong dung dịch Y.
 Xem đáp án
Xem đáp án
- Khi tác dụng HCl: nHCl phản ứng = = 0,6 mol;
nHCl dư = 0,72 – 0,6 = 0,12 (mol)
CuO + 2HCl → CuCl2 + H2O (1)
FexOy + yHCl → xFeCl2y/x + yH2O (2)
Fe + 2HCl → FeCl2 + H2 (3)
Cu + FeCl3 → CuCl2 + FeCl2 (4)
Fe + 2FeCl3 → 3FeCl2 (5)
- Số mol các chất trong 270,8 gam dung dịch Y
- Trong dung dịch trung hòa về điện (hoặc bảo toàn Cl trong muối) ta có: (*)
- Khi tác dụng H2SO4 đặc, nóng:
CuO + H2SO4 ⟶ CuSO4 + H2O (6)
2FexOy + (6x-2y)H2SO4 ⟶ xFe2(SO4)3 + (6x-2y)H2O + (3x-2y)SO2 (7)
2Fe + 6H2SO4 ⟶ Fe2(SO4)3 + 6H2O + 3SO2 (8)
Cu + 2H2SO4 ⟶ CuSO4 + 2H2O + SO2 (9)
Fe + Fe2(SO4)3 ⟶ 3FeSO4 (10)
Cu + Fe2(SO4)3 ⟶ CuSO4 + 2FeSO4 (11)
- Các chất trong dung dịch Z
- Bảo toàn Fe ta có: (**)
- Khi Z tác dụng dung dịch Ba(OH)2 dư, tách kết tủa rồi nung
FeSO4 + Ba(OH)2 → BaSO4 + Fe(OH)2 (12)
Fe2(SO4)3 + 3Ba(OH)2 → 3BaSO4 + 2Fe(OH)3 (13)
CuSO4 + Ba(OH)2 → BaSO4 + Cu(OH)2 (14)
- Kết tủa T
4Fe(OH)2 + O2 2Fe2O3 + 4H2O (15)
2Fe(OH)3 Fe2O3 + 3H2O (16)
Cu(OH)2 CuO + H2O (17)
- Theo phương trình hóa học (1, 2, 3):
- Theo phương trình hóa học (6,7,8,9):
- Bảo toàn S: số mol gốc SO42- trong muối = = 0,42 – 0,09 = 0,33 (mol)
- Bảo toàn S, Fe, Cu: chất rắn còn lại (99,29 gam) gồm
⇒ 99,29 = 0,33.233 + 80(d +2e) + 80c (***)
- Thay (**) vào (***) ta có: 80(a + b) + 80c = 22,4 (****)
- Từ (*) và (****) ta có: a = 0,04 (mol)
- Phần trăm khối lượng FeCl3 trong dung dịch Y:
.
Câu 17:
Chọn 5 chất rắn khác nhau và viết phương trình hóa học của phản ứng khi cho mỗi chất đó tác dụng với dung dịch H2SO4 đặc nóng (vừa đủ) thu được khí SO2 có tỉ lệ mol tương ứng với các giá trị:
a) x = 1 b) x = c) x = d) x = 10
 Xem đáp án
Xem đáp án
Các chất rắn: CaSO3 (C, P), NaHSO3, FeS, Fe3O4, Cu. Phương trình hóa học:
CaSO3 + H2SO4 CaSO4 + H2O + SO2 (x = 1)
2NaHSO3 + H2SO4 Na2SO4 + 2H2O + 2SO2 (x = 0,5)
2FeS + 10H2SO4 Fe2(SO4)3 + 10H2O + 9SO2 (x = 10 : 9)
2Fe3O4 + 10H2SO4 3Fe2(SO4)3 + 10H2O + SO2 (x =10)
Cu + 2H2SO4 CuSO4 + 2H2O + SO2 (x = 2)
Câu 18:
Hỗn hợp X gồm 3 este đều mạch hở, không phân nhánh và không chứa nhóm chức khác. Thủy phân hoàn toàn 33,15 gam X cần dùng vừa đủ 300ml dung dịch NaOH 1,5M thu được hỗn hợp Y chứa 3 ancol (rượu) đều no và hỗn hợp muối Z. Lấy toàn bộ Z đun nóng với hỗn hợp vôi tôi xút (phản ứng vôi tôi xút: R(COONa)a + aNaOH R(H)a + aNa2CO3), thu được duy nhất một hiđrocacbon đơn giản nhất có thể tích là 9,408 lít (đktc). Mặt khác, đốt cháy hoàn toàn 33,15 gam X cần dùng vừa đủ 34,44 lít khí O2 (đktc). Biết được trong phân tử ancol mỗi nguyên tử cacbon no chỉ liên kết với một nhóm (OH).
a) Xác định công thức cấu tạo của các este trong X.
b) Xác định thành phần phần trăm khối lượng của các este trong X.
 Xem đáp án
Xem đáp án
Sơ đồ thủy phân:
R1(COOR)x + xNaOH R1(COONa)x + xROH (1)
- Vì các este đều mạch hở, không phân nhánh nên tối đa 2 chức; vì hỗn hợp muối đun nóng với hỗn hợp vôi tôi xút thu được duy nhất một hiđrocacbon đơn giản nhất là CH4 nên 2 muối là CH3COONa (a mol) và CH2(COONa)2 (b mol).
- Số mol: ;
;
- Theo phương trình hóa học:
- Sơ đồ phản ứng khi đốt cháy X: X + O2 CO2 + H2O (4)
- Hỗn hợp sau phản ứng:
+ Bảo toàn khối lượng: 44u + 18v = 33,15 + 1,5375.32
+ Bảo toàn O ta có:
- Ta có:
- Từ số mol 2 muối, số mol 3 este, thủy phân tạo được 3 ancol
X ở dạng
nên
⇒
Nghiệm duy nhất:
Hỗn hợp X:
