Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 9)
-
9457 lượt thi
-
22 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Tổng số hạt p, n, e của hai nguyên tử các nguyên tố A và B là 177; trong đó: tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 47. Số hạt mang điện của B nhiều hơn A là 8.
a) Xác định các nguyên tố A và B.
 Xem đáp án
Xem đáp án
a)
Gọi PA, NA, PB, NB lần lượt là số proton, nơtron của nguyên tử nguyên tố A và B.
Theo bài ra ta có hệ phương trình:
A là Fe, B là Zn.
Câu 2:
b) Cho 18,6 gam hỗn hợp gồm A và B tác dụng với dung dịch axit HCl vừa đủ thu được dung dịch X. Cô cạn dung dịch X thu được 39,9 gam hỗn hợp muối khan. Nếu cho X tác dụng với dung dịch AgNO3 dư thu được m gam kết tủa. Viết phương trình hóa học xảy ra và tính giá trị của m.
 Xem đáp án
Xem đáp án
b)
Gọi số mol của Fe và Zn lần lượt là x và y.
Fe + 2HCl FeCl2 + H2 ↑ (1)
x x mol
Zn + 2HCl ZnCl2 + H2 ↑ (2)
y y mol
Theo bài ra ta có hệ phương trình:
Vậy
ZnCl2 + 2AgNO3 Zn(NO3)2 + 2AgCl↓ (3)
0,2 0,4 mol
FeCl2 + 3AgNO3 Fe(NO3)3 + 2AgCl↓ + Ag↓ (4)
0,1 0,2 0,1 mol
Vậy m = mAgCl + mAg = (0,4 + 0,2).143,5 + 0,1.108 = 96,9 gam.
Câu 3:
Tiến hành các thí nghiệm sau:
1. Sục từ từ 0,075 mol khí CO2 vào 225 ml dung dịch NaOH 0,5M.
 Xem đáp án
Xem đáp án
Sục từ từ 0,075 mol khí CO2 vào 225 ml dung dịch NaOH 0,5M.
nNaOH = 0,225.0,5 = 0,1125 mol
Ta có: Phản ứng tạo 2 muối.
Phương trình hóa học minh họa:
2NaOH + CO2 Na2CO3 + H2O
Na2CO3 + CO2 + H2O 2NaHCO3.
Câu 4:
2. Sục khí Cl2 dư vào dung dịch FeSO4.
 Xem đáp án
Xem đáp án
2. Sục khí Cl2 dư vào dung dịch FeSO4.
Phương trình hóa học:
6FeSO4 + 3Cl2 2Fe2(SO4)3 + 2FeCl3
Câu 5:
3. Hoà tan hỗn hợp KHSO4 và NaHCO3 (tỉ lệ mol 1:1) vào nước dư.
 Xem đáp án
Xem đáp án
3. Hoà tan hỗn hợp KHSO4 và NaHCO3 (tỉ lệ mol 1:1) vào nước dư.
Phương trình hóa học:
2NaHCO3 + 2KHSO4 Na2SO4 + K2SO4 + 2CO2↑ + 2H2O
Câu 6:
4. Cho hỗn hợp Cu và Fe2O3 (ti lệ mol 1:1) vào dung dịch HCl dư.
Viết phương trình hoá học cho phản ứng xảy ra trong các thí nghiệm trên.
 Xem đáp án
Xem đáp án
4. Cho hỗn hợp Cu và Fe2O3 (ti lệ mol 1:1) vào dung dịch HCl dư.
Phương trình hóa học:
Fe2O3 + 6HCl 2FeCl3 + 3H2O
Cu + 2FeCl3 CuCl2 + 2FeCl2
Câu 7:
Canxi hidroxit là một bazơ có nhiều ứng dụng trong đời sống. Nước vôi trong là dung dịch loãng của canxi hidroxit. Viết phương trình hoá học giải thích các ứng dụng sau của canxi hidroxit:
a. Dùng nước vôi trong bôi lên phần da vừa bị ong, kiến đốt cho đỡ đau buốt. Biết thành phần chính của nọc ong, kiến là axit fomic (HCOOH).
 Xem đáp án
Xem đáp án
Các phương trình giải thích các ứng dụng:
a) Dùng nước vôi trong bôi lên phần da vừa bị ong, kiến đốt cho đỡ đau buốt do:
Ca(OH)2 + 2HCOOH (HCOO)2Ca + 2H2O
Câu 8:
 Xem đáp án
Xem đáp án
b) Dùng nước vôi trong khử độc các chất thải công nghiệp chứa SO2, H2S,...
Ca(OH)2 dư + SO2 CaSO3↓ + H2O
Ca(OH)2 dư + H2S CaS + 2H2O
Câu 9:
Dùng phương pháp hoá học, hãy nhận biết các chất riêng biệt sau: CuO, Al2O3, FeO, MgO, BaO bằng 2 hoá chất (không tính không khí) khi đồ dùng, thiết bị cơ bản có đủ.
 Xem đáp án
Xem đáp án
Sử dụng 2 hóa chất để nhận biết: Nước và dung dịch HCl.
Đánh số thứ tự từng hóa chất mất nhãn, trích mẫu thử.
+ Cho một lượng nước dư vào các mẫu thử, lắc đều:
- Nếu mẫu thử nào tan hoàn toàn tạo dung dịch trong suốt là BaO.
BaO + H2O Ba(OH)2 (*)
- Nếu không có hiện tượng là: CuO, Al2O3, FeO, MgO.
+ Thu lấy dung dịch ở (*) cho vào lần lượt các mẫu thử còn lại:
- Nếu mẫu thử nào tan, tạo dung dịch trong suốt là Al2O3.
Ba(OH)2 + Al2O3 Ba(AlO2)2 + H2O
- Nếu không có hiện tượng là: CuO, FeO, MgO.
+ Cho dung dịch HCl (dư) vào các mẫu thử còn lại, lắc đều:
- Mẫu thử tan tạo dung dịch màu xanh là CuO.
CuO + 2HCl CuCl2 + H2O
- Mẫu thử tạn tạo dung dịch mà lục nhạt là FeO.
FeO + 2HCl FeCl2 + H2O
- Mẫu thử tan tạo dung dịch trong suốt là MgO.
MgO + 2HCl MgCl2 + H2O
Câu 10:
Viết phương trình hoá học hoàn thành sơ đồ chuyển hoá bên, biết:
- Các chất trong sơ đồ từ H1 đến H11 là chất hữu cơ khác nhau;
- H6 là chất khí thuộc loại hidrocabon sinh ra khi hoa quả chín;
- H7 là polime thiên nhiên, thành phần chính trong nhiều loại ngũ cốc;
- H11 là polime có tính đàn hồi cao.
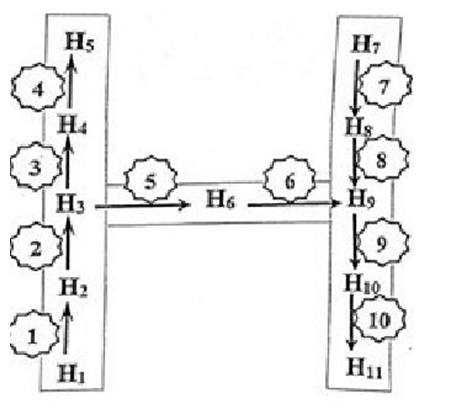
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
|
H1 |
CH3COONa |
H7 |
|
|
H2 |
CH4 |
H8 |
C6H12O6 |
|
H3 |
C2H2 |
H9 |
C2H5OH |
|
H4 |
CH3CHO |
H10 |
CH2=CH-CH=CH2 |
|
H5 |
CH3COOH |
H11 |
|
|
H6 |
C2H4 |
|
|
Các phương trình hóa học minh họa:
(1) CH3COONa + NaOHCH4↑ + Na2CO3
(2) 2CH4 C2H2 + 3H2
(3) C2H2 + H2O CH3CHO
(4) CH3CHO + Br2 + H2O ® CH3COOH + 2HBr
(5) C2H2 + H2C2H4
(6) C2H4 + H2O C2H5OH
(7)
(8)
(9) 2C2H5OH CH2=CH-CH=CH2 + 2H2O
(10)
Câu 11:
 Xem đáp án
Xem đáp án
FeO + H2SO4 FeSO4 + H2O
0,4 → 0,4 → 0,4 mol
Dung dịch Y:
Câu 12:
 Xem đáp án
Xem đáp án
Gọi công thức muối cacbonat: R2(CO3)n (n là hóa trị của R).
CaCO3 + 2HCl CaCl2 + CO2↑ + H2O
R2(CO3)n + 2nHCl 2RCln + 2nCO2↑ + nH2O
CaCO3 + 2HCl CaCl2 + CO2↑ + H2O
0,15 ← 0,15 → 0,15 mol
R2(CO3)n + 2nHCl 2RCln + 2nCO2 + nH2O
(0,25 - 0,15) mol
Vậy n = 2; R = 137 thỏa mãn.
Vậy R là Ba.
Câu 13:
Công thức thực nghiệm (hay công thức đơn giản là công thức hoá học có số nguyên tử các nguyên tố dạng số nguyên tối giản. Ba chất hữu cơ mạch hở A, B, D có cùng công thức thực nghiệm. Đốt cháy hoàn toàn 3,0 gam mỗi chất A, B, D đều thu được hỗn hợp sản phẩm chỉ chứa CO2 và H2O. Hấp thụ hoàn toàn sản phẩm cháy thu được bằng 750 ml dung dịch Ca(OH)2 0,1M thấy tạo thành 5,0 gam kết tủa trắng, đồng thời khối lượng dung dịch thu được sau khi tách lọc kết tủa tăng 1,2 gam so với dung dịch ban đầu.
1. Xác định công thức thực nghiệm của A, B, D.
 Xem đáp án
Xem đáp án
1.
;
(A, B, D) + O2 CO2 + H2O
Ca(OH)2 + CO2 CaCO3↓ + H2O (1)
Ca(OH)2 + 2CO2 Ca(HCO3)2 (2)
Xét 2 trường hợp xảy ra:
Trường hợp 1: Chỉ xảy ra phản ứng (1)
Ca(OH)2 + CO2 CaCO3↓ + H2O
0,05 ← 0,05 mol
A, B, D có công thức dạng: CnH2n+2Ox
(loại)
Trường hợp 2: Xảy ra phản ứng (1) và (2)
Ca(OH)2 + CO2 CaCO3↓ + H2O
Ca(OH)2 + 2CO2 Ca(HCO3)2
Theo bảo toàn nguyên tố Ca:
Theo bảo toàn nguyên tố C:
Công thức thực nghiệm của A, B, D: CH2O.
Câu 14:
Xác định công thức phân tử và gọi tên của A, B, D dựa theo các dữ kiện sau đây:
- Khối lượng phân tử: MA < MB < MD;
- A là hợp chất đơn chức, không làm quỳ tím hóa đỏ, tan trong nước tạo dung dịch được dùng để ngâm tiêu bản phục vụ nghiên cứu trong y học;
- B có chứa 1 nhóm chức giống axit axetic, đồng thời tác dụng với Na cho tỉ lệ . B là một chất có trong thành phần của sữa chua;
- D có nhiều trong các loại quả chín.
 Xem đáp án
Xem đáp án
- A là hợp chất đơn chức, không làm quỳ tím hóa đỏ, tan trong nước tạo dung dịch được dùng để ngâm tiêu bản phục vụ nghiên cứu trong y học A là andehit fomic CTPT của A: CH2O.
- B có chứa 1 nhóm chức giống axit axetic, đồng thời tác dụng với Na cho tỉ lệ . B là một chất có trong thành phần của sữa chua
B là CH3CH(OH)COOH (axit lactic)CTPT của B: C3H6O3.
- D có nhiều trong các loại quả chín nên D là glucozơ CT PT của D: C6H12O6.
Câu 15:
Một trong những ứng dụng của D là tráng gương. Cho 100 gam dung dịch chứa D với nồng độ 4,5% tác dụng hoàn toàn với Ag2O dư trong NH3 thu được m gam Ag. Tính m.
 Xem đáp án
Xem đáp án
C6H12O6 + Ag2O C6H12O7 + 2Ag↓
0,025 0,05 mol
mAg = 0,05.108 = 5,4 gam.
Câu 16:
Rót từ từ dung dịch HCl cho đến dư vào dung dịch hỗn hợp chứa a mol Na2CO3 và b mol NaHCO3. Từ kết quả số liệu thực nghiệm ta có 2 đồ thị theo hình vẽ sau:
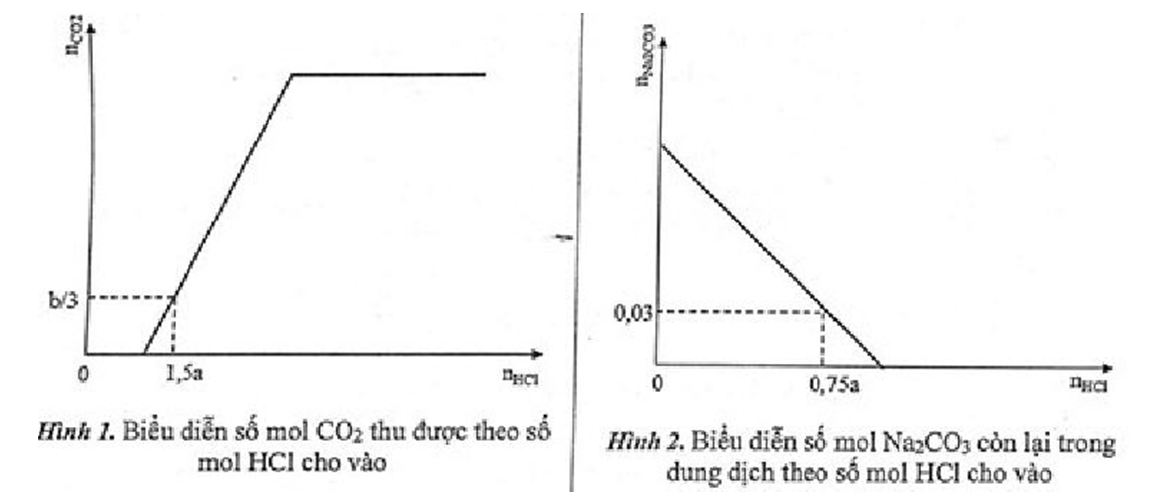
Xác định khối lượng chất tan trong dung dịch thu được khi lượng HCl rót vào dung dịch là 1,8a mol.
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
Đặt:
Các phương trình hóa học xảy ra:
Na2CO3 + HCl NaCl + NaHCO3
NaHCO3 + HCl NaCl + CO2↑ + H2O
+Theo hình 2: Khi
Na2CO3 + HCl NaHCO3 + NaCl
(a-0,03) 0,075a mol
⇒ a – 0,03 = 0,75 a ⇒ a = 0,12 mol
+ Theo hình 1: Khi
Na2CO3 + HCl NaCl + NaHCO3
0,12 → 0,12 → 0,12 → 0,12 mol
NaHCO3 + HCl NaCl + CO2 + H2O
(0,18 - 0,12) → 0,12 mol
Dung dịch gồm: Na2CO3 (0,12 mol); NaHCO3 (0,18 mol).
+ Khi nHCl = 1,8a = 0,216 mol
Na2CO3 + HCl NaCl + NaHCO3
0,12 → 0,12 → 0,12 → 0,12 mol
NaHCO3 + HCl NaCl + CO2 + H2O
0,096 ← 0,096 → 0,096
Tổng khối lượng chất tan: 17,136 + 12,636 = 29,772 gam.
Câu 17:
Nung hỗn hợp X gồm CH4, CH2=CH2; CH3-C ≡ CH; CH2=CH-C ≡ CH và a (mol) H2 có Ni xúc tác (để xảy ra phản ứng cộng H2 vào liên kết đôi, liên kết ba) thu được 0,2 mol hỗn hợp Y chỉ gồm các hidrocacbon và có tỉ khối so với H2 là 17,9. Biết 0,1 mol Y phản ứng tối đa với 0,06 mol Br2 trong dung dịch. Tìm giá trị của a.
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
Ta có: nX = nY = 0,2 mol
Sơ đồ phản ứng:
X
Vậy X cộng tối đa với (a + 0,12) mol H2.
Đặt công thức trung bình của X là:
Theo bảo toàn khối lượng:
Giải (I) + (II):
Câu 18:
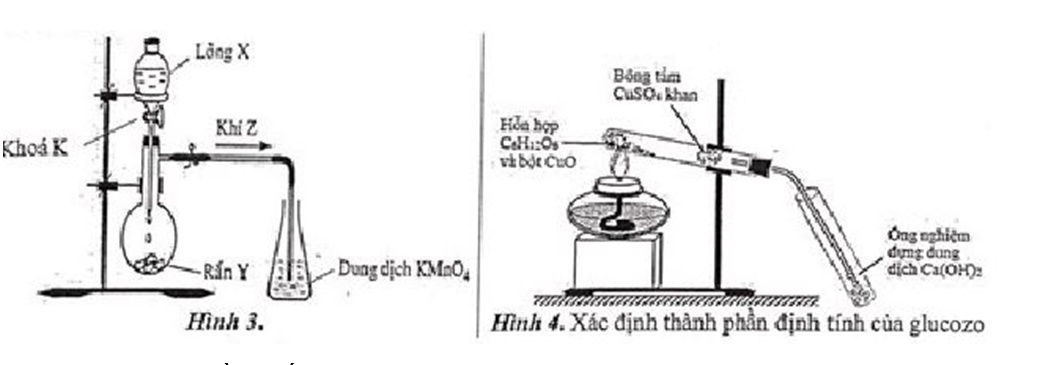
Thí nghiệm điều chế và chứng minh tính khử của khí Z được thực hiện như hình 3. Khi mở khoá K, chất lỏng X chảy xuống. Sau một thời gian, bình đựng dung dịch KMnO4 nhạt dần.
a. Xác định công thức phân tử của X, Y, Z phù hợp với sơ đồ; biết khí Z có khả năng làm mất màu cánh hoa hồng.
 Xem đáp án
Xem đáp án
a) Khí Z là SO2; X là H2SO4; chất rắn Y là Na2SO3.
Câu 19:
b. Viết phương trình hoá học cho phản ứng xảy ra trong thí nghiệm.
 Xem đáp án
Xem đáp án
b) Phương trình hóa học minh họa:
Na2SO3 + H2SO4 Na2SO4 + SO2↑ + H2O
5SO2 + 2KMnO4 + 2H2O K2SO4 + 2MnSO4 + 2H2SO4
Câu 20:
Nêu hiện tượng và viết phương trình hoá học cho phản ứng xảy ra khi tiến hành thí nghiệm theo hình 4.
 Xem đáp án
Xem đáp án
Hiện tượng: Bông tẩm CuSO4 khan chuyển dần sang màu xanh, dung dịch Ca(OH)2 vẫn đục.
C6H12O6 + 6O2 6CO2 + 6H2O
CuSO4 + 5H2O CuSO4.5H2O
Ca(OH)2 + CO2 CaCO3↓ + H2O
Câu 21:
Hàng năm, trên thế giới sản xuất hàng trăm triệu tấn axit sunfuric do các ứng dụng quan trọng của nó đối với nền kinh tế quốc dân.
Trong công nghiệp, axit sunfuric được sản xuất bằng phương pháp tiếp xúc. Nguyên liệu là lưu huỳnh (hoặc quặng pirit sắt), không khí và nước. Thông thường sản xuất axit sunfuric có 3 giai đoạn.
- Giai đoạn 1: Oxi hoá lưu huỳnh (hoặc quặng pirit sắt) bằng không khí giàu oxi;
- Giai đoạn 2: Oxi hoá sản phẩm chứa lưu huỳnh thu được ở giai đoạn 1 bằng xúc tác phù hợp;
- Giai đoạn 3: Hấp thụ sản phẩm chứa lưu huỳnh thu được giai đoạn 2 để tạo axit sunfuric.
Trên thực tế, hiệu suất của quá trình sản xuất axit sunfuric phụ thuộc nhiều vào giai đoạn 3 do hiệu suất của 2 giai đoạn đầu có thể đạt tới 100%. Nếu dùng nước để hấp thụ SO3 thì hiệu suất phản ứng có thể chỉ đạt dưới 5% do phản ứng toả nhiệt nên sản phẩm sinh ra tạo lớp sương mù, vừa khó thu hồi, vừa hạn chế sự tiếp xúc giữa các chất tham gia phản ứng. Thực tế trong sản xuất người ta dùng dung dịch H2SO4 đặc làm chất hấp thụ trong giai đoạn 3. Sản phẩm của phản ứng thu được là oleum có công thức dạng H2SO4.nSO3. Oleum dễ vận chuyển an toàn hơn axit sunfuric. Khi biết công thức của oleum có thể tính toán lượng nước cần hoà tan để thu được axit sunfuric tinh khiết.
1. Viết phương trình hoá học cho các phản ứng xảy ra trong quá trình sản xuất axit sunfuric thực tế.
 Xem đáp án
Xem đáp án
Phương trình hoá học cho các phản ứng xảy ra trong quá trình sản xuất axit sunfuric thực tế:
S + O2 SO2
(hoặc 4FeS2 + 11O2 2Fe2O3 + 8SO2)
2SO2 + O2 2SO3
H2SO4 + nSO3 → H2SO4.nSO3
Câu 22:
 Xem đáp án
Xem đáp án
Đặt công thức của oleum: H2SO4.nSO3.
nNaOH = 0,24.1 = 0,24 mol
H2SO4.nSO3 + nH2O → (n + 1)H2SO4 (1)
← 0,12 mol
2NaOH + H2SO4 ® Na2SO4 + 2H2O (2)
0,24 → 0,12 mol
Theo (1), (2):
Giải phương trình hóa học được n = 7.
Công thức hóa học của oleum: H2SO4.7H2O.
