Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 22)
-
9451 lượt thi
-
15 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Nêu hiện tượng và viết phương trình phản ứng trong các thí nghiệm sau:
- Sục từ từ đến dư khí CO2 vào dung dịch Ca(OH)2.
 Xem đáp án
Xem đáp án
- Sục từ từ đến dư khí CO2 vào dung dịch Ca(OH)2:
Hiện tượng: Dung dịch vẩn đục sau đó chuyển thành trong suốt.
Phương trình hóa học:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
CaCO3↓ + CO2 + H2O → Ca(HCO3)2
Câu 2:
- Cho mẩu Na vào dung dịch CuSO4.
 Xem đáp án
Xem đáp án
- Cho mẩu Na vào dung dịch CuSO4.
Hiện tượng: Mẩu Na tan dần, có bọt khí thoát ra và xuất hiện kết tủa màu xanh.
Phương trình hóa học:
2Na + 2H2O 2NaOH + H2↑
2NaOH + CuSO4 Na2SO4 + Cu(OH)2↓
Câu 3:
Một học sinh lắp dụng cụ thí nghiệm điều chế khí X tinh khiết trong phòng thí nghiệm (như hình bên dưới). Biết khí X có màu vàng lục, mùi hắc, nặng hơn không khí và rất độc.
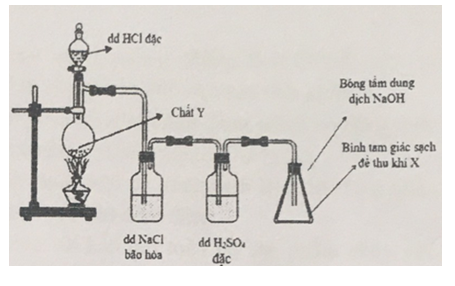
a. Xác định khí X, chất Y. Viết một phương trình hóa học điều chế khí X ở thí nghiệm trên.
 Xem đáp án
Xem đáp án
a. Chất X là khí Cl2, chất Y là những chất oxi hóa mạnh như: MnO2 hoặc KMnO4, KClO3, K2Cr2O7….
Một phương trình hóa học minh họa:
2KMnO4 + 16HCl 2MnCl2 + 2KCl + 5Cl2 + 8H2O
Câu 4:
b. Cho biết tác dụng của bình đựng dung dịch NaCl bão hòa, bình đựng dung dịch H2SO4 đặc và bông tẩm dung dịch NaOH.
 Xem đáp án
Xem đáp án
b. Tác dụng của bình đựng dung dịch NaCl bão hòa, bình đựng dung dịch H2SO4 đặc và bông tẩm dung dịch NaOH:
+ Dung dịch NaCl: hấp thụ khí HCl.
+ Dung dịch H2SO4 đặc: Hấp thụ hơi nước.
+ Bông tẩm dung dịch NaOH: Hấp thụ khí Cl2 khi đầy bình, tránh Cl2 thoát ra ngoài môi trường.
Câu 5:
c. Nếu đổi chỗ hai bình đựng dung dịch NaCl và H2SO4 đặc cho nhau có được không? Vì sao?
 Xem đáp án
Xem đáp án
c. Không thể đổi chỗ 2 bình đựng dung dịch NaCl và H2SO4 đặc vì nếu đổi chỗ hai bình sẽ không thu được khí Cl2 khô.
Câu 7:
Ba chất hữu cơ mạch hở có công thức phân tử là C3H6, C2H4O2, C2H6O đượckí hiệu ngẫu nhiên là A, B, C. Biết rằng:
- Khi đốt cháy A, B đều thu được số mol CO2 bằng số mol H2O.
- Chất B ít tan trong nước, làm mất màu dung dịch brôm.
- Chất C tác dụng được với Na.
- Chất A tác dụng được với NaOH và Na.
Hãy lập luận để xác định các chất A, B, C. Viết công thức cấu tạo thu gọn của chúng.
 Xem đáp án
Xem đáp án
Khi đốt chất A, B đều thu được số mol CO2 bằng số mol H2O nên chất A, B có số nguyên tử H gấp 2 lần nguyên tử C.
Chất A tác dụng được với Na, NaOH nên chất A là axit có công thức: CH3-COOH.
Chất B ít tan trong nước và làm mất màu dung dịch brom nên chất B là hiđrocacbon có liên kết đôi: CH3-CH=CH2
Chất C tác dụng với Na nên C là ancol: C2H5OH.
Câu 8:
Nung kim loại Cu trong không khí sau một thời gian thu được chất rắn A. Hòa tan A bằng H2SO4 đặc nóng vừa đủ thu được dung dịch B và khí C (khí C có khối lượng phân tử bằng 64). Khí C tác dụng với dung dịch KOH thu được dung dịch D. D vừa tác dụng với BaCl2 vừa tác dụng với NaOH. Xác định thành phần A, B, C, D và viết tất cả các phương trình phản ứng xảy ra.
 Xem đáp án
Xem đáp án
A gồm Cu, CuO; B là CuSO4; C là SO2; D gồm KHSO3 và K2SO3.
Các phương trình hóa học của phản ứng xảy ra:
Câu 9:
Cho m gam Na tan hoàn toàn trong 400 ml dung dịch HCl 2M. Kết thúc phản ứng thu được dung dịch X. Dung dịch X tác dụng vừa đủ với 200 ml dung dịch NaHCO3 1M. Tính giá trị của m.
 Xem đáp án
Xem đáp án
Các phản ứng hóa học có thể xảy ra như sau:
2Na + 2HCl → 2NaCl + H2 (↑) (1)
2Na + 2H2O → 2NaOH + H2(↑) (2)
Dung dịch sau phản ứng tác dụng với NaHCO3 nên:
+ Trường hợp 1: HCl dư, chỉ xảy ra phản ứng (1)
HCldư + NaHCO3 → 2NaCl + CO2↑ + H2O
0,2 ← 0,2 mol
Vậy nHCl dư = 0,2 mol;
Theo (1) có nNa = nHCl pư = 0,8 – 0,2 = 0,6 mol
Vậy m = mNa = 0,6.23 = 13,8 gam.
+ Trường hợp 2: HCl hết, dung dịch X chứa NaOH, xảy ra cả hai phản ứng (1) và (2).
NaOH + NaHCO3 → Na2CO3 + H2O
0,2 ← 0,2 mol
Vậy nNa = 0,8 + 0,2 = 1 mol → m = mNa = 1.23 = 23 gam.
Câu 10:
Trộn V1 dung dịch HCl 0,6M với V2 lít dung dịch NaOH 0,4M thu được 0,6 lít dung dịch A. Dung dịch A tác dụng vừa đủ với 1,02 gam Al2O3. Tính giá trị V1, V2.
 Xem đáp án
Xem đáp án
V1 + V2 = 0,6
HCl + NaOH → NaCl + H2O
Dung dịch sau phản ứng hòa tan Al2O3 nên:
+ Trường hợp 1: HCl dư
+ Trường hợp 2: NaOH dư
Câu 11:
Chia 24,0 gam hỗn hợp X gồm Fe và kim loại M có hóa trị II thành ba phần bằng nhau:
- Phần 1: Hòa tan hoàn toàn trong dung dịch HCl loãng, dư thu dược 4,48 lít khí.
- Phần 2: Cho tác dụng vừa đủ với 5,6 lít khí Cl2.
a. Xác định M.
 Xem đáp án
Xem đáp án
a) Gọi số mol Fe và M trong mỗi phần lần lượt là x và y mol.
Phần 1:
Giả sử M không phản ứng với HCl:
Fe + 2HCl → FeCl2 + H2 (↑)
Vậy M có phản ứng với HCl.
Phần 2:
Giải hệ phương trình được x = y = 0,1.
Vậy mhh = 0,1.56 + 0,1.M = 8 → M = 24.
Vậy kim loại M là Magie.
Câu 12:
b. Lấy phần 3 hòa tan hoàn toàn trong dung dịch H2SO4 đặc nóng, sau khi kết thúc thu được dung dịch Y và 4,928 lít khí SO2 (sản phẩm khử duy nhất). Hỏi khi cô cạn dung dịch Y thu được bao nhiêu gam chất rắn. Biết thể tích các khí đo ở đktc.
 Xem đáp án
Xem đáp án
b) Phần 3:
Ta có các phương trình hóa học:
Muối thu được gồm:
Vậy mmuối = 29,12 gam.
Câu 13:
Cồn 75o được khuyến cáo sử dụng để sát trùng, phòng chống dịch Covid-19 lây lan. Em hãy trình bày cách pha chế 1,0 lít cồn 75o từ lượng cồn 96o và nước tinh khiết.
 Xem đáp án
Xem đáp án
- Chuẩn bị bình định mức loại 1000 ml
- Dùng ống đong lấy 781,25 ml cồn 96o
- Thêm từ từ nước cất rồi khuấy đều cho đủ 1000ml dung dịch. Ta được 1,0 lít cồn 75o.
Câu 14:
Hỗn hợp X gồm 2 hiđrocacbon mạch hở A và B. Trong đó A là đồng đẳng của etilen có công thức tổng quát là CnH2n và B là đồng đẳng của axetilen có công thức tổng quát là CmH2m-2.
a. Để phản ứng với 6,72 lít hỗn hợp X thì cần tối đa 400 ml dung dịch Br2 1M. Tính phần trăm theo thể tích của mỗi chất trong hỗn hợp X, biết các khí đo ở đktc.
 Xem đáp án
Xem đáp án
Gọi số mol của A và B lần lượt là x và y mol.
Theo bài ra ta có hệ phương trình:
Câu 15:
b. Đốt cháy hoàn toàn m gam hỗn hợp X trên rồi hấp thụ toàn bộ sản phẩm cháy vào bình đựng dung dịch Ca(OH)2 thu được 40,0 gam kết tủa và khối lượng bình tăng 35,4 gam so với ban đầu. Lọc bỏ kết tủa rồi thêm lượng dư dung dịch Ba(OH)2 vào bình, sau phản ứng thu thêm 29,7 gam kết tủa.
Xác định công thức cấu tạo của 2 hiđrocacbon A, B trong hỗn hợp X và giá trị của m. Xem đáp án
Xem đáp án
b)
Ta có các phương trình hóa học xảy ra:
Vậy 2 hợp chất cần tìm là C2H4 và C2H2.
