Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 27)
-
9459 lượt thi
-
21 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Cho 6 dung dịch đựng riêng biệt trong các lọ mất nhãn: Ba(OH)2, BaCl2, NaNO3, HCl, H2SO4, NH4HSO4 được đặt kí hiệu ngẫu nhiên A, B, C, D, E, F. Kết quả thí nghiệm của các dung dịch như sau:
|
Mẫu thử |
Thuốc thử |
Hiện tượng |
|
A |
- Quỳ tím - Mẫu thử C hoặc mẫu thử D |
- Quỳ tím hóa đỏ - Đều tạo kết tủa trắng |
|
B |
- Quỳ tím |
- Quỳ tím không đổi màu |
|
C |
- Quỳ tím - Mẫu thử A - Mẫu thử F |
- Quỳ tím hóa xanh - Tạo kết tủa trắng - Tạo kết tủa trắng và khí có mùi khai |
|
D |
- Quỳ tím - Mẫu thử A hoặc mẫu thử F |
- Quỳ tím không đổi màu - Đều tạo kết tủa trắng |
|
E |
- Quỳ tím |
- Quỳ tím hóa đỏ |
|
F |
- Quỳ tím - Mẫu thử C - Mẫu thử D |
- Quỳ tím hóa đỏ - Tạo kết tủa trắng và khí có mùi khai - Tạo kết tủa trắng |
Hãy xác định các dung dịch A, B, C, D, E, F (Không cần giải thích)
 Xem đáp án
Xem đáp án
Ta có các chất được xác định như bảng sau:
|
A |
B |
C |
D |
E |
F |
|
H2SO4 |
NaNO3 |
Ba(OH)2 |
BaCl2 |
HCl |
NH4HSO4 |
Câu 2:
Chất rắn màu trắng A tan được trong nước tạo thành dung dịch màu xanh lam. Cho dung dịch NaOH vào dung dịch chất A thì tạo ra kết tủa B màu xanh lơ. Khi nung nóng chất B thì thu được chất X màu đen. Nếu sau đó tiếp tục nung nóng chất X và có dòng khí H2 đi qua thì tạo ra chất rắn C màu đỏ. Chất rắn C tác dụng với axit vô cơ đậm đặc D tạo ra dung dịch của chất A ban đầu và khí E. Sục khí E đến dư vào dung dịch nước brom thu được dung dịch F không màu. Dung dịch F làm quỳ tím hóa đỏ và tạo kết tủa G với dung dịch BaCl2. Xác định các chất A, B, C, D, E, G, X và viết các phương trình hóa học xảy ra.
 Xem đáp án
Xem đáp án
Các phương trình hóa học xảy ra:
CuSO4 (A) + NaOH → Cu(OH)2¯(B) + Na2SO4
Cu(OH)2 CuO (X) + H2O
CuO + H2 Cu (C) + H2O
Cu + 2H2SO4 (D) CuSO4 + SO2 (E) + 2H2O
SO2 + Br2 + H2O → H2SO4 + 2HBr
BaCl2 + H2SO4 → BaSO4 ¯ (G) + 2HCl
Câu 3:
Cho sơ đồ chuỗi phản ứng sau:
X + 2KHSO4 A¯ + B + 2C + 2D
BaCl2 + KHSO4 A¯ + E + HCl
X + 2KOH G¯ + H + 2D
H + 2HCl 2E + C + D
Xác định các chất X, A, B, C, D, E, G, H. Viết phương trình hóa học các phản ứng theo sơ đồ trên. Biết rằng mỗi chữ cái là một chất vô cơ khác nhau và khí C không làm mất màu dung dịch brom.
 Xem đáp án
Xem đáp án
Xác định được các chất thể hiện trong bảng sau:
|
X |
A |
B |
C |
D |
E |
G |
H |
|
Ba(HCO3)2 |
BaSO4¯ |
K2SO4 |
CO2 |
H2O |
KCl |
BaCO3¯ |
K2CO3 |
Các phương trình hóa học trong sơ đồ:
Ba(HCO3)2 + 2KHSO4 BaSO4¯ + K2SO4 + 2CO2 + 2H2O
BaCl2 + KHSO4 BaSO4¯ + KCl + HCl
Ba(HCO3)2 + 2KOH BaCO3¯ + K2CO3 + 2H2O
K2CO3 + 2HCl 2KCl + CO2 + H2O
Câu 4:
Nêu hiện tượng và viết phương trình hóa học các phản ứng xảy ra trong các thí nghiệm sau:
a) Cho dung dịch H2SO4 đậm đặc vào cốc thủy tinh chứa 2,0 gam tinh bột gạo.
 Xem đáp án
Xem đáp án
a) Cho dung dịch H2SO4 đậm đặc vào cốc thủy tinh chứa 2,0 gam tinh bột gạo.
Hiện tượng: Cốc thủy tinh chứa bột gạo chuyển sang màu đen và khối chất rắn màu đen dâng lên khỏi miệng cốc thủy tinh.
Phương trình hóa học minh họa:
(C6H10O5)n 6nC + 5nH2O
C + 2H2SO4 CO2 + 2SO2 + 2H2O
Câu 5:
b) Cho 2 mL dầu ăn vào ống nghiệm chứa dung dịch NaOH (dư), đun nóng một thời gian
 Xem đáp án
Xem đáp án
b) Cho 2 mL dầu ăn vào ống nghiệm chứa dung dịch NaOH (dư), đun nóng một thời gian:
Hiện tượng: Thấy 1 lớp chất rắn màu trắng nhẹ nổi lên trên, đó là muối Na của axit béo (xà phòng)
Phương trình hóa học minh họa:
Câu 6:
c) Cắt ngang thân một cây mía và để lâu bề mặt cắt ngang ấy trong không khí.
 Xem đáp án
Xem đáp án
c) Cắt ngang thân một cây mía và để lâu bề mặt cắt ngang ấy trong không khí.
Hiện tượng: Khi để ngọn mía lâu ngày trong không khí, ở đầu đoạn mía thường có mùi rượu vì đoạn đầu cây mía tiếp xúc trực tiếp với không khí, trong không khí có thể có một số vi khuẩn giúp phân hủy dần saccarozơ thành glucozơ, sau đó lên men glucozơ thành rượu etylic.
Phương trình hóa học minh họa:
C12H22O11 + H2O C6H12O6 (glucozơ) + C6H12O6 (frutozơ)
C6H12O6 2C2H5OH + 2CO2
Câu 7:
d) Cho nước ép quả nho chín vào ống nghiệm chứa lượng dư dung dịch AgNO3 trong NH3 và đun nóng nhẹ
 Xem đáp án
Xem đáp án
d) Cho nước ép quả nho chín vào ống nghiệm chứa lượng dư dung dịch AgNO3 trong NH3 và đun nóng nhẹ
Hiện tượng: Có kết tủa sáng trắng bám lên thành ống nghiệm.
C6H12O6 + Ag2O C6H12O7 + 2Ag↓
(Hoặc:
C5H11O5 – CHO + 2AgNO3 + 3NH3 + H2O → C5H11O5 – COONH4 + 2Ag↓ + 2NH4NO3)
Câu 8:
a) Để đánh giá một phản ứng diễn ra nhanh hay chậm người ta dùng khái niệm tốc độ phản ứng. Tốc độ trung bình của phản ứng (VTB) thường được xác định bằng độ biến thiên nồng độ (mol/L) của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian (giây)
Xét phản ứng hóa học: Br2 + HCOOH 2HBr + CO2. Nồng độ ban đầu của Br2 0,012 mol/L, sau 50 giây nồng độ Br2 còn lại là 0,01 mol/L. Tính tốc độ trung bình của phản ứng trên (theo Br2) trong thời gian 50 giây.
 Xem đáp án
Xem đáp án
a) Tốc độ trung bình của phản ứng trên (theo Br2) trong thời gian 50 giây:
Câu 9:
b) Kết quả thực nghiệm cho thấy rằng cứ tăng thêm 10°C thì tốc độ phản ứng sẽ tăng lên g lần, g có giá trị từ 2 đến 4. Ví dụ: trong một phản ứng hoá học, mỗi khi tăng nhiệt độ lên 10oC thì tốc độ phản ứng tăng 3 lần nên khi tăng nhiệt độ từ 30°C lên 60°C thì tốc độ phản ứng tăng 27 lần
Hỏi tốc độ của một phản ứng hóa học tăng lên bao nhiêu lần nếu tăng nhiệt độ từ 20oC lên 170oC? Biết rằng khi tăng nhiệt độ lên 25°C thì tốc độ phản ứng tăng 3 lần.
 Xem đáp án
Xem đáp án
b) Áp dụng quy tắc Van’t Hoff:
- Tốc độ phản ứng tăng lên 3 lần nên
(1)
- Tăng nhiệt độ thêm 25oC thì T2 – T1 = 25oC , thay vào (1)
- Khi phản ứng tăng từ 20oC lên 170oC thì:
Tốc độ phản ứng tăng lên 730 lần.
Câu 10:
Hình vẽ bên mô tả thí nghiệm điều chế khí Z từ hỗn hợp rắn gồm CaC2, Al4C3 và CaCO3.
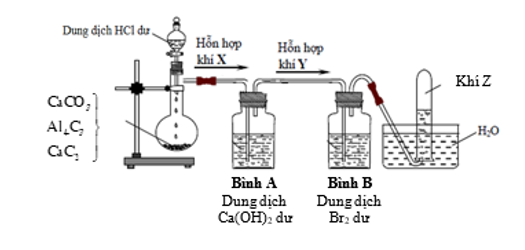
a) Xác định thành phần hỗn hợp khí X và viết phương trình hóa học tạo ra các chất trong X.
 Xem đáp án
Xem đáp án
a) Hỗn hợp khí X gồm: CH ≡ CH; CH4; CO2;
Các phương trình hóa học minh họa:
CaC2 + 2HCl → CaCl2 + CH ≡ CH
Al4C3 + 12HCl → 4AlCl3 + 3CH4
CaCO3 + 2HCl ® CaCl2 + CO2 + H2O
Câu 11:
b) Xác định thành phần hỗn hợp khí Y và nêu hiện tượng quan sát được trong bình B sau khi kết thúc thí nghiệm. Viết phương trình hóa học xảy ra
 Xem đáp án
Xem đáp án
b) Hỗn hợp khí Y gồm: CH ≡ CH; CH4
Ca(OH)2 dư + CO2 CaCO3¯ + H2O
C2H2 + 2Br2 dư C2H2Br4
Hiện tượng: dung dịch brom bị nhạt màu
Câu 13:
Nhiệt phân 1,68 lít CH4 (ở đktc) trong bình kín, sau một thời gian chỉ thu được hỗn hợp khí A gồm C2H2, H2, CH4 dư; tỉ khối hơi của A so với hiđro bằng 4,8. Tính hiệu suất phản ứng nhiệt phân CH4
 Xem đáp án
Xem đáp án
2CH4 C2H2 + 3H2
Ban đầu: 0,075 mol
Phản ứng: a 0,5a 1,5a mol
Dư: 0,075 – a 0,5a 1,5a mol
Bảo toàn khối lượng:
Câu 14:
Lên men giấm V mL rượu etylic 46o thu được dung dịch A. Chia A thành hai phần bằng nhau
- Phần 1: Cho tác đựng với Na dư thu được 49,28 lít H2 (ở đktc).
- Phần 2: Cho tác dụng với NaHCO3 dư thu được 13,44 lít CO2 (ở đktc)
Biết: khối lượng riêng của rượu etylic nguyên chất là 0,8 g/mL, khối lượng riêng của nước là 1,0 g/mL.
a) Viết phương trình hóa học các phản ứng xảy ra và tính giá trị V.
 Xem đáp án
Xem đáp án
a)
Gọi c là số mol H2O trong dd rượu.
C2H5OH + O2 CH3COOH + H2O
a a a mol
2C2H5OH + 2Na → 2C2H5ONa + H2
b 0,5b mol
2Na + 2H2O → 2NaOH + H2
a + c 0,5(a + c) mol
2CH3COOH + 2Na → 2CH3COONa + H2
a 0,5a mol
CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O
a a mol
Ta có hệ phương trình:
Vdd = V =
Câu 16:
Đun nóng m gam một chất béo X (không lẫn axit béo tự do) với dung dịch KOH vừa đủ cho đến khi phản ứng xảy ra hoàn toàn, thu được 0,92 gam glixerol, hỗn hợp Y gồm a gam muối của axit oleic (C17H33COOH) và 3,18 gam muối của axit linoleic (C17H31COOH).
a) Tính giá trị a.
 Xem đáp án
Xem đáp án
a) Phương trình hóa học:
(C17H33COO)xC3H5(OOC17H31)3-x + 3KOH → xC17H33COOK + (3-x)C17H31COOK + C3H5(OH)3
Theo phương trình hóa học có:
Câu 17:
b) Xác định các công thức cấu tạo của chất béo X.
 Xem đáp án
Xem đáp án
b) Các công thức cấu tạo của chất béo X
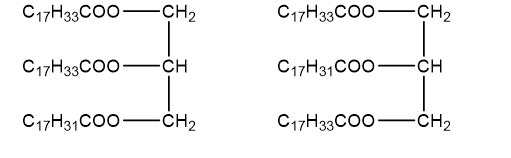
Câu 18:
Cho 336,3 mL dung dịch KOH 12% (D = 1,11 g/mL) vào 200 mL dung dịch H3PO4 1M, sau khi phản ứng xảy ra xong thu được dung dịch A. Cô cạn dung dịch A thì khối lượng chất rắn khan thu được là bao nhiêu gam?
 Xem đáp án
Xem đáp án
Ta có: Þ KOH dư
Phương trình hóa học:
H3PO4 + 3KOH → K3PO4 + 3H2O
Ban đầu: 0,2 0,8 mol
Phản ứng: 0,2 0,6 0,2 mol
Dư: 0 0,2 0,2 mol
Câu 19:
Cho 4,8 gam hỗn hợp bột gồm CaCO3 và CaO vào cốc thủy tinh chứa H2O (thật dư) và khuấy kỹ, để yên một thời gian, sau đó sục từ từ khí CO2 đến dư vào cốc thủy tinh. Đồ thị biểu diễn sự phụ thuộc khối lượng kết tủa CaCO3 (gam) theo thể tích khí CO2 (lít, đktc) được mô tả như hình bên. Giả thiết các quá trình xảy ra hoàn toàn. Tính giá trị a và b trên đồ thị.
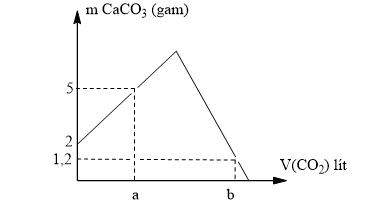
 Xem đáp án
Xem đáp án
CaO + H2O → Ca(OH)2 (1)
0,05 0,05 mol
+ Tại lít CO2 hết, Ca(OH)2 dư
Ca(OH)2 + CO2 → CaCO3¯ + H2O (*)
+ Tại lít CO2 hết, CaCO3 tan một phần
Ca(OH)2 + CO2 → CaCO3¯ + H2O (2)
0,05 0,05 0,05 + 0,02 mol
CaCO3 + CO2 + H2O Ca(HCO3)2 (3)
y y y mol
Câu 20:
Cho từ từ dung dịch HCl vào bình A chứa 7,9 gam hỗn hợp bột X gồm bột Al, Fe, Cu và khuấy đều, sau khi kết thúc các phản ứng thu được dung dịch Y (chỉ chứa muối) và còn lại chất rắn Z. Lượng khí thoát ra được dẫn qua ống sứ chứa CuO dư, nung nóng, thấy khối lượng của ống sứ giảm 3,52 gam. Thêm tiếp dung dịch AgNO3 đến dư vào bình A thu được 75,02 gam hỗn hợp kết tủa.
a) Tính % khối lượng mỗi kim loại trong hỗn hợp X.
 Xem đáp án
Xem đáp án
a)
2Al + 6HCl → 2AlCl3 + 3H2 (1)
a 3a a 1,5a mol
Fe + 2HCl → FeCl2 + H2 (2)
b 2b b b mol
Cu + HCl → không phản ứng
c mol
⇒ 27a + 56b + 64c = 7,9 (*)
Dung dịch Y chứa: AlCl3: a mol; FeCl2: b mol; H2: (1,5a + b) mol
H2(k) + CuO(r) → Cu(r) + H2O(k)
1,5a + b 1,5a + b 1,5a + b mol
mrắn giảm = mO trong oxit đã phản ứng = 3,52
® (**)
3AgNO3 + AlCl3 → 3AgCl¯ + Al(NO3)3 (3)
a ® 3a mol
3AgNO3 + FeCl2 → 2AgCl¯ + Ag¯ + Fe(NO3)3 (4)
b ® 2b b mol
2AgNO3 + Cu → 2Ag¯ + Cu(NO3)2 (5
c ® 2c mol
mkết tủa = mAgCl + mAg = 143,5.(3a + 2b) + 108.(b + 2c) = 75,02
nên 430,5a + 395b + 216c = 75,02 (***)
Giải hệ:
Câu 21:
b) Nếu nung bình A chứa 7,9 gam hỗn hợp X trong O2 (dư) đến khối lượng không đổi, thu được hỗn hợp T. Tính thể tích dung dịch HCl 0,5M tối thiểu để hòa tan hết T.
 Xem đáp án
Xem đáp án
b)
Gọi n là số oxi hóa trung bình của 3 kim loại trong oxit, x là số mol của 3 kim loại
2M + nO2 → M2On (6)
x 0,5nx 0,5x mol
M2On + 2nHCl → 2MCln+ nH2O (7)
0,5x nx x mol
Từ (6) và (7) ta có:
