Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 16)
-
9402 lượt thi
-
16 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Viết các phương trình hóa học xảy ra khi tiến hành các thí nghiệm sau:
a) Hòa tan Fe3O4 lần lượt vào dung dịch H2SO4 loãng, dung dịch H2SO4 đặc nóng.
 Xem đáp án
Xem đáp án
a) Fe3O4 + 4H2SO4 (loãng) → FeSO4 + Fe2(SO4)3 + 4H2O
2Fe3O4 +10 H2SO4 (đặc) t0→3Fe2(SO4)3 + SO2 ↑ + 10H2O
Câu 2:
b) Nhỏ từ từ dung dịch NaOH tới dư lần lượt vào dung dịch Ca(HCO3)2, dung dịch AlCl3.
 Xem đáp án
Xem đáp án
b) 2NaOH (dư) + Ca(HCO3)2 → Na2CO3 + CaCO3 ↓ + 2H2O
4NaOH (dư) + AlCl3 → NaAlO2 + 3NaCl + 2H2O
Câu 3:
c) Nhỏ dung dịch AgNO3 lần lượt vào dung dịch FeCl3, dung dịch Fe(NO3)2.
 Xem đáp án
Xem đáp án
c) 3AgNO3 + FeCl3 → 3AgCl↓ + Fe(NO3)3
AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓
Câu 4:
d) Cho ít bột Cu lần lượt vào dung dịch AgNO3, dung dịch Fe2(SO4)3.
 Xem đáp án
Xem đáp án
d) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
Câu 5:
Chọn hai kim loại M, R phù hợp với hai sơ đồ chuyển hóa sau và viết các phương trình hóa học tương ứng.
M2O3(1)→NaMO2(2)→M(3)→M2O3(4)→M.R2O(5)→ROH(6)→R2CO3(7)→RCl(8)→R.
M là Al; R là Na
 Xem đáp án
Xem đáp án
(1) Al2O3 + 2NaOH → 2NaAlO2 + H2O
(2) NaAlO2 + HCl + H2O → NaCl + Al(OH)3↓
(3) 2Al(OH)3 t0→Al2O3 + 3H2O
(4) 2Al2O3 dpnc→4Al + 3O2
(5) Na2O + H2O → 2NaOH
(6) NaOH + NaHCO3 → Na2CO3 + H2O
(7) Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
(8) 2NaCl dpnc→2Na + Cl2
Câu 6:
Hình bên dưới đây là đồ thị biểu diễn độ tan (S) trong nước của chất rắn X.
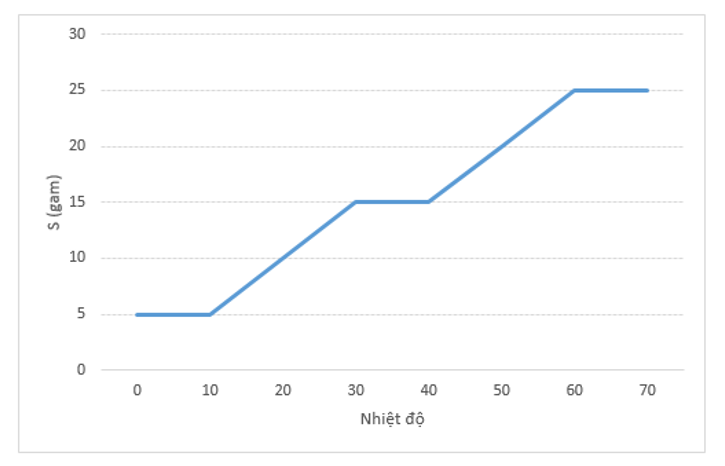
a) Hãy cho biết trong khoảng nhiệt độ s (gam) từ 0°C đến 70°C, có những khoảng nhiệt độ nào thu được dung dịch bão hòa của X?
 Xem đáp án
Xem đáp án
a) Những khoảng nhiệt độ thu được dung dịch bão hòa là:
từ 0oC đến 10oC; 30oC đến 40oC; 60oC đến 70oC
Câu 7:
b) Nếu 150 gam dung dịch bão hòa X đang nhiệt độ 70°C hạ nhiệt độ xuống còn 30°C. Hỏi có bao nhiêu gam X khan tách ra khỏi dung dịch?
 Xem đáp án
Xem đáp án
b) Tại 70oC
SX = 25 gam, mdd = 150 g
⇒ C%X = 2525+100.100%=20%
⇒ mX = 20%.150100%=30g
Tại 30oC
SX = 15 gam ⇒ C%X = 1515+100.100%≈13,04%
Gọi x là độ kết tinh của X
Khi đó: mddX = 150 – x (g); mX = 30 – x (g)
Ta có: 30−x150−x.100%=13,04% ⇒ x = 12 g
Vậy có 12 gam X khan tách ra khỏi dung dịch
Câu 8:
Dung dịch A chứa hai chất tan trong số các chất sau: BaCl2, NH4Cl, (NH4)2CO3, Ba(HCO3)2. Khi nhỏ dung dịch KOH dư vào dung dịch A thấy có khí thoát ra và xuất hiện kết tủa trắng.
a) Xác định hai chất tan trong dịch A.
 Xem đáp án
Xem đáp án
a) Cho KOH dư vào dung dịch A thấy có khí thoát ra chứng tỏ có NH4Cl hoặc (NH4)2CO3
Cho KOH dư vào dung dịch A thấy xuất hiện kết tủa trắng chứng tỏ có Ba(HCO3)2
Dung dịch chứa đồng thời (NH4)2CO3 và Ba(HCO3)2 không tồn tại.
Vậy A chứa NH4Cl và Ba(HCO3)2
Câu 9:
b) Đem dung dịch A tiến hành các thí nghiệm sau:
- Thí nghiệm 1: Cho NaOH dư vào V lít dung dịch A thu được a mol khí, m1 gam kết tủa.
- Thí nghiệm 2: Cho Ba(OH)2 dư vào V lít dung dịch A thu được a mol khí, 2m1 gam kết tủa.
- Thí nghiệm 3: Cho H2SO4 dư vào V lít dung dịch A thu được a mol khí, m2 gam kết tủa.
Viết phương trình hóa học cho các phản ứng xảy ra trong 3 thí nghiệm trên và tính phần trăm khối lượng mối muối trong dung dịch A.
 Xem đáp án
Xem đáp án
b) TN1:
2NaOH + (NH4)2CO3→ Na2CO3+ 2NH3+ 2H2O a2 ← a
2NaOH + Ba(HCO3)2→ BaCO3 + Na2CO3+ 2H2O m1197 ← m1197
TN2:
Ba(OH)2 + 2NH4Cl→ BaCl2+ 2NH3+ 2H2O a ← a
Ba(OH)2+ Ba(HCO3)2→ 2BaCO3 + 2H2O m1197 → 2.m1197
TN3:
H2SO4+ Ba(HCO3)2→ BaSO4↓ + 2CO2↑ + 2H2O a2 ← a2 ← a
Từ TN1 và TN3 ta nhận thấy
nBa(HCO3)2=a2=nNH4Cl
Kiểm tra m2 = 116,5a; m1 = 98,5a (thỏa mãn)
Phần trăm khối lượng của Ba(HCO3)2 là:
%mBa(HCO3)2=259259+53,5.100=82,88%
%mNH4Cl=100−82,88=17,12%
Câu 10:
Đốt cháy cháy hoàn toàn 6,25 gam một mẫu cacbon (có chứa tạp chất trơ với khối lượng chiếm không quá 10%) bằng oxi vừa đủ, thu được hỗn hợp khí X chứa CO2 và CO. Tỉ khối của X so với H2 là 19,6. Cho khí X hấp thụ vào 250 ml dung dịch Ba(OH)2 1M, sau khi phản ứng hoàn toàn thu được 29,55 gam kết tủa Tính phần trăm khối lượng của tạp chất trơ trong mẫu than trên.
 Xem đáp án
Xem đáp án
Hướng dẫn giải
nBaCO3=29,55197=0,15A (mol), nBa(OH)2= 0,25 (mol)
Khí X hấp thụ vào Ba(OH)2 thì chỉ có CO2 phản ứng ta có:
Bảo toàn nguyên tố (Ba) nBa(HCO3)2= 0,25 – 0,15 = 0,1 (mol)
Bảo toàn nguyên tố (C) nCO2=nC(BaCO3)+nC(Ba(HCO3)2= 0,15 + 2.0,1 = 0,35 (mol)
Đặt nCO = x (mol)
Do dX/H2= 19,6 ⇒ 28x + 44.0,35 = 19,6.2.(x + 0,35)
⇒ x = 0,15 (mol)
Bảo toàn nguyên tố (C) nC bđ = nC(CO) + nC(CO2) = 0,15 + 0,35 = 0,5 (mol)
⇒ mC = 0,5.12 = 6 (g) ⇒ mtạp chất = 6,25 – 6 = 0,25 g
⇒ %mtạp chất = 0,25.100%6,25=4%
Câu 11:
Dung dịch X gồm 0,02 mol Cu(NO3)2 và 0,1 mol HgSO4. Tính khối lượng Fe tối đa phản ứng được với dung dịch X. Cho biết sản phẩm khử duy nhất của NO−3 là NO.
 Xem đáp án
Xem đáp án
Hướng dẫn giải
nCu2+= 0,02 (mol); nNO3−= 0,04 (mol); nH+= 0,2 (mol)
3Fe + 8H+ + 2NO3−→ 3Fe2++ 2NO + 4H2O0,06←0,16←0,04
Fe + Cu2+→ Fe2++ Cu0,02←0,02
Fe + 2H+→ Fe2++ H20,02←0,04
⇒ nFe = 0,1 (mol) ⇒ mFe max = 5,6 g
Câu 12:
 Xem đáp án
Xem đáp án
Hướng dẫn giải
Các phương trình hóa học theo sơ đồ phản ứng:
(C6H10O5)n + nH2O H2SO4,t0→nC6H12O6
C6H12O6 enzim→2C2H5OH + 2CO2
C2H5OH + O2 xt→CH3COOH + H2O
CH3COOH + C3H7OH CH3COOC3H7 + H2O
CH3CH2CH2OH CH3CH=CH2 + H2O
CH3CH=CH2 + HBr → CH3CHBr-CH3
CH3CHBr-CH3 + NaOH CH3CH(OH)CH3 + NaBr
CH3CH(OH)CH3 + CH3COOH CH3CH(OCOCH3)CH3 + H2O
Câu 13:
Ba chất hữu cơ A, B, C đều chứa C, H, O và có cùng khối lượng mol phân tử là 60 g/mol. Cả 3 chất A, B, C đều phản ứng được với kim loại Na. Ngoài ra, B còn tác dụng được với dung dịch NaOH và C có phản ứng tráng gương. Xác định công thức phân tử và công thức cấu tạo của A, B, C.
 Xem đáp án
Xem đáp án
A, B, C đều tác dụng với Na; B tác dụng với NaOH, C có phản ứng tráng gương nên:
A là hợp chất của ancol
B là hợp chất của axit cacboxylic
C là hợp chất vừa chứa nhóm chức ancol vừa chứa nhóm chức anđehit
Với M = 60 g /mol ta có:
CTPT của A là: C3H8O; CTCT của A là: 1. CH3CH2CH2OH; 2. CH3CH(OH)CH3
CTPT của B là: C2H4O2; CTCT của B là: CH3COOH
CTPT của C là: C2H4O2; CTCT của C là: HOCH2CHO
Câu 14:
Hiđrocacbon X là đồng đẳng của benzen, có công thức đơn giản nhất là C4H5. Xác định công thức phân tử, viết công thức cấu tạo các đồng phân của X. Trong số các công thức cấu tạo của của X, chất nào khi tác dụng với Br2 đun nóng, có xúc tác bột Fe hoặc không có xúc tác này đều tạo ra một sản phẩm thế monobrom duy nhất? Viết phương trình phản ứng minh họa.
 Xem đáp án
Xem đáp án
CTTQ của X là: (C4H5)n
Do X thuộc đồng đằng của benzen nên CTTQ khác của X là: CmH2m-6 (m ≥ 6)
⇒ 4n = m và 5n = 2m – 6
⇒ ⇒ m = 8
Vậy CTPT của X là: C8H10
CTCT của X gồm 7 đồng phân
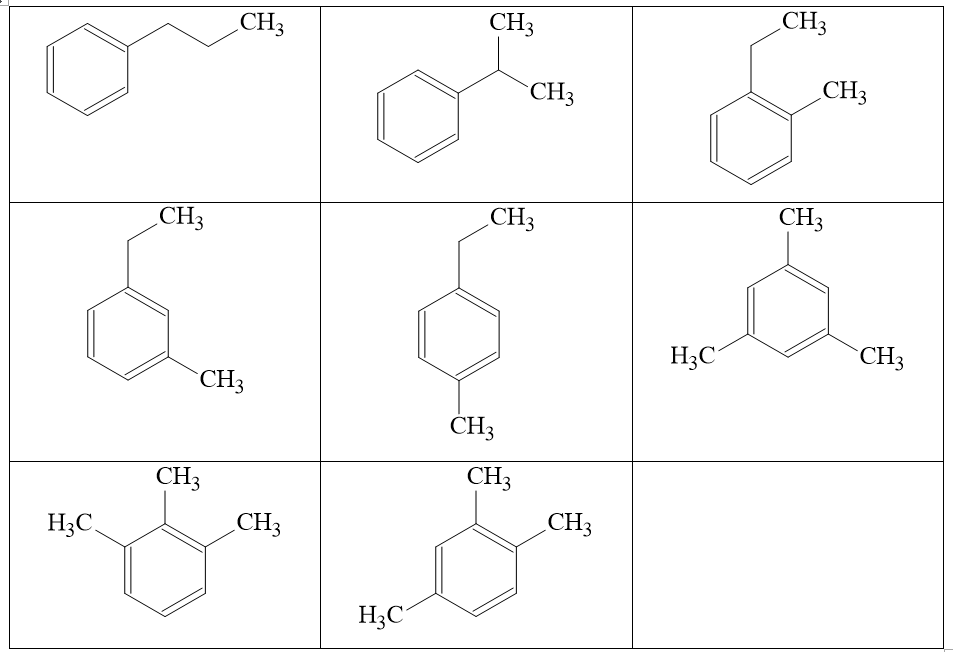
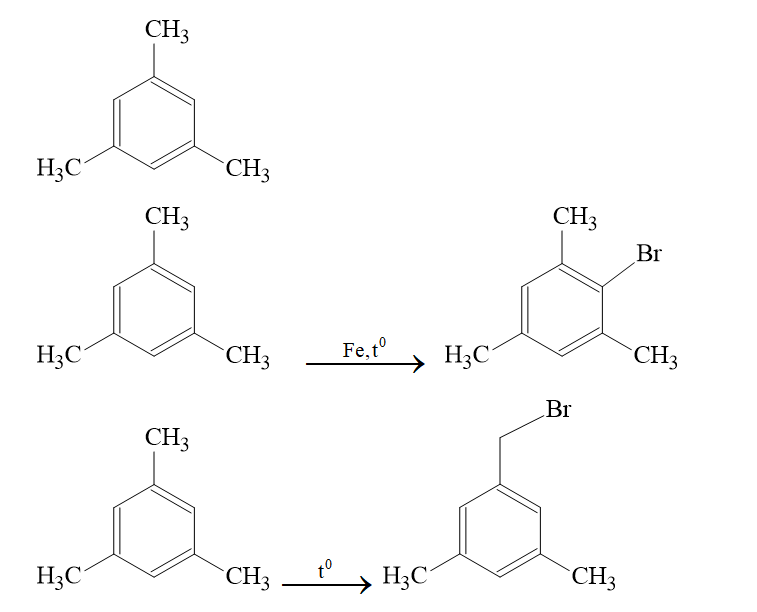
Trong số các công thức cấu tạo của của X, chất nào khi tác dụng với Br2 đun nóng, có xúc tác bột Fe hoặc không có xúc tác này đều tạo ra một sản phẩm thế monobrom duy nhất.
Cấu tạo phù hợp là
Câu 15:
Hỗn hợp X gồm anken A và ankin B. Biết 50 ml hỗn hợp X phản ứng tối đa với 80 ml H2 (các thể tích khí đo ở cùng điều kiện nhiệt độ và áp suất). Mặt khác, đốt cháy hoàn toàn a gam X rồi hấp thụ toàn bộ sản phẩm cháy vào dung dịch nước vôi trong, thu được 25 gam kết tủa và còn lại dung dịch Y có khối lượng giảm 4,56 gam so với dung dịch ban đầu. Cho lượng KOH dư vào Y thu được 5 gam kết tủa nữa. Xác định công thức phân tử của A và B.
 Xem đáp án
Xem đáp án
Hướng dẫn giải
Đặt ,
Ta có: mdd giảm = mkết tủa – ()
⇔ 4,56 = 25 – (44a + 18b)
⇔ 44a + 18b = 20,44
Bảo toàn nguyên tố (C) a = 0,25 + 0,05.2 = 0,35 (mol)
⇒ b = 0,28 (mol)
nankin= 0,35 – 0,28 = 0,07 (mol)
Đặt nanken = x (mol)
Ta có: ⇒ x =
Gọi CTTQ của A và B lần lượt là: CnH2n (n2); CmH2m-2 (m2)
Khi đó: n + 0,07m = 0,35
Biện luận thấy n = m = 3 thỏa mãn.
Vậy A là: C3H6; B là C3H4
Câu 16:
Oxi hóa m gam một ancol đơn chức X, thu được hỗn hợp X gồm axit cacboxylic, nước và ancol dự. Chia Y làm hai phần bằng nhau. Phần một phản ứng hoàn toàn với dung dịch KHCO3 dư thu được 2,24 lít khí CO2 (đktc). Phần hai phản ứng với Na vừa đủ, thu được 3,36 lít khí H2 (đktc) và 19 gam chất rắn khan. Xác định công thức cấu tạo của ancol X.
 Xem đáp án
Xem đáp án
Hướng dẫn giải
= 0,1 (mol); = 0,15 (mol)
naxit (P1) = = 0,1 (mol) = naxit (P2) =
⇒ do axit tạo = 0,05 (mol)
do Na tạo = 0,05 (mol)
nancol dư = 2.(0,15 – 0,05 – 0,05) = 0,1 (mol)
19 gam chất rắn khan gồm: RCOONa: 0,1 (mol); R’ONa: 0,1 (mol) và NaOH: 0,1 (mol)
Ta có: (R + 67).0,1 + (R’ + 39).0,1 + 40.0,1 = 19
⇔ R + R’ = 44 ⇒ R là: CH3 và R’ là C2H5
Vậy công thức cấu tạo của ancol X là: C2H5OH