Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 3)
-
9429 lượt thi
-
19 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Nêu hiện tượng và viết phương trình hóa học xảy ra (nếu có) trong các trường hợp sau:
a) Nhúng lá nhôm vào dung dịch H2SO4 loãng.
 Xem đáp án
Xem đáp án
a) Nhúng lá nhôm vào dung dịch H2SO4 loãng:
Hiện tượng: Lá nhôm tan dần, xuất hiện bọt khí không màu, không mùi, dung dịch thu được trong suốt.
Phương trình hóa học:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
Câu 2:
b) Nhỏ dung dịch NaOH vào dung dịch FeCl3.
 Xem đáp án
Xem đáp án
b) Nhỏ dung dịch NaOH vào dung dịch FeCl3:
Hiện tượng: Xuất hiện kết tủa màu nâu đỏ, dung dịch màu vàng nâu nhạt màu dần.
Phương trình hóa học:
3NaOH + FeCl3 → Fe(OH)3↓ + 3NaCl
Câu 3:
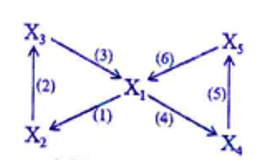
 Xem đáp án
Xem đáp án
2/
Xác định được các chất như sau:
X1: CH3COOH
X2: CH3COOC2H5
X3: C2H5OH
X4: (CH3COO)2Ca
X5: CH3COONa
Phương trình hóa học minh họa cho sơ đồ:
(1) CH3COOH + C2H5OH CH3COOC2H5 + H2O
(2) CH3COOC2H5 + H2O CH3COOH + C2H5OH
(3) C2H5OH + O2 CH3COOH + H2O
(4) 2CH3COOH + Ca(OH)2 → (CH3COO)2Ca + 2H2O
(5) (CH3COO)2Ca + Na2CO3 → 2CH3COONa + CaCO3↓
(6) CH3COONa + HCl → CH3COOH + NaCl
Câu 4:
3. Các loại bim bim (snack) là món yêu thích của nhiều người, nhất là các bạn trẻ. Trong các gói bim bim, lượng bim bim thường chỉ chiếm một nửa thể tích, phần còn lại là khí nitơ. Tại sao người ta không bơm không khí mà lại bơm khí nitơ vào các gói bim bim?
 Xem đáp án
Xem đáp án
3/
Những lý do người ta không bơm không khí mà lại bơm khí nitơ vào các gói bim bim:
- Khí nitơ trơ về mặt hóa học nên không làm ảnh hưởng đến chất lượng của bim bim (snack) bên trong.
- Khí nitơ cũng là loại khí không màu, không mùi, do đó khi ở trong gói bim bim chúng không làm biến dạng mùi vị sản phẩm, mà còn giữ cho miếng bim bim không bị ỉu, vẫn giòn ngon như ban đầu.
Câu 5:
1. Tiến hành thí nghiệm với khí X không màu theo các bước sau:
- Bước 1: Nạp đầy X vào một bình thủy tinh trong suốt, đậy bình bằng nút cao su có ống thủy tinh vuốt nhọn xuyên qua.
- Bước 2: Nhúng đầu ống thủy tinh vào cốc chứa nước có pha vài giọt quỳ tím.
Sau một thời gian, nước trong cốc theo ống phun vào bình thành tia (như hình vẽ).
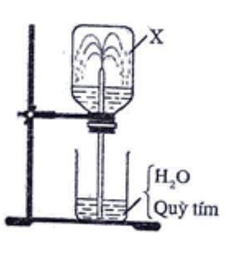
a) X là khí nào trong số các khí: O2, H2, CH4, HCl?
 Xem đáp án
Xem đáp án
1/
a) Dựa vào thí nghiệm ta thấy khí X tan tốt trong nước, vậy X là khí HCl.
Câu 6:
 Xem đáp án
Xem đáp án
b) Mục đích của thí nghiệm: Chứng minh tính tan nhiều của HCl trong nước.
Hiện tượng quan sát được: Nước phun mạnh vào bình thành các tia có màu đỏ.
Giải thích: Do tan nhiều trong nước, áp suất của khí HCl trong bình giảm đột ngột, nước trong cốc bị hút vào bình qua ống thủy tinh vuốt nhọn, phun thành các tia nước có màu đỏ.
Câu 7:
2. Hạt nhân của hầu hết các nguyên tử đều được tạo thành từ các hạt proton và hạt nơtron. Các nguyên tử có cùng số hạt proton nhưng khác nhau về số hạt nơtron được gọi là các đồng vị của một nguyên tố hóa học. Tổng số hạt proton, nơtron trong hạt nhân nguyên tử được gọi là số khối. Một cách gần đúng, nguyên tử khối có giá trị bằng số khối. Vì hầu hết các nguyên tố trong tự nhiên là hỗn hợp của nhiều đồng vì nên nguyên tử khối của một nguyên tố là nguyên tử khối trung bình của hỗn hợp các đồng vị của nguyên tố đó.
a) Nguyên tố cacbon có 2 đồng vị bền là X (hạt nhân chứ 6 proton, 6 nơtron) và Y (hạt nhân chứa 6 proton, 7 nơtron). Tính nguyên tử khối của các nguyên tử X, Y.
 Xem đáp án
Xem đáp án
2/
a/
Nguyên tử khối của X = 6 + 6 = 12
Nguyên tử khối của Y = 6 + 7 = 13
Câu 8:
b) Trong thể thao để gia tăng thành tích, một số vận động viên đã gian lận bằng cách sử dụng các loại chất kích thích (doping). Một trong các loại doping thường gặp nhất là testosterone tổng hợp. Đối với testosterone tự nhiên trong cơ thể, phần trăm số nguyên tử của đồng vị Y không đổi và bằng 1,11% trong khi testosterone tổng hợp (doping) có phần trăm số nguyên tử của đồng vị Y ít hơn testosterone tự nhiên. Đây chính là mấu chốt của xét nghiệm CIR (Cacbon Isotope Ratio) nhằm xác định vận động viên có sử dụng doping hay không. Giả sử, kết quả phân tích CIR đối với vận động viên thu được phần trăm số nguyên tử X là a và Y là b. Từ tỉ lệ đó, người ta tính được nguyên tử khối trung bình của cacbon trong mẫu phân tích có giá trị là 12,0098. Tính a, b và cho biết vận động viên này có sử dụng doping hay không.
 Xem đáp án
Xem đáp án
b/
Theo bài ra ta có hệ phương trình:
Vì %13C = 0,98% < 1,11% nên vận động viên này có sử dụng doping.
Câu 9:
3. Không dùng thêm: thuốc thử, nhiệt độ và phản ứng điện phân, hãy nhận biết các dung dịch đựng trong các lọ riêng biệt mất nhãn sau: H2SO4, Na2SO4, CuSO4, NaOH.
 Xem đáp án
Xem đáp án
3/ Nhận biết các dung dịch H2SO4, Na2SO4, CuSO4, NaOH đựng trong các lọ riêng biệt mất nhãn:
Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít ra ống nghiệm đánh số tương ứng (Trích mẫu thử).
- Mẫu thử có màu xanh lam là dung dịch CuSO4.
- Cho lần lượt dung dịch CuSO4 vừa nhận ra vào các mẫu thử còn lại:
+ Mẫu thử xuất hiện kết tủa xanh là dung dịch NaOH.
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
+ Mẫu thử còn lại là H2SO4 và Na2SO4 không có hiện tượng.
- Lọc kết tủa thu được, rồi đem tác dụng với 2 mẫu thử còn lại
+ Mẫu thử hòa tan được kết tủa là dung dịch H2SO4
H2SO4 + Cu(OH)2↓ → CuSO4 + 2H2O
+ Mẫu thử còn lại không hòa tan kết tủa là dung dịch NaOH
Câu 10:
1. Hợp chất X có công thức AB2 (A, B là hai nguyên tố hóa học). Tổng số hạt mang điện có trong một phân tử X là 70. Số hạt mang điện trong nguyên tử A nhiều hơn trong nguyên tử B là 22.
a) Tìm công thức của X.
(Cho số proton trong hạt nhân của các nguyên tử: H = 1; C = 6; N = 7; O = 8; Na = 11; Al = 13; Cl = 17; K = 19; Ca =20).
 Xem đáp án
Xem đáp án
1/
a/
Theo bài ra ta có hệ phương trình:
Ta có:
(Với ZA; ZB lần lượt là số hiệu nguyên tử của A và B, trong đó Z = số proton = số electron trong nguyên tử).
Vậy X là KO2
Câu 11:
b) X được sử dụng làm nguồn cung cấp oxi trong bình lặn và tàu ngầm. Viết phương trình hóa học giải thích ứng dụng trên của X.
 Xem đáp án
Xem đáp án
b/
Phương trình hóa học:
4KO2 + 2CO2 → 2K2CO3 + 3O2
Câu 12:
Hỗn hợp X chứa Fe, FeO, FeSO4 trong đó số mol FeSO4 gấp 9 lần số mol hai chất còn lại. Hòa tan hoàn toàn X trong dung dịch chứa 0,59 mol H2SO4 đặc, nóng thu được 0,27 mol SO2 và dung dịch Y. Cho dung dịch chứa 1,48 mol NaOH vào Y thu được 51,36 gam một chất kết tủa. Tính thành phần phần trăm khối lượng của FeO trong X.
 Xem đáp án
Xem đáp án
Đặt
Các phương trình hóa học xảy ra:
2Fe + 6H2SO4 đặc Fe2(SO4)3 + 3SO2↑ + 6H2O
2FeO + 4H2SO4 đặc Fe2(SO4)3 + SO2↑ + 4H2O
2FeSO4 + 2H2SO4 đặc Fe2(SO4)3 + SO2↑ + 2H2O
Cho dung dịch chứa 1,48 mol NaOH vào Y thu được kết tủa Fe(OH)3 (0,48 mol)
Ta có:
⇒ nH+ dư = 0,04 mol
Lại có:
→ nFeO = nO = 0,03 (mol) = y (mol)
Bảo toàn electron ta có:
3x + 0,03 + 9x + 0,27 = 0,27.2 → x = 0,02 (mol)
Vậy %mFeO = 3,01%.
Câu 13:
Hòa tan hoàn toàn 30 gam chất X là tinh thể muối sunfat ngậm nước của kim loại M trong m gam nước thu được dung dịch Y. Nhỏ dung dịch NaOH đến dư vào Y, lọc kết tủa rồi nung đến khối lượng không đổi thu được 9,6 gam chất rắn. Nếu thêm lượng dư dung dịch Ba(NO3)2 vào Y thì thu được 27,96 gam kết tủa. Biết hóa trị của M không thay đổi trong quá trinh phản ứng.
a) Tìm công thức của X.
 Xem đáp án
Xem đáp án
a/
Gọi công thức của tinh thể X là M2(SO4)n.kH2O (với n là hóa trị của M, n > 0, k > 0)
Đặt số mol tinh thể X là a (mol)
Vì cho lượng dư NaOH vào dung dịch Y vẫn thu được kết tủa nên M(OH)n không phản ứng với NaOH
M2(SO4)n + 2nNaOH → 2M(OH)n↓ + nNa2SO4
2M(OH)n M2On + nH2O
M2(SO4)n + nBa(NO3)2 → 2M(NO3)n + nBaSO4↓
|
n |
1 |
2 |
3 |
4 |
|
M |
32 |
64 (Cu) |
96 |
128 |
|
k |
5 |
10 (nhận) |
15 |
20 |
Vậy công thức tinh thể X là CuSO4.5H2O
Câu 14:
b) Trong dung dịch Y, số nguyên tử H gấp 1,68 lần số nguyên tử O. Tính m.
 Xem đáp án
Xem đáp án
b/
Đặt số mol của m gam H2O dùng để hòa tan tinh thể X là x (mol)
Trong dung dịch Y, số nguyên tử H gấp 1,68 lần số nguyên tử O
Câu 15:
Dẫn từ từ khí CO2 vào dung dịch chứa hỗn hợp a mol Ba(OH)2 và b mol NaOH. Sự phụ thuộc của số mol kết tủa thu được vào số mol khí CO2 phản ứng được thể hiện trong bảng sau:
|
Số mol khí CO2 |
0,11 |
0,16 |
|
Số mol kết tủa |
0,105 |
0,095 |
Lập luận tính số mol CO2 để lượng kết tủa thu được là 0,08 mol.
 Xem đáp án
Xem đáp án
Thứ tự phản ứng có thể xảy ra như sau
Ba(OH)2 + CO2 → BaCO3↓ + H2O
2NaOH + CO2 → Na2CO3 + H2O
Na2CO3 +CO2 + H2O → 2NaHCO3
BaCO3 + CO2 + H2O → Ba(HCO3)2
Nhận xét 1:
→ Tại thời điểm này kết tủa đạt cực đại
Nhận xét 2:
→ Tại thời điểm này kết tủa đã bị hòa tan một phần
→ Dung dịch gồm NaHCO3 và Ba(HCO3)2 bị hòa tan
Để thu được kết tủa thu được là 0,08 mol, ta nhận xét như sau:
→ Tồn tại 2 trường hợp
Trường hợp 1: Dung dịch gồm Ba(OH)2 và NaOH dư
Trường hợp 2: Dung dịch gồm NaHCO3; Ba(HCO3)2
Câu 16:
Chất hữu cơ X có trong các sản phẩm chăm sóc da để tẩy da chết, làm sáng da và mờ các vết thâm…Trong công nghiệp thực phẩm, X được sử dụng như một chất tạo hương vị để thực phẩm có vị chua cay. X chứa C, H, O với tỉ lệ khối lượng mC : mO = 3 : 5. Phân tử khối của X là 134
a) Tìm công thức phân tử của X
 Xem đáp án
Xem đáp án
a/
Gọi công thức phân tử của X là CxHyOz
Câu 17:
b) Khi cho a mol X tác dụng hết với dung dịch NaHCO3 dư thu được 2a mol khí CO2. X có mạch cacbon không phân nhánh, phân tử chỉ chứa các nhóm chức –OH và –COOH. Viết công thức cấu tạo của X và các phương trình hóa học xảy ra khi cho X lần lượt tác dụng với dung dịch NaOH, NaHCO3.
 Xem đáp án
Xem đáp án
b/
Vì a mol X tác dụng với dung dịch NaHCO3 thu được 2a mol CO2 nên X có 2 nhóm -COOH
Vì X có 5 nguyên tử O nên X có 1 nhóm -OH và 2 nhóm -COOH
Vậy X có CTCT: HOOC-CH2-CH(OH)-COOH
HOOC-CH2-CH(OH)-COOH + 2NaOH → NaOOC-CH2-CH(OH)-COONa + 2H2O
HOOC-CH2-CH(OH)-COOH + 2NaHCO3 → NaOOC-CH2-CH(OH)-COONa + 2CO2 + 2H2O
Câu 18:
Đốt cháy hoàn toàn 0,03 mol hỗn hợp X gồm hai hidrocacbon mạch hở A và B có cùng số nguyên tử H trong phân tử, số nguyên tử C của mỗi chất không vượt quá 4. Dẫn sản phẩm cháy sinh ra lần lượt qua bình (1) đựng 51,3 gam dung dịch H2SO4 98% rồi bình (2) chứa 10 lít dung dịch Ca(OH)2 0,012M. Sau khi các phản ứng kết thúc thấy dung dịch H2SO4 trong bình (1) có nồng độ 95% và dung dịch trong bình (2) có nồng độ 0,004M.
a) Tìm công thức phân tử của A, B và số mol mỗi chất trong X.
 Xem đáp án
Xem đáp án
a/
Gọi công thức của 2 hidrocacbon A và B lần lượt là CaHx và CbHx (với a < 4 và b < 4; x chia hết cho 2)
4CaHx + (4a+x)O2 4aCO2 + 2xH2O
4CbHx + (4b+x)O2 4bCO2 + 2xH2O
Vì dung dịch sau phản ứng dư Ca(OH)2 nên CO2 chỉ tạo kết tủa.
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Giả sử A có số C nhỏ hơn B → a < 2,667 < b < 4
Trường hợp 1: a = 1 (loại vì không có chất CH6)
Trường hợp 2: a = 2 và b = 3 → A là C2H6 và B là C3H6
Trường hợp 3: a = 2 và b = 4 → A là C2H6 và B là C4H6
Câu 19:
b) Thêm a mol H2 vào 0,03 mol X rồi dẫn qua bột Ni đun nóng thu được hỗn hợp Y chỉ chứa các hidrocacbon. Y làm mất màu tối đa 10 ml dung dịch Br2 1M. Tính a.
 Xem đáp án
Xem đáp án
b/
Trường hợp 1: X gồm C2H6 (0,01 mol) và C3H6 (0,02 mol)
C3H6 + H2 C3H8
C3H6 + Br2 → C3H6Br2
Nhận xét:
Trường hợp 2: X gồm C2H6 (0,02 mol) và C4H6 (0,01 mol)
C4H6 + H2 C4H8
C4H6 + 2H2 C4H10
C4H6 + Br2 → C4H6Br2
C4H6 + 2Br2 → C4H6Br4
Nhận xét:
