Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 17)
-
9406 lượt thi
-
17 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Xác định các chất X1, X2, X3, X4 và viết các phương trình hóa học (ghi rõ điều kiện xảy ra, nếu có) của các phản ứng theo sơ đồ sau:
 Xem đáp án
Xem đáp án
Ta có: X1: CH3COOH; X2: CO; X3: CuSO4; X4: Fe(OH)3.
Phương trình hóa học:
C4H10 + O2 2CH3COOH + H2O
CH3COOH + C2H5OH CH3COOC2H5 + H2O
CH3COOC2H5 + 5O2 4CO2 + 4H2O
CO2 + C 2CO
CO + CuO Cu + CO2
Cu + 2H2SO4 đặc CuSO4 + SO2 + 2H2O
CuSO4 + Fe → FeSO4 + Cu
6FeSO4 + 3Cl2 → 2FeCl3 + 2Fe2(SO4)3
Fe2(SO4)3 + 6NaOH → 2Fe(OH)3↓ + 3Na2SO4
2Fe(OH)3 Fe2O3 + 3H2O
Câu 2:
Nêu hiện tượng quan sát được và viết các phương trình hóa học của các phản ứng xảy ra (nếu có) khi tiến hành các thí nghiệm sau:
a. Cho một ít bột Mg vào dung dịch KHSO4.
 Xem đáp án
Xem đáp án
a. Hiện tượng: Bột Mg tan dần và sủi bọt khí không màu.
Phương trình hóa học:
Mg + 2KHSO4 → MgSO4 + K2SO4 + H2↑
Câu 3:
b. Cho từ từ đến dư dung dịch Ba(OH)2 vào dung dịch Al2(SO4)3.
 Xem đáp án
Xem đáp án
b. Hiện tượng: Xuất hiện kết tủa trắng sau đó kết tủa tan dần một phần.
Phương trình hóa học:
3Ba(OH)2 + Al2(SO4)3 → 3BaSO4↓ + 2Al(OH)3↓
Ba(OH)2 + 2Al(OH)3 → Ba(AlO2)2 + 4H2O
Câu 4:
c. Đun nóng ống nghiệm chứa nước ép quả nho chín và dung dịch bạc nitrat trong amoniac.
 Xem đáp án
Xem đáp án
c. Hiện tượng: Xuất hiện kết tủa trắng bạc trên thành ống nghiệm.
Phương trình hóa học:
C6H12O6 + 2AgNO3 + 3NH3 + H2O C5H11O5-COONH4 + 2Ag↓ + 2NH4NO3
(Hoặc: C6H12O6 + Ag2O C6H12O7 + 2Ag).
Câu 5:
d. Đốt cháy rượu etylic, dùng ống nghiệm úp phía trên ngọn lửa. Sau đó, rót nước vôi trong vào ống nghiệm, lắc nhẹ.
 Xem đáp án
Xem đáp án
d. Hiện tượng: Xuất hiện kết tủa trắng.
Phương trình hóa học:
C2H5OH + 3O2 2CO2 + 3H2O
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Câu 6:
Hình vẽ sau mô tả thí nghiệm điều chế và thu khí clo trong phòng thí nghiệm.
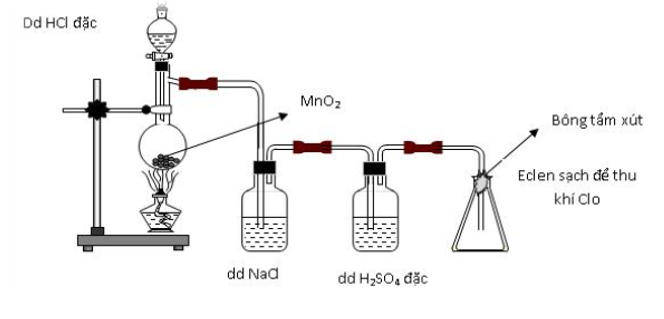
a. Nêu vai trò của bình chứa dung dịch H2SO4 đặc và bông tẩm dung dịch NaOH. Viết các phương trình hóa học của các phản ứng đã xảy ra.
 Xem đáp án
Xem đáp án
a. Vai trò của bình chứa dung dịch H2SO4 đặc để giữ lại hơi nước và bông tẩm dung dịch NaOH để tránh khí Cl2 thoát ra ngoài.
MnO2 + 4HCl đặc MnCl2 + Cl2 + 2H2O
2NaOH + Cl2 → NaCl + NaClO + H2O
Câu 7:
b. Cho 3,95 gam KMnO4 tác dụng với lượng dư dung dịch HCl đặc thu được tối đa V lít khí Cl2. Tính giá trị của V.
 Xem đáp án
Xem đáp án
b. Ta có:
Phương trình hóa học:
lít.
Câu 8:
Giải thích các trường hợp sau và viết phương trình hóa học của các phản ứng xảy ra (nếu có):
a. Than hoạt tính được dùng làm mặt nạ phòng độc, làm chất khử màu, khử mùi, …
 Xem đáp án
Xem đáp án
a. Than hoạt tính có khả năng hấp phụ các chất độc, chất có mùi, chất màu, …
Câu 9:
b. Khí hiđro được sử dụng làm nhiên liệu thay thế cho than đá, dầu mỏ, khí thiên nhiên, …
 Xem đáp án
Xem đáp án
b. Khí hiđro khi cháy tỏa ra nhiều nhiệt lượng và chỉ tạo hơi nước nên là nguồn năng lượng sạch, có thể thay thế cho nhiên liệu hóa thạch trong tương lai.
Câu 10:
c. Cho canxi cacbua vào nước có pha sẵn vài giọt phenolphtalein, thu được dung dịch màu hồng và thấy sủi bọt khí.
 Xem đáp án
Xem đáp án
c. Phương trình hóa học:
CaC2 + 2H2O → Ca(OH)2 + C2H2↑.
Ca(OH)2 tạo thành làm hồng phenolphtalein.Câu 11:
d. Cho bột NaHCO3 vào cốc thủy tinh đựng dung dịch CH3COOH. Nghiêng miệng cốc về phía ngọn nến nhỏ đang cháy thì ngọn nến bị tắt.
 Xem đáp án
Xem đáp án
d. Phương trình hóa học:
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑.
Khí CO2 sinh ra làm ngọn nến bị tắt.
Câu 12:
Đốt nóng m gam bột Fe trong không khí, thu được hỗn hợp A gồm ba oxit. Hòa tan hoàn toàn A bằng dung dịch HCl, thu được dung dịch D chỉ chứa hai muối. Cho lượng dư dung dịch AgNO3 vào D, sau khi các phản ứng xảy ra hoàn toàn, thu được 20,46 gam chất rắn E. Mặt khác, dung dịch D có khả năng hòa tan tối đa 0,64 gam Cu. Tính giá trị m.
 Xem đáp án
Xem đáp án
Dung dịch D chứa muối FeCl2 và FeCl3.
Dung dịch D + Cu
Cu + 2FeCl3 → CuCl2 + 2FeCl2
nCu = 0,01 mol →
Dung dịch D + AgNO3 dư:
Theo giả thiết thu được 20,46 gam chất rắn nên
143,5.2x + 108x + 143,5.0,06 = 20,46 → x = 0,03
Vậy dung dịch D gồm 0,03 mol FeCl2 và 0,02 mol FeCl3.
Bảo toàn nguyên tố Fe, ta có
Câu 13:
Thủy phân 270 gam tinh bột bằng dung dịch H2SO4 loãng, đun nóng (hiệu suất phản ứng là 72%), thu được dung dịch X. Trung hòa toàn bộ X bằng dung dịch NaHCO3 vừa đủ, thu được dung dịch Y. Thực hiện phản ứng lên men toàn bộ Y với hiệu suất 75%, thu được V ml dung dịch rượu etylic 40o. Biết khối lượng riêng của rượu etylic nguyên chất là 0,8 g/ml. Nếu đem toàn bộ lượng rượu này lên men giấm với hiệu suất H% thì thu được 1,5 lít dung dịch Z (giả sử chỉ xảy ra phản ứng lên men giấm). Để trung hòa 10 ml dung dịch Z, cần vừa đủ 14,4 ml dung dịch NaOH 0,5M. Tính giá trị của V và H.
 Xem đáp án
Xem đáp án
Thủy phân tinh bột:
(C6H10O5)n + nH2O nC6H12O6
Hiệu suất 72% nên
Dung dịch X: C6H12O6, tinh bột dư và H2SO4 loãng.
H2SO4 + 2NaHCO3 → Na2SO4 + H2O + CO2
Dung dịch Y: C6H12O6, tinh bột dư và Na2SO4.
C6H12O6 2C2H5OH + 2CO2
Hiệu suất phản ứng lên men là 75% nên
Thể tích rượu etylic 40o thu được là
C2H5OH + O2 CH3COOH + H2O
CH3COOH + NaOH → CH3COONa + H2O
Số mol NaOH cần dùng để trung hòa 1,5 lít dung dịch Z là
Hiệu suất phản ứng lên men giấm là
Câu 14:
Hỗn hợp X gồm metan, etilen và axetilen. Đốt cháy hoàn toàn 9,6 gam X bằng lượng oxi vừa đủ, thu được hỗn hợp Y. Dẫn toàn bộ Y vào bình đựng dung dịch NaOH, thu được dung dịch chỉ chứa 74,2 gam Na2CO3. Khi sục từ từ 11,2 lít X vào dung dịch brom dư thì có tối đa 100 gam brom phản ứng. Tính phần trăm thể tích của các chất trong X.
 Xem đáp án
Xem đáp án
Gọi số mol của CH4, C2H4 và C2H2 trong 9,6 gam X lần lượt là x, y, z mol.
16x + 28y + 26z = 9,6 (1)
Đốt cháy X và dẫn sản phẩm vào bình đựng dung dịch NaOH
x + 2y + 2z = 0,7 (2)
Số mol của CH4, C2H4 và C2H2 trong 11,2 lít X lần lượt là kx, ky, kz mol.
Lấy (3) chia (4) ta được, 5x + y – 3z = 0 (5)
Giải hệ (1, 2, 5) ta được x = 0,1; y = 0,1 và z = 0,2
Câu 15:
Đốt cháy 11,075 gam trieste T trong không khí, rồi hấp thụ toàn bộ sản phẩm cháy vào bình đựng dung dịch nước vôi trong dư, thu được 71,25 gam kết tủa, đồng thời khối lượng dung dịch giảm 27,975 gam so với ban đầu. Mặt khác, đun nóng 26,58 gam T với 17,1 ml dung dịch NaOH 20% (có khối lượng riêng bằng 1,2 g/ml), thu được glixerol và m gam hỗn hợp muối của axit béo. Biết các phản ứng đều xảy ra hoàn toàn và số mol NaOH dùng dư a% so với lượng phản ứng. Tính giá trị của m và a.
 Xem đáp án
Xem đáp án
Khối lượng dung dịch giảm 27,975 gam nên
Tỉ lệ C : H : O = 0,7125 : 1,325 : 0,075 = 57 : 106 : 6
Công thức phân tử của trieste T là C57H106O6.
và
Lượng NaOH dư là 0,1026 – 0,03.3 = 0,0126 mol
→
Bảo toàn khối lượng, ta có
Câu 16:
Nung nóng 20 gam một mẩu quặng malachit có thành phần chính là Cu(OH)2.CuCO3 (còn lại là tạp chất trơ) trong không khí. Hòa tan toàn bộ lượng CuO thu được bằng dung dịch H2SO4 20% vừa đủ, sau đó làm lạnh dung dịch đến 10oC thì có 24,6 gam tinh thể CuSO4.5H2O tách ra. Biết các phản ứng đều xảy ra hoàn toàn và độ tan của CuSO4 ở 10oC là 17,4 gam. Tính hàm lượng phần trăm của Cu(OH)2.CuCO3 có trong mẩu quặng.
 Xem đáp án
Xem đáp án
Cu(OH)2.CuCO3 2CuO + H2O + CO2
Khối lượng dung dịch H2SO4 20% đã dùng: 490x (gam).
Khối lượng dung dịch trước khi làm lạnh: 80x + 490x = 570x (gam).
Khối lượng dung dịch bão hòa thu được sau khi làm lạnh: (570x – 24,6) gam và chứa lượng chất tan: (x – 0,0984).160 gam
Theo giả thiết độ tan của CuSO4 là 17,4 gam nên ta có:
Giải phương trình ta được x = 0,16
Ta có
Hàm lượng phần trăm của Cu(OH)2.CuCO3 có trong mẩu quặng là
Câu 17:
Hỗn hợp E gồm Al, FexOy và CuO, trong đó tỉ lệ khối lượng của FexOy và CuO tương ứng là 29:35. Nung nóng m gam E trong bình kín (không có không khí), thu được hỗn hợp Z. Cho toàn bộ Z tác dụng với lượng dư dung dịch NaOH, thu được 0,336 lít khí H2 và còn lại 3,92 gam hỗn hợp rắn T. Hòa tan 3,92 gam T bằng lượng dư dung dịch H2SO4 đặc, nóng, thu được V lít khí SO2 (sản phẩm khử duy nhất). Hấp thụ toàn bộ V lít khí SO2 vào 120 ml dung dịch Ba(OH)2 0,5M thu được 8,68 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Xác định công thức FexOy và tính phần trăm khối lượng của Al có trong E.
 Xem đáp án
Xem đáp án
Hỗn hợp E: Al, FexOy và CuO
2yAl + 3FexOy yAl2O3 + 3xFe (1)
2Al + 3CuO Al2O3 + 3Cu (2)
Hỗn hợp Z: Al2O3, Fe, Cu và Al dư
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (3)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (4)
→ nAl dư (Z) = 0,01 mol.
3,92 gam hỗn hợp rắn T: Fe và Cu
2Fe + 6H2SO4 đặc Fe2(SO4)3 + 3SO2 + 6H2O (5)
Cu + 2H2SO4 đặc CuSO4 + SO2 + 2H2O (6)
SO2 + Ba(OH)2 → BaSO3 + H2O (7)
SO2 + BaSO3 + H2O → Ba(HSO3)2 (8)
Gọi số mol của Fe và Cu trong 3,92 gam T là x, y
→ 56x + 64y = 3,92 (I)
Theo giả thiết và
TH1: Không xảy ra phản ứng (8), Ba(OH)2 dư.
→ Bảo toàn electron: 3x + 2y = 0,08 (II)
Giải hệ (I, II) ta được x = -0,034 và y = 0,091 → loại
TH2: SO2 dư hòa tan một phần kết tủa
Tổng số mol SO2 là 0,08 mol
→ Bảo toàn electron: 3x + 2y = 0,16 (III)
Giải hệ (I, III) ta được x = 0,03 và y = 0,035.
Ta có nCuO = 0,035 mol
→ mCuO = 2,8 gam mà →
→ mO = 2,32 – 0,03.56 = 0,64 gam → nO = 0,04 mol
→ Tỉ lệ:
→ Công thức oxit là Fe3O4: 0,01 mol
Bảo toàn electron cho phản ứng nhiệt nhôm:
→ nAl phản ứng = 0,05 mol
Số mol Al ban đầu là: 0,01 + 0,05 = 0,06 mol
Khối lượng hỗn hợp E là: 0,06.27 + 0,01.232 + 0,035.80 = 6,74 gam
Phần trăm khối lượng của Al trong E là: 24,04%.
