Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 19)
-
9452 lượt thi
-
16 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Viết các phương trình hóa học của các phản ứng xảy ra khi:
a. Sục từ từ khí CO2 đến dư vào dung dịch nước vôi trong.
 Xem đáp án
Xem đáp án
Các phương trình hóa học xảy ra:
a. CO2 + Ca(OH)2 → CaCO3↓ + H2O
CO2 + CaCO3↓ + H2O → Ca(HCO3)2
Câu 2:
b. Cho KHCO3 rắn vào dung dịch H2SO4 đặc dư.
 Xem đáp án
Xem đáp án
b. 2KHCO3 + H2SO4 → K2SO4 + 2H2O + 2CO2↑
Câu 3:
c. Cho oxit Fe3O4 tác dụng với dung dịch HCl dư.
 Xem đáp án
Xem đáp án
c. Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
Câu 5:
Hoàn thành các sơ đồ phản ứng sau đây:
(X1) + H2SO4 → (X2) + SO2↑ + H2O (1)
(X3) + KOH → (X2) + (X4) (2)
(X5) + KOH → (X2) + (X6) + H2O (3)
Biết M(X1) = M(X3) = M(X5) = 120 g/mol.
 Xem đáp án
Xem đáp án
X1: KHSO3; X3: MgSO4; X5: NaHSO4; X2: K2SO4; X4: Mg(OH)2; X6: Na2SO4.
Các phản ứng xảy ra trong sơ đồ:
2KHSO3 + H2SO4 → K2SO4 + 2SO2↑ + 2H2O
MgSO4 + 2KOH → K2SO4 + Mg(OH)2↓
2NaHSO4 + 2KOH → K2SO4 + Na2SO4 + 2H2O
Câu 6:
Hình vẽ sau đây mô tả thí nghiệm điều chế khí Cl2 trong phòng thí nghiệm:
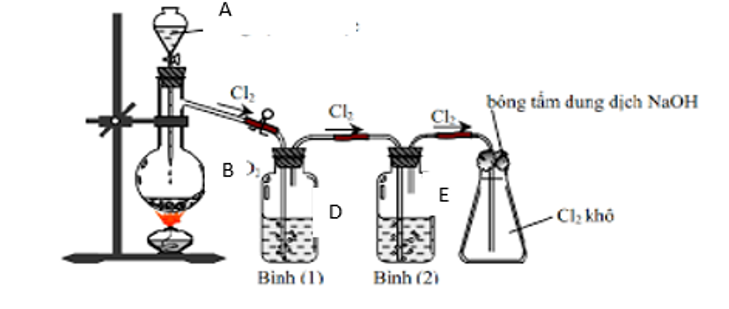
a. Hãy chọn các hóa chất A, B, D, E phù hợp và viết phương trình hóa học điều chế khí Cl2.
 Xem đáp án
Xem đáp án
a. A: dung dịch HCl đặc.
B: Các chất oxi hóa mạnh như: MnO2, KMnO4, K2Cr2O7, CaOCl2, …
D: dung dịch NaCl bão hòa.
E: dung dịch H2SO4 đặc.
Một số phương trình hóa học điều chế Cl2:
MnO2 + 4HCl đặc MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl đặc 2KCl + 2MnCl2 + 5Cl2 + 8H2O
K2Cr2O7 + 14HCl đặc 2KCl + 2CrCl3 + 3Cl2 + 7H2O
Câu 7:
b. Cho biết vai trò của bình (1), bình (2) trong quá trình điều chế trên.
 Xem đáp án
Xem đáp án
b. Vai trò của bình 1 (dung dịch NaCl bão hòa): để giữ lại hơi HCl trong hỗn hợp khí và hơi thoát ra từ bình cầu.
Vai trò của bình 2 (dung dịch H2SO4 đặc): để giữ lại hơi nước.
Câu 8:
Trình bày phương pháp hóa học để làm sạch khí CO2 có lẫn tạp chất SO2.
 Xem đáp án
Xem đáp án
Cho hỗn hợp khí đi qua dung dịch brom dư, SO2 bị giữ lại theo phương trình:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
Khí CO2 không phản ứng thoát ra.
Câu 9:
Nung hỗn hợp X gồm a gam Al và 24 gam Fe2O3 trong điều kiện không có không khí, sau phản ứng thu được hỗn hợp chất rắn Y. Cho Y tác dụng với 500 ml dung dịch NaOH bM thu được 6,72 lít khí H2, chất rắn không tan Z và dung dịch T gồm 2 chất tan có cùng nồng độ mol. Biết các phản ứng xảy ra hoàn toàn. Tìm giá trị của a và b.
 Xem đáp án
Xem đáp án
Phương trình hóa học:
2Al + Fe2O3 Al2O3 + 2Fe
Chất rắn Y: Al2O3, Fe và Al dư
Al2O3 + 2NaOH → 2NaAlO2 + H2O
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Chất rắn không tan Z: Fe.
Dung dịch T: NaAlO2, NaOH dư
Ta có: → nAl phản ứng = 0,3 mol
→ nAl dư = 0,2 mol
Số mol Al ban đầu là: 0,3 + 0,2 = 0,5 mol
→ mAl = 0,5.27 = 13,5 gam
→ a = 13,5
Bảo toàn nguyên tố Al:
Dung dịch T gồm 2 chất tan có cùng nồng độ mol tức có cùng số mol nên
nNaOH dư = 0,5 mol
Bảo toàn nguyên tố Na: nNaOH phản ứng = nAl ban đầu = 0,5 mol
Số mol NaOH ban đầu là: 0,5 + 0,5 = 1,0 mol
Nồng độ NaOH là → b = 2
Câu 10:
Etilen và các chất tương tự etilen có chứa 1 liên kết đôi trong phân tử nên dễ tham gia phản ứng cộng. Phản ứng cộng với brom, liên kết kém bền trong liên kết đôi bị đứt ra và mỗi phân tử etilen đã kết hợp thêm một phân tử brom:
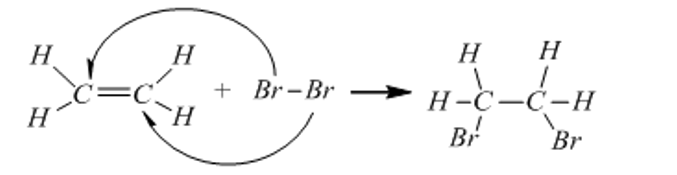
Dẫn khí P (có công thức phân tử C4H8, chứa liên kết đôi tương tự etilen) đi qua dung dịch brom màu da cam, sau phản ứng thấy dung dịch brom bị mất màu và thu được sản phẩm hữu cơ Q (C4H8Br2). Viết công thức cấu tạo có thể có của Q.
 Xem đáp án
Xem đáp án
Có 3 CTCT có thể có của Q:
CH2=CH-CH2-CH3
CH3-CH=CH-CH3
CH2=C(CH3)2
Câu 11:
Cho G, I và K là các hợp chất no, mạch hở có công thức đơn giản nhất là C2H3O2. Biết các chất trên chỉ chứa nhóm chức phản ứng được với dung dịch NaOH (đun nóng).
a. Xác định công thức phân tử của G, I, K.
 Xem đáp án
Xem đáp án
a. Gọi công thức của G, I, K là: (C2H3O2)n
Độ bất bão hòa của G, I, K là:
Do G, I, K là hợp chất no chỉ chứa các nhóm chức phản ứng được với NaOH nên
CTPT của G, I, K là C4H6O4.
Câu 12:
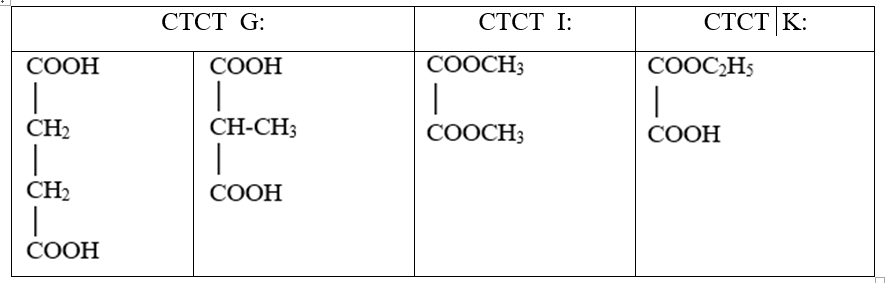
b. Viết công thức cấu tạo có thể có của G, I và K. Biết G, I và K tham gia các phản ứng theo đúng tỉ lệ mol như sau:
(G) + 2NaHCO3 → (G1) + 2CO2↑ + 2H2O
(I) + 2NaOH → (I1) + 2CH3OH
(K) + 2NaOH → (I1) + (K1) + H2O
 Xem đáp án
Xem đáp án
b. G + 2NaHCO3 → (G1) + 2CO2↑ + 2H2O nên G là axit 2 chức.
(I) + 2NaOH → (I1) + 2CH3OH nên I là este 2 chức của axit hai chức với CH3OH.
(K) + 2NaOH → (I1) + (K1) + H2O nên K là hợp chất tạp chức axit và este.
Câu 13:
Hỗn hợp T gồm 2 chất hữu cơ U (RCOOH) và V (R’(OH)2), trong đó R, R’ là các gốc hiđrocacbon mạch hở. Lấy 0,05 mol hỗn hợp T tác dụng với Na dư thấy giải phóng 0,896 lít khí. Mặt khác, đốt cháy hoàn toàn 0,25 mol hỗn hợp T, sau phản ứng thu được 15,68 lít CO2 và 13,5 gam H2O. Tìm công thức phân tử và viết công thức cấu tạo của U và V.
 Xem đáp án
Xem đáp án
Gọi x và y lần lượt là số mol của U và V trong 0,05 mol hỗn hợp T.
Phương trình hóa học: RCOOH + Na → RCOONa + H2
R’(OH)2 + 2Na → R’(ONa)2 + H2
Ta có hệ phương trình:
Trong 0,25 mol hỗn hợp T có 0,1 mol RCOOH và 0,15 mol R’(OH)2.
Khi đốt cháy :
Gọi n và m lần lượt là số nguyên tử Cacbon trong U và V.
Bảo toàn nguyên tố C: 0,1n + 0,15m = 0,7 → 2n + 3m = 14 → Chọn n = 4 và m = 2
Vì nên ancol V là no → V là C2H6O2 hay C2H4(OH)2.
Bảo toàn nguyên tố H
→ số nguyên tử H trong U là:
CTPT của U là: C4H6O2.
CTCT của U là: CH2=CH-CH2-COOH
CH3-CH=CH-COOH
CH2=C(CH3)-COOH
Câu 14:
Khoáng chất X có công thức dạng MCO3.M(OH)2.nH2O (M là kim loại có hóa trị không đổi, n là số nguyên và n ≤ 10). Nung 19,2 gam X đến khối lượng không đổi thu được 8,0 gam chất rắn MO và hỗn hợp Y (gồm khí và hơi).
a. Xác định công thức của khoáng chất X.
 Xem đáp án
Xem đáp án
a. Phương trình hóa học:
MCO3.M(OH)2.nH2O 2MO + CO2 + (n + 1)H2O
Ta có:
Biện luận ta được n = 9 và M = 64 (Cu) thỏa mãn.
Công thức của khoáng chất X là: CuCO3.Cu(OH)2.9H2O
Câu 15:
b. Dẫn toàn bộ hỗn hợp Y vào 100 ml dung dịch Z gồm NaOH 1M và Ba(OH)2 0,3M đến khi phản ứng hoàn toàn thu được m1 gam kết tủa, khối lượng dung dịch tăng lên so với ban đầu là m2 gam. Tính m1, m2.
 Xem đáp án
Xem đáp án
b. Hỗn hợp Y gồm 0,05 mol CO2 và 0,5 mol H2O(h).
Theo giả thiết,
m1 gam kết tủa gồm 0,03 mol BaCO3 → m1 = 0,03.197 = 5,91 gam
Khối lượng dung dịch tăng lên so với ban đầu là:
m2 =
Câu 16:
Dẫn hỗn hợp khí A gồm 2 hidrocacbon mạch hở N (CnH2n+2) và M (CmH2m+2-2k) vào bình đựng 250 ml dung dịch Br2 1M, chỉ xảy ra phản ứng:
CmH2m+2-2k + kBr2 → CmH2m+2-2kBr2k
Sau phản ứng hoàn toàn thấy khối lượng bình brom tăng lên 7,0 gam, đồng thời có 14,6 gam khí thoát ra khỏi bình. Đốt cháy hoàn toàn khí thoát ra thu được 21,952 lít CO2.
a. Xác định công thức phân tử của N và M.
b. Tính thành phần phần trăm về thể tích của các khí trong hỗn hợp A.
 Xem đáp án
Xem đáp án
Theo giả thiết:
Xét phản ứng:
Vì khối lượng bình brom tăng 7,0 gam chính là khối lượng M phản ứng nên ta có
Chọn k = 1 và m = 2 → CTPT của M là C2H4.
Hỗn hợp khí thoát ra gồm CnH2n+2 (N): x mol và C2H4 (M) dư: y mol
Ta có hệ:
→ x = 0,44
→ 0,44n + 2y = 0,98
Nếu n = 1 (CH4) → y = 0,27
Nếu n = 2 (C2H6) → y = 0,05
