Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 10)
-
9426 lượt thi
-
21 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Nêu hiện tượng quan sát được và viết các phương trình hóa học của phản ứng xảy ra (nếu có) khi tiến hành các thí nghiệm sau:
a) Cho lượng dư CuSO4 khan vào rượu etylic 90°.
 Xem đáp án
Xem đáp án
a) Cho lượng dư CuSO4 khan vào rượu etylic 90°:
Hiện tượng: CuSO4 khan màu trắng thành hidrat màu xanh
Phương trình hóa học:
CuSO4 + 5H2O → CuSO4. 5H2O
Câu 2:
b) Nhỏ vài giọt oleum (H2SO4,3SO3) vào dung dịch Ba(HCO3)2.
 Xem đáp án
Xem đáp án
b) Nhỏ vài giọt oleum (H2SO4,3SO3) vào dung dịch Ba(HCO3)2.
Hiện tượng: Xuất hiện kết tủa trắng và khí không màu
Phương trình hóa học:
H2SO4.3SO3 + 3H2O → 4H2SO4
H2SO4 + Ba(HCO3)2 → BaSO4↓ + 2H2O + 2CO2
Câu 3:
c) Đưa bình đựng hỗn hợp khí metan và clo ra ánh sáng. Sau một thời gian, cho nước vào bình, lắc nhẹ rồi thêm vào một mẩu giấy quỳ tím.
 Xem đáp án
Xem đáp án
c) Hiện tượng: Màu vàng lục clo mất dần, quỳ tím hóa đỏ
Phương trình hóa học:
CH4 + Cl2 CH3Cl + HCl (↑)
HCl (↑) + H2O → dd HCl
Dung dịch HCl làm quỳ tím hóa đỏ.
Câu 4:
d) Lấy nước ép quả nho chín cho vào ống nghiệm có chứa dung dịch AgNO3/NH3, đặt ống nghiệm vào cốc nước nóng.
 Xem đáp án
Xem đáp án
d) Hiện tượng: Tạo kết tủa trắng bạc
Phương trình hóa học:
C6H12O6 + Ag2O C6H12O7 + 2Ag
Câu 5:
Chỉ dùng tối đa 2 thuốc thử hãy trình bày cách phân biệt các kim loại đựng trong các lọ riêng biệt gồm: Ba, Ag, Al, Fe, Mg.
 Xem đáp án
Xem đáp án
Đánh số thứ tự từng lọ mất nhãn, trích mẫu thử.
Cho 5 mẫu kim loại tác dụng với dung dịch HCl dư:
+ Mẫu tan và sủi bọt khí là: Ba, Al; Fe; Mg
Ba + 2HCl ⟶ BaCl2 + H2↑
Mg + 2HCl ⟶ MgCl2 + H2↑
2Al + 6HCl ⟶ 2AlCl3 + 3H2↑.
Fe + 2HCl ⟶ FeCl2 + H2
+ Mẫu không tan là Ag
Nhỏ từ từ dung dịch NaOH vào các dung dịch muối vừa hình thành ở trên cho đến dư.
+ Mẫu tạo kết tủa trắng là MgCl2 ⇒ Kim loại ban đầu là Mg
MgCl2 + 2NaOH ⟶ Mg(OH)2↓ + 2NaCl.
+ Mẫu tạo kết tủa trắng xanh, hóa nâu ngoài không khí là FeCl2⇒ Kim loại ban đầu là Fe
FeCl2 + 2NaOH ⟶ Fe(OH)2↓ + 2NaCl.
4Fe(OH)2↓ + O2 + 2H2O ⟶ 4Fe(OH)3 ↓.
+ Mẫu tạo kết tủa keo trắng và kết tủa tan dần khi kiềm dư là AlCl3⇒ Kim loại ban đầu là Al
AlCl3 + 3NaOH ⟶ Al(OH)3↓ + 3NaCl.
Al(OH)3 + NaOH ⟶ Na[Al(OH)4]
+ Mẫu không có hiện tượng gì là BaCl2 ⇒ Kim loại ban đầu là Ba
Câu 6:
Cho hỗn hợp các khí gồm: CO2, SO2, C2H4, C2H2, CH4.
Trình bày phương pháp hóa học để thu được CH4 tinh khiết từ hỗn hợp khí trên. Viết các phương trình hóa học của phản ứng xảy ra.
 Xem đáp án
Xem đáp án
3. Tinh chế CH4:
Dẫn hỗn hợp khí trên đi qua dung dịch nước vôi trong dư, CO2 và SO2 bị hấp thụ hết.
CO2 + Ca(OH)2 ⟶ CaCO3↓ + H2O
SO2 + Ca(OH)2 ⟶ CaSO3↓+ H2O
Các khí còn lại dẫn qua dung dịch Br2 dư, C2H4, C2H2 bị hấp thụ hết.
C2H4 + Br2 ⟶ C2H4Br2
C2H2 + 2Br2 ⟶ C2H2Br4
Khí CH4 thoát ra dẫn qua bình H2SO4 đặc dư ta thu được CH4 tinh khiết.
Câu 7:
Chất A được tạo ra do quá trình quang hợp của cây xanh. Thủy phân chất A trong môi trường axit được chất A1. Lên men chất A1 được ancol (rượu) A2. Tiếp tục lên men ancol A2 được axit A3. Cho axit A3 phản ứng với ancol A2 trong điều kiện thích hợp được hợp chất hữu cơ A4.
Xác định các chất A, A1, A2, A3, A4 và viết các phương trình hóa học của phản ứng xảy ra.
 Xem đáp án
Xem đáp án
A là (C6H10O5)n
|
A1 |
A2 |
A3 |
A4 |
|
C6H12O6 |
C2H5OH |
CH3COOH |
CH3COOC2H5 |
Các phương trình hóa học minh họa:
6n CO2 + 5n H2O (C6H10O5)n
(C6H10O5)n + n H2O n C6H12O6
C6H12O6 2C2H5OH + 2CO2
C2H5OH + O2 CH3COOH + H2O
CH3COOH + C2H5OH CH3COOC2H5 + H2O
Câu 8:
Hòa tan hoàn toàn 8,56 gam một muối clorua (muối Y) vào nước được 200 mL dung dịch Y. Lấy 50 mL dung dịch Y tác dụng với dung dịch AgNO3 dư thu được 5,74 gam muối kết tủa trắng.
a) Tìm công thức muối Y.
 Xem đáp án
Xem đáp án
a. Gọi công thức của muối là RCln
50 ml Y + AgNO3 dư → AgCl (5,74 gam)
→ 200 ml Y + AgNO3 dư → AgCl ( 22,96 gam)
→ nAgCl = 0,16 mol
Phương trình hóa học:
RCln + nAgNO3 → R(NO3)n + n AgCl↓
a (mol) an (mol)
Ta có: Ra + 35,5an = 8,56 mà an =0,16
→ Ra = 2,88 → R = 18n
Vậy n = 1 ; R = 18 thỏa mãn, muối là NH4Cl
Câu 9:
b) Từ muối Y viết các phương trình hóa học thực hiện sơ đồ sau (dung dịch viết tắt là dd)

 Xem đáp án
Xem đáp án
b) Các phương trình hóa học:
NH4Cl + NaOH NaCl + NH3 + H2O
2NaCl + 2H2O 2NaOH + H2 + Cl2
Cl2 + 2KOH → KCl + KClO + H2O
2H2O + 2Na → 2NaOH + H2
Câu 10:
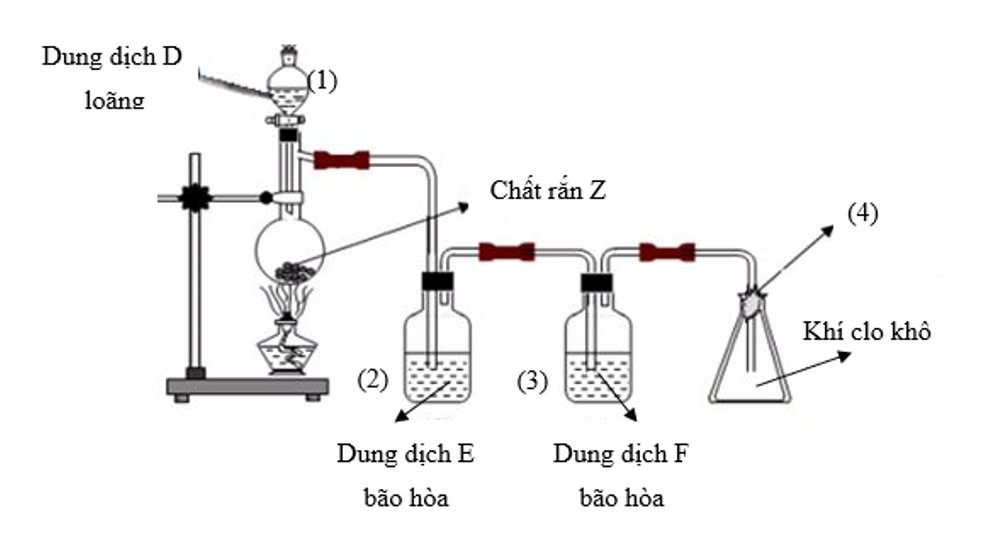
Cho sơ đồ thí nghiệm điều chế khí clo như sau:
a) Viết một phương trình hóa học điều chế khí clo trong phòng thí nghiệm.
 Xem đáp án
Xem đáp án
a) Một phương trình hóa học điều chế Cl2 trong phòng thí nghiệm:
MnO2 + 4HCl MnCl2 + Cl2 + 2H2O
Câu 11:
b) Chỉ ra chi tiết còn thiếu hoặc chưa chính xác ở vị trí (1), (2), (3), (4) trong sơ đồ trên, giải thích tại sao. Xác định các chất D, E, F, Z phù hợp với sơ đồ đúng.
 Xem đáp án
Xem đáp án
a) Ta có chi tiết còn thiếu hoặc chưa chính xác:
(1) dung dịch D đặc
(2) ống dẫn khí vào bình cắm sâu xuống dung dịch để loại bỏ được hết khí HCl
(3) dung dịch F đặc để hút nước, giúp làm khô khí clo
(4) cần có bông tẩm dung dịch NaOH vì khí clo là một khí độc, tránh clo bay ra ngoài môi trường gây ô nhiễm.
Như vậy:
D là HCl đặc; E là dung dịch NaCl bão hòa, F là H2SO4 đặc, Z là MnO2
Câu 12:
Hòa tan hoàn toàn 25,6 gam hỗn hợp D gồm MgO và Fe bằng dung dịch H2SO4 loãng, dư thu được dung dịch E và V lít (đktc) H2. Thêm từ từ dung dịch NaOH đến dư vào dung dịch E, kết thúc phản ứng lọc lấy kết tủa, nung trong không khí đến khối lượng không đổi thu được 28 gam chất rắn M.
Tính giá trị của V.
 Xem đáp án
Xem đáp án
MgO + H2SO4 → MgSO4 + H2O
Fe + H2SO4 → FeSO4 + H2↑
Dung dịch E: H2SO4 dư, MgSO4, FeSO4
H2SO4 dư + 2NaOH → Na2SO4 + 2H2O
MgSO4 + 2NaOH → Mg(OH)2↓ + Na2SO4
FeSO4 + 2NaOH → Fe(OH)2↓ + Na2SO4
Mg(OH)2 MgO + H2O
4Fe(OH)2 + O2 2Fe2O3 + 4H2O
Chất rắn M: MgO và Fe2O3
Ta có hệ phương trình:
Câu 13:
Chất dẻo PVC được dùng làm vật liệu cách điện, ống dẫn nước, vải che mưa, … do cách điện tốt, bền với axit, PVC có thể được điều chế theo sơ đồ sau:
CH4 → A→ B → PVC.
a) Viết các phương trình hóa học của phản ứng (dạng công thức cấu tạo thu gọn) theo sơ đồ trên.
 Xem đáp án
Xem đáp án
a) Các phương trình hóa học xảy ra theo sơ đồ:
(1) 2CH4 CH≡CH+ 3H2
(2) CH≡CH + HCl CH2=CHCl
(3) n CH2=CHCl 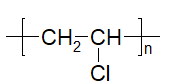
Câu 14:
b) Biết CH4 chiếm 90% thể tích khi thiên nhiên và hiệu suất tương ứng với mỗi giai đoạn lần lượt là 50%, 80%, 80%.
Tính số m3 (đktc) khí thiên nhiên cần để điều chế 1 tấn PVC.
 Xem đáp án
Xem đáp án
b/
nPVC = mol
Theo các pthh: mol
Vì hiệu suất tương ứng với mỗi giai đoạn lần lượt là 50%, 80%, 80%
Thể tích khí thiên nhiên cần dùng là 2 488 888,889 lit = 2488,888889 m3
Câu 15:
Chia hỗn hợp X gồm bột Cu và Fe3O4 (đã trộn đều) thành 2 phần bằng nhau và tiến hành các thí nghiệm sau:
+ Thí nghiệm 1: (được thực hiện trong, môi trường không có không khí)
Cho phần I vào dung dịch HCl loãng, dư thu được dung dịch Y và chất rắn không tan. Cô cạn dung dịch Y thu được 46,08 gam chất rắn Z. Nung chất rắn Z ở điều kiện thích hợp thu được 30,96 gam chất rắn T chỉ gồm các muối khan. Giả thiết hiệu suất cho các quá trình là 100%,
+ Thí nghiệm 2:
Hòa tan hoàn toàn phần 2 bằng dung dịch H2SO4 đặc, nóng dư thu được khi SO2 (sản phẩm khử duy nhất). Hấp thụ hết lượng SO2 này vào bình đựng dung dịch Ca(OH)2 dư, thấy khối lượng bình tăng 7,04 gam.
a) Viết các phương trình hóa học và tính phần trăm khối lượng Cu trong hỗn hợp X.
 Xem đáp án
Xem đáp án
a/
Phần 1:
(1) Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
x x 2x mol
(2) Cu + 2FeCl3 → CuCl2 + 2FeCl2
2x x 2x mol
Vì sau phản ứng (1,2) còn chất rắn không tan nên Cu còn dư sau phản ứng, FeCl3 hết
Dung dịch Y: FeCl2, CuCl2
Gọi số mol Fe3O4 ở mỗi phần là x mol
Theo PTHH (1,2) : mT = = 135x + 127.3x = 30,96
Vậy x = 0,06 mol
Phần 2:
(3) Cu + 2H2SO4 đặc CuSO4 + SO2 + 2H2O
(4) 2Fe3O4 + 10H2SO4 đặc 3Fe2(SO4)3 + SO2 + 10H2O
SO2 + Ca(OH)2 → CaSO3↓ + H2O
Khối lượng bình tăng = bị hấp thụ = 7,04 gam
Theo PTHH (4)
→ nCu = 0,08 mol
% mCu trong hỗn hợp X =
Câu 16:
b) Tìm công thức phân tử của các chất trong Z. Biết các chất trong Z đều có khối lượng mol phân tử nhỏ hơn 220 g/mol.
 Xem đáp án
Xem đáp án
b/ Gọi các muối trong Z có công thức lần lượt là: CuCl2.yH2O; FeCl2.zH2O (x,y €N*)
Ta có:
Vì mz = 46,08 gam
→ 30,96 + 1,08y + 3,24z = 46,08 → 1,08y + 3,24z = 15,12 (*)
Biết các chất trong Z đều có khối lượng mol phân tử nhỏ hơn 220 g/mol.
Thay giá trị của y, z vào * ta có bảng sau:
|
y |
1 |
2 |
3 |
4 |
|
z |
4,333 |
4 (Thỏa mãn) |
3,67 |
3,33 |
Vậy công thức muối cần tìm là: CuCl2.2H2O; FeCl2.4H2O
Câu 17:
COVID-19 là bệnh đường hô hấp cấp tính truyền nhiễm gây ra bởi chủng virut SARS-CoV 2. Tổ chức Y tế thế giới (WHO) đã tuyên bố dịch viêm phổi do virut Corona (chủng mới) là đại dịch toàn cầu. Một trong những biện pháp phòng ngứa nguy cơ lây nhiễm là thường xuyên rửa tay bằng dung dịch rửa tay khô. Tổ chức Y tế thế giới đã có hướng dẫn người dân tự pha chế nước rửa tay khô với lượng dùng là lít có công thức pha chế như sau: cồn (C2H5OH) 96o: 830 ml; oxi già (H2O2) 3%: 40 ml; chất X: 15 ml; tinh dầu: 5 ml; nước cất hoặc nước đun sôi để nguội 110 ml.
a) Tính phần trăm thể tích của C2H5OH trong dung dịch thu được sau khi pha trộn các nguyên liệu trên với nhau.
 Xem đáp án
Xem đáp án
a. Phần trăm thể tích của C2H5OH trong dung dịch thu được sau khi pha trộn (khi không có sự hao hụt thể tích sau khi pha trộn)
Câu 18:
b) Trong nước rửa tay khô, X có tác dụng giữ ẩm, dưỡng da. Biết X là ancol có công thức tổng quát CxHy(OH)n và 1 nguyên tử C trong X chỉ có thể liên kết tối đa 1 nhóm -OH. Cho m gam X vào bình chứa Na (dư), sau khi kết thúc phản ứng thấy có 3,36 lít (đktc) khí thoát ra và khối lượng bình tăng 8,9 gam so với ban đầu. Nếu đốt cháy hoàn toàn 0,1 mol X, khối lượng CO2 thu được không vượt quá 22,0 gam. Tìm công thức cấu tạo của X.
 Xem đáp án
Xem đáp án
b.
nkhí = 0,15 mol
2CxHy(OH)n + 2nNa → 2CxHy(ONa)n + n H2
0,15 mol
Khối lượng bình tăng 8,9 gam so với ban đầu =
Vậy mX = 9,2 gam =
Đốt cháy X : CxHy(OH)n xCO2
0,1 mol 0,1x (mol)
Ta có : → 44.0,1x ≤ 22 → x ≤ 5
Vì 1 nguyên tử C trong X chỉ có thể liên kết tối đa 1 nhóm –OH nên n ≤ 5.
Biện luận được n = 3; M = 92
X cần tìm là : C3H5(OH)3
Câu 19:
Khí SO2 được sinh ra do sự đốt cháy các nhiên liệu hóa thạch (than, dầu, khí đốt,...) là nguyên nhân quan trọng nhất gây ô nhiễm không khí. Tiêu chuẩn quốc tế quy định nếu trong không khí nồng độ SO2 vượt quá 30.10-6 mol/m3 thì coi như không khí bị ô nhiễm SO2. Khi tiến hình phân tích 50 lít không khí ở một thành phố thấy có chứa 0,08 mg SO3. Hãy cho biết thành phố đó có bị ô nhiễm SO2 hay không?
 Xem đáp án
Xem đáp án
Nồng độ mol/m3 SO2 của thành phố là:
Thành phố đó chưa bị ô nhiễm SO2
Câu 20:
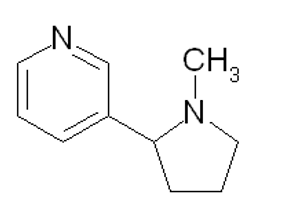
Nicotin là một chất tìm thấy trong các cây họ Cà (Solanaceae), chủ yếu trong cây thuốc lá (0,6 đến 3% trọng lượng cây thuốc lá khô). Nó là một chất độc thần kinh rất mạnh, có thể khiến giấc ngủ bị rối loạn, nhức đầu, chống mặt, có nguy cơ hạn chế dòng máu chảy lên não. Hình bên cho thấy công thức cấu tạo thu gọn của nicotin.
- Tính thành phần phần trăm về khối lượng của nitơ trong nicotin, biết nitơ có hóa trị III trong nicotin.
 Xem đáp án
Xem đáp án
CTPT của nicotin : C10H14N2
Thành phần phần trăm về khối lượng của nitơ trong nicotin:
Câu 21:
Dẫn 1 luồng hơi nước qua than nóng đỏ thì thu được hỗn hợp khí X gồm CO2, CO, H2, tỉ khối hơi của X so với CH4 là 0,975. Toàn bộ hỗn hợp khí X trên khử vừa đủ 27,6 gam hỗn hợp Y gồm CuO, Fe3O4 nung nóng thu được rắn Z chỉ có 2 kim loại, cho toàn bộ Z vào dung dịch HCl dư thấy có 3,36 lít H2 bay ra (đktc).
Xác định phần trăm thể tích của CO trong hỗn hợp X. Giả thiết các phản ứng xảy ra hoàn toàn.
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
Chất rắn Z: Cu, Fe
Fe + 2HCl → FeCl2 + H2
Gọi số mol của CuO, Fe3O4 trong hỗn hợp lần lượt là a , b (mol)
Bảo toàn Fe: nFe = nFe (Fe3O4) = 3b
Ta có:
Vì hỗn hợp khí X gồm CO2, CO, H2, tỉ khối hơi của X so với CH4 là 0,975
Nên MX = 44x + 28y + 2z = 15,6.(x + y + z)
Suy ra: 28,4x + 12,4y - 13,6z = 0 (I)
Ta có:
C + H2O CO + H2 (1)
y y mol
C + 2H2O CO2 + 2H2 (2)
x 2x mol
Bảo toàn O:
nO (CO pư) + nO (CuO, Fe3O4) = nO (CO2) + nO (H2O)
hay y + 0,2 + 0,05.4 = 2y + z
→ y + z = 0,4 (II)
Từ PTHH (1,2): 2x+ y = z (III)
Từ (I); (II); (III) giải hệ phương trình được x = y = 0,1 và z = 0,3 mol
%VCO =
