Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 13)
-
9403 lượt thi
-
20 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Hoàn thành các phương trình hóa học (ghi rõ điều kiện) trong sơ đồ chuyển hóa sau:
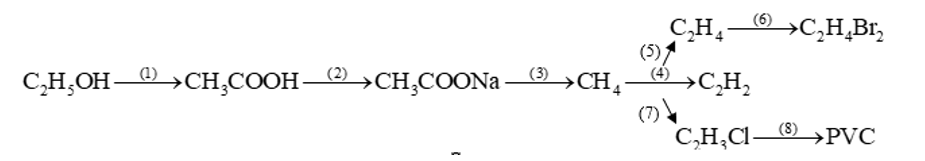
 Xem đáp án
Xem đáp án
Các phương trình hóa học minh họa sơ đồ :
(1) C2H5OH + O2 lên men→ CH3COOH + H2O
(2) CH3COOH + NaOH → CH3COONa + H2O
(3) CH3COONa + NaOH CaO→t0CH4↑ + Na2CO3
(4) 2CH4 15000C→làm lanh nhanh C2H2 + 3H2
(5) CH ≡ CH + H2 Pd/PbCO3→t0CH2 = CH2
(6) CH2 = CH2 + Br2 → CH2Br – CH2Br
(7) CH ≡ CH + HCl → CH2 = CHCl
(8) n CH2 = CHClt0,P,xt→(CH2- CHCl)n
Câu 2:
Nêu hiện tượng và viết phương trình phản ứng xảy ra trong các thí nghiệm sau:
a. Nhỏ từ từ đến dư dung dịch HCl vào dung dịch Na2CO3.
 Xem đáp án
Xem đáp án
a. Nhỏ từ từ đến dư dung dịch HCl vào dung dịch Na2CO3:
Hiện tượng: ban đầu không thấy hiện tượng, sau một thời gian thấy sủi bọt khí.
Phương trình hóa học:
HCl + Na2CO3 → NaHCO3 + NaCl
HCl + NaHCO3 → NaCl + H2O + CO2↑
Câu 3:
b. Nhỏ từ từ đến dư dung dịch NaOH vào dung dịch AlCl3.
 Xem đáp án
Xem đáp án
b. Nhỏ từ từ đến dư dung dịch NaOH vào dung dịch AlCl3:
Hiện tượng: xuất hiện kết tủa keo trắng, lượng kết tủa tăng dần, sau đó tan dần tạo dung dịch trong suốt không màu.
Phương trình hóa học:
3NaOH + AlCl3 → Al(OH)3↓ + 3NaCl
NaOH + Al(OH)3↓ → NaAlO2 + 2H2O
Câu 4:
c. Cho mẩu Zn dư vào dung dịch Fe2(SO4)3.
 Xem đáp án
Xem đáp án
c. Cho mẩu Zn dư vào dung dịch Fe2(SO4)3
Hiện tượng: dung dịch màu vàng chuyển dần thành trong suốt không màu, đồng thời có kim loại màu xám trắng bám lên thanh kẽm.
Phương trình hóa học:
Zn + Fe2(SO4)3 → ZnSO4 + 2FeSO4
Zn + FeSO4 → Fe↓ + ZnSO4
Câu 5:
d. Sục từ từ đến dư khí CO2 vào dung dịch Ca(OH)2.
 Xem đáp án
Xem đáp án
d. Sục từ từ đến dư khí CO2 vào dung dịch Ca(OH)2:
Hiện tượng: xuất hiện kết tủa trắng, lượng kết tủa tăng dần, sau đó tan hết và tạo dung dịch trong suốt không màu.
Phương trình hóa học:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
CO2 + CaCO3↓ + H2O → Ca(HCO3)2
Câu 6:
Hình vẽ bên mô tả cách điều chế và thu khí SO2 trong phòng thí nghiệm.
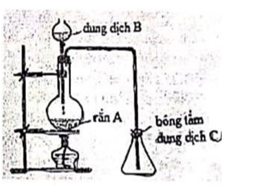
a. Xác định các chất A, B, C và viết phương trình phản ứng xảy ra giữa A và B.
 Xem đáp án
Xem đáp án
a. Ta có:
Chất A: Na2SO3
Chất B: H2SO4
Chất C: dd kiềm (NaOH, Ca(OH)2…)
Phương trình hóa học giữa A với B:
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2↑
Câu 7:
b. Giải thích cách thu khí SO2.
 Xem đáp án
Xem đáp án
b. dSO2/kk=6429>1
Khí SO2 nặng hơn không khí nên thu bằng cách đẩy không khí và để ngửa bình.
Câu 8:
c. Nêu vai trò của bông tẩm dung dịch C.
 Xem đáp án
Xem đáp án
c. Bông tẩm dung dịch kiềm có vai trò hấp thụ SO2 không để thoát ra ngoài.
Câu 9:
d. Cho 2 hóa chất là dung dịch H2SO4 đặc và CaO rắn, hóa chất nào được dùng để làm khô khí SO2? Giải thích.
 Xem đáp án
Xem đáp án
d. Dùng H2SO4 đặc để làm khô khí SO2 vì H2SO4 đặc hút nước và không tác dụng với khí SO2.
Câu 10:
Cho dung dịch CuSO4 có khối lượng riêng D = 1,206 gam/ml (dung dịch X). Cô cạn 414,59 ml X thu được tối đa 140,625 gam tinh thể CuSO4.5H2O. Tính nồng độ phần trăm và nồng độ mol của X.
 Xem đáp án
Xem đáp án
nCuSO4.5H2O=140,625160+5×18=0,5625(mol)
nCuSO4= 0,5625 (mol)⇒mCuSO4=0,5625×160=90(gam)
mdd X=1,206×414,59=500(gam)
C%CuSO4=90500×100%=18%
Câu 11:
Hòa tan hỗn hợp M gồm 0,4 mol Cu và 0,1 mol Fe3O4 trong 400 ml dung dịch HCl 2M. Sau phản ứng, thu được dung dịch A và chất rắn B. Cho A tác dụng với lượng dư dung dịch AgNO3 thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Tính m.
 Xem đáp án
Xem đáp án
Fe3O4+8HCl→FeCl2+2FeCl3+4H2O 0,1 0,8 → 0,1 0,2 mol
Cu+2FeCl3→CuCl2+2FeCl2Bd: 0,4 0,2Pu: 0,1 0,2 0,1 0,2Sau pu: 0,3 0,1 0,2
Câu 12:
Cho 4 hợp chất hữu cơ mạch hở X, Y, Z, T có công thức phân tử là C2H2, C4H8, C2H6O, C2H4O2 nhưng không theo thứ tự. X, Y, Z, T có các tính chất sau:
- X tác dụng được với Na và dung dịch NaOH.
- Y, T làm mất màu nước brom.
- Z tác dụng với Na nhưng không tác dụng với dung dịch NaOH.
- T tác dụng với dung dịch AgNO3 trong NH3 (Ag2O/NH3) thu được kết tủa màu vàng.
Biết Y có cấu tạo đối xứng. Xác định công thức cấu tạo của X, Y, Z, T và viết các phương trình phản ứng xảy ra.
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
- X tác dụng với Na và dung dịch NaOH nên X là axit C2H4O2 (CTCT: CH3COOH).
Phương trình hóa học minh họa :
2CH3COOH + 2Na → 2CH3COONa + H2
CH3COOH + NaOH → CH3COONa + H2O
- T làm mất màu nước brom và T tác dụng với dd AgNO3/NH3 thu được kết tủa màu vàng nên T là C2H2 (CTCT: CH ≡ CH); Phương trình hóa học:
CH ≡ CH + 2Br2 → CHBr2 – CHBr2
CH ≡ CH + 2AgNO3 + 2NH3 → CAg ≡ CAg ↓ + 2NH4NO3
Y làm mất màu nước brom; Y là anken C4H8 và Y có cấu tạo đối xứng nên CTCT của Y: CH3 – CH = CH – CH3; Phương trình hóa học:
CH3 – CH = CH – CH3 + Br2 → CH3 – CHBr – CHBr – CH3
- Z tác dụng với Na nhưng không tác dụng với dd NaOH nên Z là ancol C2H6O (CTCT: CH3CH2OH). Phương trình hóa học:
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2
Câu 13:
Hoàn thành các phương trình phản ứng theo sơ đồ sau (mỗi chữ cái trong ngoặc là một chất):
(A) → (B) + (C) + (D)
(C) + (E) → (G) + (H) + (I)
(A) + (E) → (K) + (G) + (I) + (H)
(K) + (H) → (L) + (I) + (M)
Biết: (D), (I), (M) là các đơn chất khí trong điều kiện thường; khí (I) có tỉ khối hơi so với khí SO2 là 1,1094; để trung hòa dung dịch chứa 2,24 gam (L) cần 200 ml dung dịch H2SO4 0,1M.
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
MI = 1,1094.64 = 71 → I là khí Cl2
Trung hòa dung dịch chứa 2,24 gam (L) cần dd chứa 0,02 mol H2SO4:
2X(OH)2+aH2SO4→X2+2aH2O 2,24(g) 0,02(mol)
⇒2(X+17a)2,24=a0,02
Vậy a = 1; X = 39 thỏa mãn.
Vậy X là K suy ra L là KOH
Phương trình hóa học minh họa sơ đồ :
2KMnO4 t0→K2MnO4 + MnO2 + O2
MnO2 + 4HCl(đ) t0→ MnCl2 + 2H2O + Cl2
2KMnO4 + 16HCl(đ) t0→ 2KCl + 2MnCl2 + 5Cl2 + 8H2O
2KCl + 2H2O dpdd→có mn 2KOH + Cl2 + H2
Câu 14:
Hỗn hợp khí X gồm hiđro, propen, propin. Nung X với xúc tác Ni đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Y. Chia Y thành 2 phần bằng nhau:
- Đốt cháy hoàn toàn phần 1 cần vừa đủ V lít khí O2 (đktc). Hấp thụ toàn bộ sản phẩm cháy bằng dung dịch nước vôi trong dư, dung dịch thu được có khối lượng giảm 16,2 gam so với khối lượng dung dịch nước vôi ban đầu.
- Dẫn phần 2 vào dung dịch Br2 dư thấy có 16 gam Br2 phản ứng.
Tính V.
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
X{H2C3H6C3H4Ni,t0→hY{C3H8C3H6: chia 2 phần bằng nhau
Phần 1: Y{C3H8(x)C3H6(y)+O2→{CO2H2O+Ca(OH)2du→ ∆mdd giảm = 16,2 (g)
BT[C]→nCO2= 3x + 3y =nCaCO3
BT[H]→nH2O= 4x + 3y
∆mdd giảm = mCaCO3−(mCO2+mH2O)
Hay 16,2 = 100(3x + 3y) – (44(3x + 3y) + 18(4x+3y))
Suy ra: 96x + 114y = 16,2 (1)
- Phần 2: Y{C3H8(x)C3H6(y) + dd: Br2 (0,1)
Suy ra: y = 0,1 (2)
Từ (1,2) có x = 0,05; y = 0,1
BT[O]→2nO2=2(3x+3y)+(4x+3y)=10x+9y=10×0,05+9×0,1=1,4
Vậy VO2=1,4×22,4=31,36(l)
Câu 15:
Hỗn hợp X gồm Al và một oxit sắt. Nung m gam X trong điều kiện không có không khí, thu được hỗn hợp chất rắn Y. Chia Y thành hai phần:
- Cho phần 1 vào lượng dư dung dịch NaOH, thu được 1,68 lít khí và 12,6 gam chất rắn.
- Cho phần 2 vào dung dịch H2SO4 đặc (nóng, dư), thu được 27,72 lít khí SO2 và dung dịch Z có chứa 263,25 gam muối sunfat.
Biết các phản ứng xảy ra hoàn toàn, các thể tích khí đo ở đktc.
a. Viết phương trình hóa học của các phản ứng xảy ra.
 Xem đáp án
Xem đáp án
a. Phương trình hóa học của các phản ứng xảy ra:
2yAl + 3FexOy t0→ 3xFe + yAl2O3
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2
Al2O3 + 2NaOH → 2NaAlO2 + H2O
2Al + 6H2SO4(đ) t0→ Al2(SO4)3 + 3SO2 + 6H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
2Fe + 6H2SO4(đ) t0→ Fe2(SO4)3 + 3SO2 + 6H2O
2FexOy + (2x+2y)H2SO4(đ) t0→ xFe2(SO4)3 + (2y-x)SO2 + (2x+2y)H2O
Câu 16:
b. Tính m và xác định công thức của oxit sắt.
 Xem đáp án
Xem đáp án
b.
Phần 1 NaOH→H2(0,075) + 12,6(g) chất rắn(Fe)
⇒Y|Al:0,05Al2O3Fe:0,225⇒nAl/YnFe/Y=29
2yAl+3FexOy→yAl2O3+3xFe 0,225
Phần 2 tác dụng với H2SO4 đặc dư cho |SO2:1,2375263,25g|Al2(SO4)3Fe2(SO4)3
BTe→3nAl/2+3nFe/2=2×1,2375 (1)
nAl/YnFe/Y=29⇒9nAl/2=2nFe/2 (2)
Từ (1,2) suy ra nAl/2 = 0,15; nFe/2 = 0,675 ⇒P2P1=3
263,25g|Fe2(SO4)3:0,6752×400=135(g)Al2(SO4)3:263,25−135=128,25(g)⇒nAl2(SO4)3=0,375(mol)
BT[Al]→|Al:0,15Al2O3:0,375×2−0,152=0,3
Vậy mY/P2=27×0,15+102×0,3+56×0,675=72,45(g)
m=mY/P1+mY/P2=13×72,45+72,45=96,6(g)
Ta có: nFenO=0,6750,3×3=34
Vậy oxit sắt là Fe3O4
Câu 17:
X là dung dịch HCl, Y là dung dịch NaOH. Cho 8,2 gam hỗn hợp G gồm Al, Fe vào cốc đựng 420 ml X. Sau phản ứng, thêm tiếp 800 gam Y vào cốc. Khuấy đều cho phản ứng xảy ra hoàn toàn, lọc kết tủa đem nung trong không khí đến khối lượng không đổi, thu được 6,55 gam chất rắn A.
Cho 120 ml X vào cốc chứa 200 gam Y thu được dung dịch Z chỉ chứa 1 chất tan. Cô cạn Z thu được 28,35 gam chất rắn T, cho toàn bộ T vào dung dịch AgNO3 dư thu được 43,05 gam kết tủa.
a. Tính nồng độ mol của X và nồng độ phần trăm của Y.
 Xem đáp án
Xem đáp án
a.
120 ml X (HCl) + 200 gam Y (NaOH) → dd Z: 1 chất tan (NaCl) →cô 28,35 gam chất rắn T (NaCl.nH2O) 43,05 gam kết tủa AgCl
= nNaCl = nHCl = nNaOH
Vậy ;
Câu 18:
b. Xác định công thức T.
 Xem đáp án
Xem đáp án
b.
Chất rắn T là NaCl.nH2O
mT = (58,5 + 18n). 0,3 = 28,35 suy ra n = 2
Vậy T là NaCl.2H2O
Câu 19:
c. Tính phần trăm khối lượng mỗi kim loại trong G.
 Xem đáp án
Xem đáp án
c.
6,55 gam chất rắn A
mA < mG vậy Al có 1 phần bị hòa tan
Bảo toàn nguyên tố Cl có: nNaCl = nHCl = 1,05 mol
Bảo toàn nguyên tố Na có:
Suy ra: A
Vậy %mAl = 65,85%; %mFe = 34,15%
Câu 20:
Hỗn hợp X gồm hai este no, mạch hở. Cho X tác dụng với dung dịch NaOH vừa đủ, thu được hỗn hợp Z gồm 2 ancol (số nguyên tử cacbon trong mỗi phân tử ancol không vượt quá 3) và 12,3 gam muối của một axit cacboxylic (muối Y). Đốt cháy hoàn toàn Y thu được 7,95 gam Na2CO3. Mặt khác, đốt cháy hoàn toàn Z thu được 3,36 lít khí CO2 (đktc) và 4,32 gam H2O. Tính phần trăm khối lượng của este có khối lượng phân tử lớn hơn trong X.
 Xem đáp án
Xem đáp án
X: 2 este no, mạch hở
Bảo toàn nguyên tố Na:
Suy ra vậy R = 15: CH3
Este no, hở nên ancol no, hở:
, vậy 1 ancol là CH3OH.
vậy X
Bảo toàn nguyên tố C có: a + nb = 0,15 (1)
Bảo toàn nguyên tố H có: 4a + 2nb + 2b = 0,48 (2)
Lại có: nmuối = a + xb = 0,15 (3)
Từ (1,3) suy ra n = x (số C = số nhóm OH)
Trường hợp 1:
n = x = 2 vậy a = 0,03; b = 0,06
Ta có X
Trường hợp 2: n = x = 3 vậy a = 0,06; b = 0,03
Ta có: X
