Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 28)
-
9449 lượt thi
-
13 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Viết một phương trình hóa học cho mỗi trường hợp sau (ghi rõ điều kiện phản ứng nếu có):
a. Phi kim tác dụng với oxit bazơ.
 Xem đáp án
Xem đáp án
a. Phi kim tác dụng với oxit bazơ.
Câu 2:
b. Phi kim tác dụng với dung dịch bazơ.
 Xem đáp án
Xem đáp án
b. Phi kim tác dụng với dung dịch bazơ.
Cl2 + 2NaOH → NaCl + NaClO + H2O
Câu 3:
c. Phi kim tác dụng với dung dịch muối.
 Xem đáp án
Xem đáp án
c. Phi kim tác dụng với dung dịch muối.
2Cl2 + FeCl2 → 2FeCl3
Câu 4:
d. Kim loại tác dụng với dung dịch bazơ.
 Xem đáp án
Xem đáp án
d. Kim loại tác dụng với dung dịch bazơ.
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Câu 5:
Cho 5 lọ mất nhãn, mỗi lọ chứa một trong các dung dịch sau: KCl, K2SO4, Ba(HCO3)2, KHCO3, K2CO3. Chỉ dùng thêm một hóa chất, hãy trình bày cách nhận biết các dung dịch trên và viết các phương trình hóa học xảy ra.
 Xem đáp án
Xem đáp án
Chọn NaHSO4 làm thuốc thử. Tiến hành nhận biết.
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Cho các mẫu thử tác dụng với NaHSO4.
+ Trường hợp nào vừa có kết tủa vừa có khí thoát ra là Ba(HCO3)2.
+ Trường hợp nào có khí không màu thoát ra là KHCO3; K2CO3 (nhóm 1)
+ Các trường hợp còn lại không hiện tượng là KCl và K2SO4 (nhóm 2)
- Cho dd Ba(HCO3)2 nhỏ vào các mẫu thử nhóm 1. Nếu có kết tủa trắng xuất hiện thì đó là K2CO3 và còn lại là KHCO3.
- Cho dd Ba(HCO3)2 nhỏ vào các dd mẫu thử nhóm 2. Nếu có kết tủa trắng xuất hiện thì đó là K2SO4 và còn lại là KCl.
Câu 6:
Viết các phương trình hóa học hoàn thành sơ đồ chuyển hóa sau (ghi rõ điều kiện phản ứng nếu có):
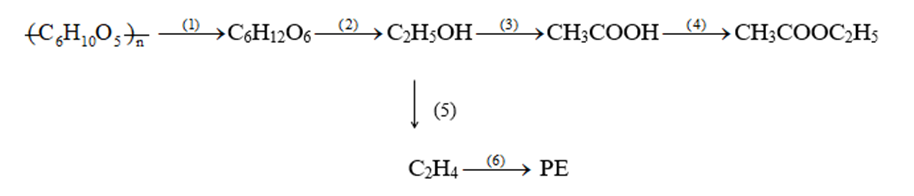
 Xem đáp án
Xem đáp án
Các phương trình hóa học minh họa cho sơ đồ:
Câu 7:
Viết các phương trình hóa học (ghi rõ điều kiện phản ứng nếu có) khi tiến hành các thí nghiệm sau:
- Thí nghiệm 1: Cho glucozơ tác dụng với dung dịch AgNO3 trong NH3, đun nóng.
- Thí nghiệm 2: Đưa bình đựng hỗn hợp khí C2H6 và Cl2 ra ngoài ánh sáng.
- Thí nghiệm 3: Sục khí etilen vào dung dịch Br2.
- Thí nghiệm 4: Đun nóng (C17H35COO)3C3H5 trong dung dịch NaOH.
 Xem đáp án
Xem đáp án
Các phương trình hóa học minh họa các thí nghiệm:
- Thí nghiệm 1:
- Thí nghiệm 2:
- Thí nghiệm 3:
- Thí nghiệm 4:
Câu 8:
Hòa tan hoàn toàn 31,8 gam một muối cacbonat của kim loại hóa trị I bằng lượng vừa đủ dung dịch HCl 7,3% (D = 1,038 g/mL). Hấp tụ toàn bộ khí CO2 thu được vào 500mL dung dịch KOH 1M thì thu được dung dịch có chứa 37,6 gam muối.
a. Xác định công thức hóa học của muối cacbonat và tính thể tích của dung dịch HCl đã dùng.
 Xem đáp án
Xem đáp án
a)Hấp thụ CO2 vào dd KOH có thể có các phản ứng:
Muối tạo ra có thể là KHCO3 hoặc K2CO3 hoặc cả KHCO3 và K2CO3
+ Nếu chỉ tạo KHCO3
nKOH phản ứng < nKOH ban đầu = 0,5 mol (Vô lý)
+ Nếu chỉ tạo muối K2CO3
nKOH phản ứng > nKOH ban đầu = 0,5 mol (Vô lý)
Vậy có cả 2 muối KHCO3 và K2CO3 được tạo ra, cả KOH và CO2 hết.
Gọi số mol của 2 muối KHCO3 và K2CO3 tương ứng là x, y mol (x,y > 0)
Theo (1), (2)
m muối =
Giải hệ phương trình được: x = 0,1; y = 0,2.
Bảo toàn nguyên tố C, có số mol CO2 = 0,1 + 0,2 = 0,3 mol
Đặt công thức muối là M2CO3.
Theo (3) nHCl = 2nCO2 = 0,3.2 = 0,6 mol.
Vdd HCl =
Câu 9:
b. Cho từ từ đến hết 200mL dung dịch HCl 2,5M vào 500mL dung dịch chứa 31,8 gam muối cacbonat trên. Tính thể tích khí thu được (ở điều kiện tiêu chuẩn).
 Xem đáp án
Xem đáp án
b. Theo (3)
Cho từ từ đến hết 0,5 mol HCl vào dd chứa 31,8 gam M2CO3:
Sau (4) HCl còn 0,2 mol, MHCO3 sinh ra 0,3 mol tiếp tục có phản ứng:
Vkhí = 0,2.22,4 = 4,48 lít (đktc)
Câu 10:
Một hỗn hợp X gồm các hidrocacbon mạch hở: C2H6, C3H6, C3H4. Đốt cháy hoàn toàn 14,2 gam X thu được 19,8 gam nước. Mặt khác, 13,44 lít hỗn hợp X ( ở điều kiện tiêu chuẩn) phản ứng tối đa với 576 mL dung dịch brom 10% (D = 1,25 g/mL). Tính phần trăm theo thể tích của mỗi chất có trong hỗn hợp X.
 Xem đáp án
Xem đáp án
Gọi số mol C2H6, C3H6, C3H4 lần lượt là x, y, z mol
Ta có: 30x + 42y + 40z = 14,2 (1)
Đốt cháy 14,2 gam X:
Bảo toàn nguyên tố H có:
nX tác dụng với dd brom (0,6 mol)
Khối lượng brom phản ứng:
vậy số mol brom phản ứng là 0,45 mol.
Coi như cho 14,2 gam X tác dụng với dd brom.
Vì cùng thành phần hỗn hợp ở 2 phần như nhau suy ra = const.
Hay
Suy ra:
Từ (1),(2),(3) có x = 0,2; y = 0,1; z = 0,1
= 100% -50% -25% = 25%
Câu 11:
Đốt cháy hoàn toàn 13,5 gam hợp chất hữu cơ X (chứa C, H,O) cần vừa đủ 10,08 lít khí O2 (ở điều kiện tiêu chuẩn), thu được hỗn hợp khí cacbonic và hơi nước có thỉ lệ số mol 1:1.
a. Lập công thức đơn giản nhất của X.
 Xem đáp án
Xem đáp án
a.
Gọi số mol H2O và CO2 đều là x mol.
Bảo toàn khối lượng:
Bảo toàn nguyên tố C:
Bảo toàn nguyên tố H:
Đặt công thức tổng quát của X là CxHyOz (x, y, z ∈ N)
Công thức đơn giản nhất của X là CH2O.
Câu 12:
b. Khi cho X tác dụng hết với kim loại Na hay muối NaHCO3 thì thu được số mol H2 hay số mol CO2 luôn bằng số mol X đã phản ứng.
b1. Tìm công thức phân tử của X thỏa mãn các điều kiện trên và có khối lượng mol phân tử nhỏ nhất.
b2. Viết các công thức cấu tạo có thể có của X. Viết các phương trình hóa học xảy ra.
 Xem đáp án
Xem đáp án
b)
b1.
X có công thức dạng (CH2O)n. X tác dụng với NaHCO3 tạo khí CO2 và có số mol bằng số mol X, suy ra X là axit có 1 nhóm -COOH.
Nếu X chỉ có 1 nhóm –COOH thì khi tác dụng với Na thì chỉ cho số mol khí H2 bằng 1/2 số mol X phản ứng. Vậy phân tử X phải có 1 nhóm –COOH và 1 nhóm –OH với số nguyên tử oxi trong các nhóm này là n ≥ 3.
Mặt khác do X có khối lượng mol nhỏ nhất nên chọn n = 3.
Vậy công thức phân tử của X là C3H6O3.
b2.
Các công thức cấu tạo có thể có của X là:
Các phương trình hóa học xảy ra:
Câu 13:
Hòa tan hoàn toàn m gam kim loại R trong dung dịch HCl dư, thu được dung dịch X và 4,48 lít khí H2 (ở điều kiện tiêu chuẩn). Cô cạn dung dịch X thu được 39,8 gam muối Y duy nhất. Nếu cho dung dịch X tác dụng với dung dịch KOH dư, lọc kết tủa đem nung ngoài không khí đến khối lượng không đổi thì thu được (m + 4,8) gam chất rắn Z. Hòa tan Z trong dung dịch H2SO4 loãng, vừa đủ thì thu được dung dịch T. Cô cạn dung dịch T thu được 56,2 gam muối U duy nhất. Xác định kim loại R, công thức hóa học của các muối Y và U.
 Xem đáp án
Xem đáp án
- Nếu B là muối khan:
Suy ra: MR = 64n (g/mol)
Với mọi n, không có trường hợp thỏa mãn. Vậy B là muối ngậm nước.
Đặt công thức muối ngậm nước là RCln.xH2O
Có:
Vậy MR + 35,5n + 18x = 99,5n
Hay MR = 64n – 18x (1)
Chất rắn D là oxit của R và giả sử D có công thức: R2Oy
Có sơ đồ phản ứng:
Bảo toàn nguyên tố R:
. Chọn y = 3; n = 2
Từ (1) có MR = 128 – 18x
Mà MR > 0 nên x < 7,1
Chỉ có x = 4, MR = 56 (thỏa mãn) vậy R là Fe
B là FeCl2.4H2O.
Bảo toàn nguyên tố Fe
G có dạng Fe2(SO4)3.qH2O
Vậy
Suy ra q = 9. Thỏa mãn
Vậy G là Fe2(SO4)3.9H2O
