Phản ứng trao đổi ion trong dung dịch
-
605 lượt thi
-
29 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Trả lời:
Dãy gồm các chất có thể cùng tồn tại trong 1 dung dịch là các chất không phản ứng được với nhau
A sai vì BaCl2 có thể tác dụng với Na2SO4; Na2CO3 có thể tác dụng với H2SO4
C sai vì Na2CO3 có thể tác dụng với BaCl2
D sai vì HCl có thể tác dụng với NaOH và Na2CO3
Đáp án cần chọn là: B
Câu 2:
 Xem đáp án
Xem đáp án
Trả lời:
Các ion có thể cùng tồn tại với nhau trong dung dịch thì không phản ứng với nhau
B sai vì: NH4+ + OH- → NH3 + H2O
C sai vì: 3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO + 2H2O
D sai vì Ba2+ + SO42- → BaSO4
Đáp án cần chọn là: A
Câu 3:
 Xem đáp án
Xem đáp án
Trả lời:
Dãy gồm các ion không thể cùng tồn tại trong một dung dịch là:
\[N{a^ + },{K^ + },HSO_4^ - ,O{H^ - }\]
Vì: HSO4- + OH- → SO42- + H2O
Đáp án cần chọn là: B
Câu 4:
(1) (NH4)2SO4 + BaCl2
(2) CuSO4 + Ba(NO3)2
(3) Na2SO4 + BaCl2
(4) H2SO4 + BaSO3
(5) (NH4)2SO4 + Ba(OH)2
(6) Fe2(SO4)3 + Ba(NO3)2
Các phản ứng đều có cùng phương trình ion rút gọn là
 Xem đáp án
Xem đáp án
Trả lời:
(1) SO42- + Ba2+ → BaSO4
(2) SO42- + Ba2+ → BaSO4
(3) SO42- + Ba2+ → BaSO4
(4) 2H+ + SO42- + BaSO3 → BaSO4 + SO2 + H2O
(5) 2NH4+ + SO42- + Ba2+ + OH- → BaSO4 + NH3 + H2O
(6) SO42- + Ba2+ → BaSO4
=>Các phản ứng có cùng phương trình ion rút gọn là: (1), (2), (3), (6).
Đáp án cần chọn là: A
Câu 5:
Ion \[CO_3^{2 - }\]cùng tồn tại với các ion sau trong một dung dịch:
 Xem đáp án
Xem đáp án
Trả lời:
Đáp án B:
![Ion \[CO_3^{2 - }\]cùng tồn tại với các ion sau trong một dung dịch:D. Fe3+, HSO4- (ảnh 1)](https://video.vietjack.com/upload2/images/1650081395/1650081571-image1.png)
![Ion \[CO_3^{2 - }\]cùng tồn tại với các ion sau trong một dung dịch:D. Fe3+, HSO4- (ảnh 2)](https://video.vietjack.com/upload2/images/1650081395/1650081571-image2.png)
Đáp án C:
![Ion \[CO_3^{2 - }\]cùng tồn tại với các ion sau trong một dung dịch:D. Fe3+, HSO4- (ảnh 3)](https://video.vietjack.com/upload2/images/1650081395/1650081571-image3.png)
![Ion \[CO_3^{2 - }\]cùng tồn tại với các ion sau trong một dung dịch:D. Fe3+, HSO4- (ảnh 4)](https://video.vietjack.com/upload2/images/1650081395/1650081571-image4.png)
![Ion \[CO_3^{2 - }\]cùng tồn tại với các ion sau trong một dung dịch:D. Fe3+, HSO4- (ảnh 5)](https://video.vietjack.com/upload2/images/1650081395/1650081571-image2.png)
Đáp án D:
![Ion \[CO_3^{2 - }\]cùng tồn tại với các ion sau trong một dung dịch:D. Fe3+, HSO4- (ảnh 6)](https://video.vietjack.com/upload2/images/1650081395/1650081571-image5.png)
![Ion \[CO_3^{2 - }\]cùng tồn tại với các ion sau trong một dung dịch:D. Fe3+, HSO4- (ảnh 7)](https://video.vietjack.com/upload2/images/1650081395/1650081571-image6.png)
Đáp án cần chọn là: A
Câu 6:
 Xem đáp án
Xem đáp án
Trả lời:
B. AgNO3 + H2O + 3NH3 → NH4NO3 + (Ag(NH3)2)OH
C. Na2ZnO2 + 2HCl → 2NaCl + Zn(OH)2
Nếu HCl dư : Zn(OH)2 + 2HCl → ZnCl2 + 2H2O
D. NaHCO3 + NaHSO4 → H2O + Na2SO4 + CO2
Đáp án cần chọn là: A
Câu 7:
 Xem đáp án
Xem đáp án
Trả lời:
Các chất phản ứng: HNO3, Na2SO4, Ca(OH)2, KHSO4
2HNO3 + Ba(HCO3)2 → Ba(NO3)2 + CO2 + H2O
Na2SO4 + Ba(HCO3)2 → BaSO4 + 2NaHCO3
Ca(OH)2 + Ba(HCO3)2 → CaCO3 + BaCO3 + H2O
2KHSO4 + Ba(HCO3)2 → K2SO4 + BaSO4 + CO2 + H2O
Đáp án cần chọn là: A
Câu 8:
1) NaHSO4 + NaHSO3
2) Na3PO4 + K2SO4
3) AgNO3 + Fe(NO3)2
4) C6H5ONa + H2O
5) CuS + HNO3
6) BaHPO4 + H3PO4
7) NH4Cl + NaNO2 (đun nóng)
8) Ca(HCO3)2 + NaOH
9) NaOH + Al(OH)3
10) MgSO4 + HCl.
Số phản ứng xảy ra là
 Xem đáp án
Xem đáp án
Trả lời:
Các phản ứng xảy ra: (1); (3); (7); (8); (9)
Đáp án cần chọn là: B
Câu 9:
 Xem đáp án
Xem đáp án
Trả lời:
Các phản ứng tạo kết tủa:
H2SO4 + BaCl2 → BaSO4↓ + 2 HCl
H2O + SO3 + BaCl2 → BaSO4↓ + 2 HCl
NaHSO4 + BaCl2 → BaSO4↓ + NaCl + HCl
Na2SO3 + BaCl2 → BaSO3↓ + 2 NaCl
K2SO4 + BaCl2 → BaSO4 ↓ + 2 KCl
Đáp án cần chọn là: D
Câu 10:
 Xem đáp án
Xem đáp án
Trả lời:
Phương trình ion đầy đủ:
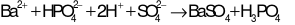
Phương trình ion thu gọn:
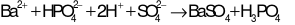
Đáp án cần chọn là: B
Câu 11:
 Xem đáp án
Xem đáp án
Trả lời:
A. KNO3 không phản ứng vì không thỏa mãn điều kiện của phản ứng trao đổi.
B. AgNO3 có phản ứng vì tạo kết tủa (AgCl).
C. NaOH có phản ứng vì tạo chất điện li yếu (H2O).
D. Na2CO3 có phản ứng vì tạo ra khí (CO2).
Đáp án cần chọn là: A
Câu 12:
 Xem đáp án
Xem đáp án
Trả lời:
Áp dụng định luật bảo toàn điện tích trong một dung dịch ta có:
n (+) = n (-)

=>x + 2y = z + t
Đáp án cần chọn là: D
Câu 13:
 Xem đáp án
Xem đáp án
Trả lời:
nHCl = 3.0,01 = 0,03 mol
PTHH: NaOH + HCl → NaCl + H2O
nNaOH = nHCl = 0,03 mol
=>V dd NaOH = n : CM = 0,03 : 0,3 = 0,1 lít = 100 ml
Đáp án cần chọn là: D
Câu 14:
 Xem đáp án
Xem đáp án
Trả lời:
Ta có: C + H2O → CO + H2 hoặc C + 2H2O → CO2 + 2H2
=>Sản phẩm đều là chất khí
Đáp án cần chọn là: D
Câu 15:
 Xem đáp án
Xem đáp án
Trả lời:
- Vì Zn(OH)2 và Al(OH)3 đều tan trong KOH nên loại A, B, D.
- Cu(OH)2 không tan trong KOH nên thỏa mãn đề bài
Đáp án cần chọn là: C
Câu 16:
(a) Cho dung dịch Ba(HCO3)2 vào dung dịch NaHSO4.
(b) Cho Na vào dung dịch FeCl2 dư.
(c) Cho dung dịch (NH4)2SO4 vào dung dịch Ba(OH)2.
(d) Sục khí CO2 dư vào dung dịch hỗn hợp NaOH và Ba(OH)2.
(e) Cho dung dịch AgNO3 vào dung dịch Fe(NO3)2.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được cả kết tủa và khí là
 Xem đáp án
Xem đáp án
Trả lời:
(a) Ba(HCO3)2 + 2NaHSO4 → BaSO4↓+ Na2SO4 + 2H2O + 2CO2 ↑
(b) 2Na + 2H2O → 2NaOH + H2↑
FeCl2 + 2NaOH → Fe(OH)2↓ + 2NaCl
(c) (NH4)2SO4 + Ba(OH)2 → BaSO4↓ + 2NH3↑ + 2H2O
(d) CO2 dư nên không thu được kết tủa.
(e) AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓
Vậy có 3 phản ứng vừa thu được khí và kết tủa là (a), (b), (c).
Đáp án cần chọn là: C
Câu 17:
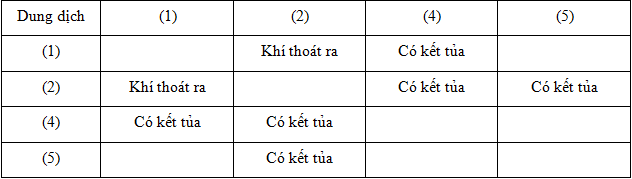
Các dung dịch (1), (3), (5) lần lượt là
 Xem đáp án
Xem đáp án
Trả lời:
(1) không phản ứng với (5) ⟹ B ; C ; D loại.
Chất (2) tạo kết tủa 2 lần + tạo khí 1 lần nên (2) là Na2CO3
Chất (1) tạo khí với chất (2) —>(1) là H2SO4
Chất (4) tạo kết tủa với (1) và (2) —>(4) là BaCl2
Chất (5) tạo kết tủa với (2) —>(5) là MgCl2
—>Còn lại (3) là NaOH
(1) không phản ứng với (5) ⟹ B ; C ; D loại.
Các dung dịch (1), (3), (5) lần lượt là H2SO4, NaOH, MgCl2.
Đáp án cần chọn là: A
Câu 18:
Hỗn hợp X gồm Na và Ba có tỉ lệ mol 1 : 1. Hòa tan một lượng X vào nước được 3,36 lít H2 (đktc) và dung dịch Y. Cho 4,48 lít CO2 hấp thụ hết vào dung dịch Y thì thu được m gam kết tủa. Giá trị của m là:
 Xem đáp án
Xem đáp án
Trả lời:
Đặt số mol mỗi kim loại là x (mol).
Na + H2O → NaOH + ½ H2
x → x → 0,5x
Ba + 2H2O → Ba(OH)2 + H2
x → x → x
=>nH2 = 0,5x + x = 0,15 =>x = 0,1 mol
=>nOH- = x + 2x = 0,3 mol
*Hấp thụ 0,2 mol CO2 vào {0,3 mol OH-; 0,1 mol Ba2+; Na+}:
Ta thấy: nOH- : nCO2 = 0,3 : 0,2 = 1,5
=>Phản ứng tạo CO32- (a mol) và HCO3- (b mol)
CO2 + 2OH- → CO32- + H2O
CO2 + OH- → HCO3-
+ nCO2 = nCO32- + nHCO3- =>a + b = 0,2 (1)
+ nOH- = 2nCO32- + nHCO3- =>2a + b = 0,3 (2)
Giải hệ (1) và (2) được a = b = 0,1
Ta thấy: nBa2+ (0,1 mol) = nCO32- (0,1 mol) =>nBaCO3 = 0,1 mol
=>mBaCO3 = 0,1.197 = 19,7g
Đáp án cần chọn là: C
Câu 19:
 Xem đáp án
Xem đáp án
Trả lời:
Ta có: nBa(OH)2 = 0,125 mol → Ba2+: 0,125 mol và OH-: 0,25 mol
Dung dịch còn lại có Fe3+: 0,024 mol; Al3+: 0,032 mol; SO42-: 0,088 mol; Cl-: 0,072 mol và H+: 0,08 mol
Khi nhỏ từ từ Ba(OH)2 vào thì
OH- + H+ → H2O
0,08 ← 0,08
Fe3+ + 3OH- → Fe(OH)3
0,024 → 0,072 → 0,072
Al3+ + 3OH- → Al(OH)3
0,032 → 0,096 → 0,032
→ nOH- dư = 0,25 - 0,08 - 0,072 - 0,096 = 0,002 mol → Al(OH)3 hòa tan một phần
OH- + Al(OH)3 → AlO2- + 2H2O
0,002 → 0,002 mol
Ba2+ + SO42- → BaSO4
0,088 ← 0,088 → 0,088
→ Kết tủa tạo ra có 0,024 mol Fe(OH)3; 0,03 mol Al(OH)3 và 0,088 mol BaSO4
→ m = 25,412 gam
Đáp án cần chọn là: C
Câu 20:
 Xem đáp án
Xem đáp án
Trả lời:
Đặt số mol Al là x mol; số mol Mg là y mol
Ta có: nHCl = 0,52 mol; nH2SO4 = 0,14 mol
Dung dịch X chứa {Al3+ (x mol); Mg2+ (y mol); H+ dư (0,8-3x-2y mol); Cl-, SO42-}
*Khi cho 0,85 mol NaOH vào dung dịch X: Đặt nAl(OH)3 (4)= z mol
Ta thấy:
+) nH+ dư + 3nAl3+ + 2nMg2+ = (0,8-3x-2y) + 3x + 2y = 0,8 mol
+) nOH- = 0,85 mol
=>nOH- >nH+ dư + 3nAl3+ + 2nMg2+ =>OH- dư, đã có sự hòa tan Al(OH)3
OH- + H+ → H2O (1)
(0,8-3x-2y) (0,8-3x-2y) mol
3OH- + Al3+ → Al(OH)3 ↓ (2)
3x ← x x mol
2OH-+ Mg2+ → Mg(OH)2 (3)
2y ← y y mol
Al(OH)3 + OH- → Al(OH)3 (4)
z → z mol
Kết tủa thu được sau phản ứng có y mol Mg(OH)2 và (x-z) mol Al(OH)3
Ta có hệ:
(1) m hh = 27x + 24y = 7,65
(2) m kết tủa = 58y + 78(x - z) = 16,5
(3) nOH-= 0,8 - 3x - 2y + 3x + 2y + z = 0,85 mol
Giải hệ trên ta có: x = 0,15; y =0,15 và z = 0,05 mol
Vậy dung dịch X có chứa 0,05 mol H+, 0,15 mol Al3+, 0,15 mol Mg2+, 0,14 mol SO42-, 0,52 mol Cl-
Đặt thể tích dung dịch chứa KOH, Ba(OH)2 là a lít
*Khi cho dung dịch chứa 0,8a mol KOH, 0,1a mol Ba(OH)2 vào dung dịch X để thu được lượng kết tủa lớn nhất:
- Trường hợp 1: Kết tủa là Al(OH)3 cực đại, Mg(OH)2, BaSO4
OH- + H+ → H2O (5)
3OH-+ Al3+ → Al(OH)3 ↓ (6)
2OH-+ Mg2+ → Mg(OH)2 ↓ (7)
→ nOH-= 0,05 + 3.0,15 + 2.0,15 = 0,8 mol
→ 0,8a + 2.0,1a = 0,8 mol → a = 0,8 lít → nBa(OH)2 = 0,1a = 0,08 mol
Ba2+ + SO42- → BaSO4↓
0,08 0,14 0,08 mol
→ mkết tủa = mBaSO4 + mAl(OH)3 + mMg(OH)2 = 0,08.233 + 0,15.78 + 0,15.58 = 39,04 gam
Khi nung kết tủa đến khối lượng không đổi thu được: BaSO4, Al2O3 và MgO
→ mchất rắn = mAl2O3 + mMgO + mBaSO4
= 0,075.102 + 0,15.40 + 0,08.233 = 32,29 gam
Trường hợp 2: Kết tủa là BaSO4 cực đại, Mg(OH)2
→ nBa2+ max = nSO4(2-) = 0,14 mol → 0,1a = 0,14 → a =1,4
→ nOH- = 0,8a + 2.0,1a = a =1,4 mol
Khi đó Al(OH)3 tan hết.
Kết tủa thu được có 0,14 mol BaSO4 và 0,15 mol Mg(OH)2
→ mkết tủa = 0,14.233 + 0,15.58 = 41,32 gam >39,04 gam
Do đó ta chọn trường hợp 2 sẽ cho khối lượng kết tủa cực đại
Khi đó: mchất rắn = mBaSO4 + mMgO = 0,14.233 + 0,15.40 = 38,62 gam
Vậy giá trị của m gần nhất với giá trị 38,6
Đáp án cần chọn là: B
Câu 21:
 Xem đáp án
Xem đáp án
Trả lời:
Xét X: Theo ĐLBTĐT ta có: 0,25.2 + 1,3 = a + b = 1,8 mol
Xét Y:
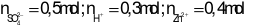
Khi cho X + Y
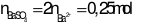
Sau khi nung thu được H. ta có:


Trường hợp 1: Tạo kết tủa và kết tủa không tan =>OH- hết

Trường hợp 2: Kết tủa tan một phần
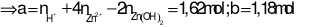
Đáp án cần chọn là: D
Câu 22:
 Xem đáp án
Xem đáp án
Trả lời:
nNaOH = 0,2 mol ; nBa(OH)2 = 0,05 mol; nOH- = 0,3 mol
nAl2(SO4)3 = 0,04 mol; nH2SO4 = 0,1.x mol; nH+ = 0,2x mol
H+ + OH- → H2O
0,2x 0,2x mol
Ba2+ + SO42- → BaSO4
0,05 0,12 0,05
Suy ra nAl(OH)3 = 0,06 mol < nAl3+
nên có 2 trường hợp xảy ra:TH1: Kết tủa không bị hòa tan
Al3+ + 3OH- → Al(OH)3
0,08 0,18← 0,06 mol
nOH- tổng = 0,22x + 0,18 = 0,3 suy ra x = 0,6M
TH2: Kết tủa bị hòa tan 1 phần
Al3+ + 3OH- → Al(OH)3
0,08 0,24 0,08
Al(OH)3 + OH- → AlO2- + 2H2O
0,02 0,02
nOH- tổng = 0,2x + 0,24 + 0,02 = 0,3 suy ra x = 0,2 M
Đáp án cần chọn là: B
Câu 23:
 Xem đáp án
Xem đáp án
Trả lời:
Mg2+ + CO32- → MgCO3
Ba2+ + CO32- → BaCO3
Ca2+ + CO32- → CaCO3
Ta có: nMg2+ + nBa2+ + nCa2+ = nCO3 2- = nNa2CO3= 0,25 mol
Áp dụng định luật bảo toàn điện tích với dung dịch X ta có:
2. (nMg2+ + nBa2+ + nCa2+)= nCl- + nNO3-
→ nCl- + nNO3- = 0,5 mol
Đáp án cần chọn là: D
Câu 24:
 Xem đáp án
Xem đáp án
Trả lời:
*Cho 200 ml X tác dụng với BaCl2 dư: nBaSO4 = 0,06 mol
Ba2+ + SO42-→ BaSO4
0,06 ← 0,06
*200 ml X tác dụng với Ba(OH)2 dư:
Ba2+ + SO42-→ BaSO4
Fe2+ + 2OH- → Fe(OH)2
→ mkết tủa = mBaSO4 + mFe(OH)2 → 0,06.233 + mFe(OH)2 = 21,18 → mFe(OH)2 = 7,2 gam
→ nFe(OH)2 = 0,08 mol → nFe2+ = 0,08 mol
Vì số mol Fe2+ và số mol SO42- khác nhau nên muối ban đầu cho vào X không có FeSO4
→ 2 muối là FeCl2 và Al2(SO4)3
→ nCl-= 2nFe2+ = 2.0,08 = 0,16 mol → [Cl-] = 0,16 : 0,2 = 0,8M
Đáp án cần chọn là: D
Câu 25:
Cho hỗn hợp X gồm x mol FeS2 và 0,025 mol Cu2S tác dụng vừa đủ với HNO3 loãng, đun nóng thu được dung dịch chỉ chứa muối sunfat của các kim loại và giải phóng khí NO duy nhất. Giá trị của x là
 Xem đáp án
Xem đáp án
Trả lời:
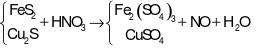
- Bảo toàn nguyên tố S ta có:
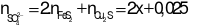
→ dung dịch sau phản ứng chứa: Fe3+: x mol; Cu2+: 0,05; SO42-: (2x + 0,025) mol
- Áp dụng định luật bảo toàn điện tích: 3x + 2.0,05 = 2.(2x + 0,025) → x = 0,05
Đáp án cần chọn là: C
Câu 26:
Phần 1: Hòa tan hoàn toàn bằng dung dịch HCl dư thu được 1,792 lít H2 (đktc).
Phần 2: Nung trong không khí dư, thu được 2,84 gam hỗn hợp rắn chỉ gồm các oxit.
Khối lượng hỗn hợp X là:
 Xem đáp án
Xem đáp án
Trả lời:
Nhận xét: Tổng số mol điện tích ion dương (của 2 kim loại) ở 2 phần là bằng nhau. Suy ra, tổng số mol điện tích ion âm ở 2 phần cũng bằng nhau.
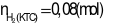

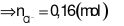
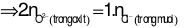
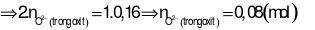
Áp dụng định luật bảo toàn khối lượng cho phản ứng ở phần 2:
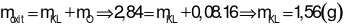
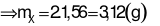
Đáp án cần chọn là: D
Câu 27:
 Xem đáp án
Xem đáp án
Trả lời:
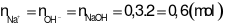
Dung dịch Y chứa Mg2+, Fe2+, H+ dư (nếu có), Cl-. Khi cho Y tác dụng với dung dịch NaOH vừa đủ thì dung dịch thu được sau phản ứng chỉ còn lại Na+ và Cl-.
Áp dụng định luật bảo toàn điện tích cho dung dịch này ta có:

=>VHCl = n : CM = 0,6 : 3 = 0,2(l)
Đáp án cần chọn là: A
Câu 28:
 Xem đáp án
Xem đáp án
Trả lời:
- Tính số mol Ba2+
BTDT: 
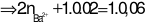
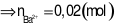
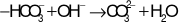

- 
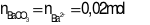
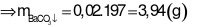
Đáp án cần chọn là: A
Câu 29:
 Xem đáp án
Xem đáp án
Trả lời:
- Khối lượng dung dịch giảm đi chính là khối lượng chất kết tủa và chất khí bay lên
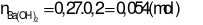
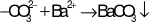
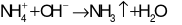
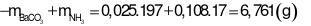
Đáp án cần chọn là: C
