Độ tan và tinh thể hiđrat
-
492 lượt thi
-
18 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Độ tan của NaNO3là:
\[S = \frac{{C{\rm{\% }}}}{{100 - C{\rm{\% }}}}.100 = \frac{{44,44}}{{100 - 44,44}}.100 = 80(g)\]
Đáp án cần chọn là: B
Câu 2:
 Xem đáp án
Xem đáp án
Bước 1: Tính mNaNO3và mH2Otrong 642gam dd bão hòa NaNO3
- Theo đề: SNaNO3(50oC) = 114 gam, ta có:
Cứ 214 gam dung dịch bão hòa NaNO3thì có 114 gam NaNO3và 100 gam H2O
Vậy 642 gam dung dịch bão hòa NaNO3thì có a gam NaNO3và b gam H2O
→ a = mNaNO3 = 114.642/214 = 342 gam
b = mH2O = 642 – 342 = 300 gam (không đổi)
Bước 2: Tính mNaNO3trong 300 gam H2O
- Ở 200C: SNaNO3(20oC) = 88 gam, ta có:
Cứ 100 gam nước hòa tan tối đa 88 gam NaNO3
Vậy 300 gam nước hòa tan tối đa 88.300/100 = 264 gam NaNO3
Bước 3: Tính mNaNO3tách ra khỏi dung dịch
- mNaNO3 kết tinh = mNaNO3(500C) - mNaNO3(200C)
mNaNO3 kết tinh = 342 – 264 = 78 gam.
Đáp án cần chọn là: C
Câu 3:
 Xem đáp án
Xem đáp án
Bước 1: Tính mNaNO3và mH2Otrong 642gam dd bão hòa NaNO3
- Theo đề: SNaNO3(50oC) = 114 gam, ta có:
Cứ 214 gam dung dịch bão hòa NaNO3thì có 114 gam NaNO3và 100 gam H2O
Vậy 642 gam dung dịch bão hòa NaNO3thì có x gam NaNO3và y gam H2O
→ x = mNaNO3 = 114.642/214 = 342 gam
y = mH2O = 642 – 342 = 300 gam (không đổi)
Bước 2: Tính mNaNO3trong 300 gam H2O
- Ở 200C: SNaNO3(20oC) = 88 gam, ta có:
Cứ 100 gam nước hòa tan tối đa 88 gam NaNO3
Vậy 300 gam nước hòa tan tối đa 88.300/100 = 264 gam NaNO3
Bước 3: Tính mNaNO3tách ra khỏi dung dịch.
- mNaNO3 kết tinh = mNaNO3(500C) - mNaNO3(200C) = 342 – 264 = 78 gam.
Đáp án cần chọn là: C
Câu 4:
 Xem đáp án
Xem đáp án
Bước 1: Tính mdd H2SO4
- nFeO = 7,2/ 72 = 0,1 mol
FeO + H2SO4→ FeSO4+ H2O
0,1 0,1 0,1 0,1 (mol)
- mH2SO4= 0,1.98 = 9,8 gam
→ mdd H2SO4=\[\frac{{9,8.100}}{{24,5}}\] = 40 (gam)
Bước 2: Tính số mol FeSO4.7H2O kết tinh
- Gọi x là số mol FeSO4.7H2O kết tinh
→ mFeSO4 còn lại= mFeSO4 ban đầu- mFeSO4 tách ra
= 0,1.152 - 152x = 15,2 - 152x (gam)
mdd sau= mFeO+ mdd H2SO4 ban đầu- mFeSO4.7H2O kết tinh
= 7,2 + 40 - 278x = 47,2 - 278x (gam)
- Ta có nồng độ % của dung dịch còn lại là:
\[C{\rm{\% }} = \frac{{{m_{ct}}}}{{{m_{{\rm{dd}}}}}} \times 100{\rm{\% }}\]
\[ \to \frac{{15,2 - 152x}}{{47,2 - 278x}}.100{\rm{\% }} = 12,18{\rm{\% }}\]
→ x = 0,08 mol
Bước 3: Tính m chất rắn FeSO4.7H2O.
mFeSO4.7H2O= 0,08.278 = 22,24 gam.
Đáp án cần chọn là: A
Câu 5:
 Xem đáp án
Xem đáp án
Bước 1: Tính mH2Ovà mMgSO4để tạo thành 1642 gam dd bão hòa.
- Ở 800C, SMgSO4= 64,2 gam
- Nghĩa là:100 gam H2O hòa tan 64,2 gam MgSO4 tạo thành 164,2 gam dung dịch bão hòa
a gam H2O hòa tan b gam MgSO4tạo thành 1642 gam dung dịch bão hòa
→ a = 1642.100/164,2 = 1000 gam; b = 64,2.1642/164,2 = 642 gam
- Gọi x là số mol MgSO4.6H2O tách ra → Số mol H2O tách ra là 6x mol
⟹ Khối lượng H2O tách ra: 108x (g)
Khối lượng MgSO4tách ra: 120x (gam)
Bước 3: Tính khối lượng tinh thể MgSO4.6H2O kết tinh
- Ở 200C, SMgSO4= 44,5 gam
- Ta có phương trình: \[\frac{{642 - 120x}}{{1000 - 108x}} = \frac{{44,5}}{{100}}\]
Giải ra x = 2,7386 mol
- Khối lượng MgSO4.6H2O kết tinh: 228.2,7386 = 624,4 gam.
Đáp án cần chọn là: D
Câu 6:
Để xác định hàm lượng FeCO3trong quặng xiđerit, người ta làm như sau: Cân 0,6 gam mẫu quặng, chế hóa nó theo một quy trình hợp lí, thu được FeSO4trong môi trường H2SO4loãng. Chuẩn độ dung dịch thu được bằng dung dịch chuẩn KMnO40,025M thì dùng vừa hết 25,2 ml. Phần trăm theo khối lượng của FeCO3là
 Xem đáp án
Xem đáp án
Bước 1: Tính nKMnO4
\[{n_{KMn{O_4}}} = 0,025 \times {25,2.10^{ - 3}} = {6,3.10^{ - 4}}\left( {mol} \right)\]
Bước 2: Tính nFeSO4
- Phản ứng chuẩn độ:
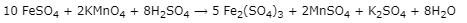
Theo PTHH:
\[nFeSO4 = 5nKMnO4 = 5 \times 6,3.10 - 4 = 3,15.10 - 3(mol)nFeSO4 = 5nKMnO4 = 5 \times 6,3.10 - 4 = 3,15.10 - 3\left( {mol} \right)\]
Bước 3: Tính %mFeCO3
- Bảo toàn nguyên tố Fe:\[{n_{F{\rm{e}}C{{\rm{O}}_3}}} = {n_{F{\rm{eS}}{{\rm{O}}_4}}} = {3,15.10^{ - 3}}\left( {mol} \right)\]
=>\[{m_{F{\rm{e}}C{{\rm{O}}_3}}} = {3,15.10^{ - 3}} \times 116 = 0,3654\left( g \right)\]
\[ \Rightarrow {\rm{\% }}{m_{F{\rm{e}}C{{\rm{O}}_3}}} = \frac{{0,3654}}{{0,6}}.100{\rm{\% }} = 60,9{\rm{\% }}\]
Đáp án cần chọn là: C
Câu 7:
FeSO4.7H2O + (NH4)2SO4→ FeSO4.(NH4)2SO4.6H2O + H2O
Cho độ tan của muối Mohr ở 200C là 26,9 g/100 g H2O và ở 800C là 73,0 g/100g H2O. Tính khối lượng của muối sắt(II) sunfat ngậm 7 nước cần thiết để tạo thành dung dịch muối Mohr bão hòa 800C, sau khi làm nguội dung dịch này xuống 200C để thu được 100 gam muối Mohr tinh thể và dung dịch bão hòa. Giả thiết trong quá trình kết tinh nước bay hơi không đáng kể.
 Xem đáp án
Xem đáp án
Bước 1:Tính m muối Mohr còn lạivà m dung dịch còn lại
- Đặt x là số mol muối Mohr có trong dung dịch bão hòa ở 800C
→ mmuối Mohr= mFeSO4.(NH4)2SO4.6H2O= 392x (g)
Ở 800C cứ 73 gam muối Mohr tan được trong 100 gam nước để tạo thành 173 gam dd bão hòa
→ 392x gam muối Mohr tan được trong 100 gam nước để tạo thành 928,9863x gam dd bão hòa
- Khi làm nguội dung dịch từ 800C xuống 200C thì tách ra 100 gam muối Mohr tinh thể
→ Khối lượng muối Mohr còn lại trong dung dịch = 392x - 100 (g)
→ Khối lượng dung dịch còn lại = 928,9863x - 100 (g)
Bước 2: Tính x mol muối Mohr
- Ta có:
Ở 200C cứ 26,9 gam muối Mohr tan trong 100 gam nước tạo thành 126,9 gam dd bão hòa
→ 392x - 100 gam muối Mohr tan trong 100 gam nước tạo thành 928,9863x - 100 gam dd bão hòa
→ 26,9.(928,9863x - 100) = 126,9.(392x - 100)
→ x = 0,404 (mol)
→ mmuối Mohr= 0,404 × 392 = 158,368 (g)
Bước 3: Tính m muối FeSO4.7H2O
- \[{m_{F{\rm{eS}}{{\rm{O}}_4}.7{H_2}O}} = 0,404 \times 278 = 112,312\left( g \right)\]
Đáp án cần chọn là: D
Câu 8:
 Xem đáp án
Xem đáp án
Bước 1: Tính số mol mỗi muối
- Đặt nFe(NO3)2= a mol; nAgNO3= b mol
⟹ mhỗn hợp= 180a + 170b = 70 (1)
- PTHH: 2Fe(NO3)2→ Fe2O3+ 4NO2+ 0,5O2
a → 0,5a
AgNO3→ Ag + NO2+ 0,5O2
b → b
- Chất rắn X gồm Fe2O3(0,5a mol) và Ag (b mol).
+ Khi cho chất rắn X phản ứng với HNO3:
+ PTHH: Fe2O3+ 6HNO3→ 2Fe(NO3)3+ 3H2O
0,5a → 3a
Ag + 2HNO3→ AgNO3+ NO2+ H2O
b → 2b
⟹ nHNO3= 3a + 2b = 1 (2)
Từ (1) và (2) ⟹ a = b = 0,2 mol
Bước 2: Tính khối lượng Fe(NO3)2
Theo PTHH, nFe(NO3)2= 0,2 mol ⟹ mFe(NO3)2= 36 gam.
Đáp án cần chọn là: C
Câu 9:
 Xem đáp án
Xem đáp án
Bước 1: Tính mFeSO4và mdd FeSO4
- nFeSO4.7H2O= 166,8/278 = 0,6 mol = nFeSO4
- mFeSO4= 0,6.152 = 91,2 gam
- Khi cho muối ngậm nước vào 300 gam H2O thì ta có:
mH2O= 300 + 0,6.7.18 = 375,6 gam
Bước 2: Tính độ tan
- Theo đề bài, 375,6 gam H2O hòa tan 91,2 gam FeSO4
⟹ 100 gam H2O hòa tan 24,28 gam FeSO4
Vậy độ tan của FeSO4ở 25oC là 24,28 gam.
Đáp án cần chọn là: B
Câu 10:
 Xem đáp án
Xem đáp án
Bước 1: Tính nZn(NO3)2
Giả sử nZn(NO3)2= a mol
Ta có: Zn(NO3)2→ ZnO + 2NO2+ 0,5O2
a → 2a 0,5a
Ta có: mchất rắn giảm= mNO2+ mO2
⟹ 46.2a + 0,5a.32 = 27
⟹ a = 0,25 mol
⟹ nNO2= 0,5 mol; nO2= 0,125 mol
Bước 2:Tính giá trị pH.
2NO2+ 0,5O2+ H2O → 2HNO3
0,5 0,125 → 0,5
⟹ CM HNO3= n : V = 0,5 : 4 = 0,125 (M)
⟹ [H+] = 0,125 M (do HNO3là chất dễ tan và điện li mạnh)
⟹ pH = -log(0,125) = 0,9.
Đáp án cần chọn là: D
Câu 11:
Cho 0,25 mol MgO tan hoàn toàn trong một lượng vừa đủ dung dịch H2SO425% đun nóng, sau đó làm nguội dung dịch đến 10oC. Tính khối lượng tinh thể MgSO4.7H2O đã tách ra khỏi dung dịch, biết rằng độ tan của MgSO4ở 100C là 28,2 gam.
 Xem đáp án
Xem đáp án
Bước 1: Tính mH2SO4 và mH2Osau phản ứng
PTHH: MgO + H2SO4→ MgSO4+ H2O
0,25 → 0,25 0,25 0,25 mol
mH2SO4= 0,25.98 = 24,5 gam
→ Khối lượng nước sau phản ứng: \[{m_{H2O}} = \frac{{75}}{{25}}.24,5 + 0,25.18 = 78gam\]
Bước 2: Tính mMgSO4 còn lại và mH2O còn lại
- Gọi x là số mol MgSO4.7H2O kết tinh
→ mMgSO4 còn lại= mMgSO4 ban đầu- mMgSO4 tách ra= 0,25.120 - 120x = 30 - 120x (gam)
mH2O còn lại= mH2O ban đầu- mH2O tách ra= 78 - 7x.18 = 78 - 126x (gam)
Bước 3: Tính mMgSO4.7H2O
- Ta có phương trình độ tan của MgSO4ở 100C là:
\[S = \frac{{30 - 120x}}{{78 - 126x}} \times 100 = 28,2\] → x = 0,09476 mol
→ mMgSO4.7H2O= 0,09476.246 = 23,31 gam.
Đáp án cần chọn là: B
Câu 12:
 Xem đáp án
Xem đáp án
Bước 1:Tính khối lượng chất tan CuSO4 trong 35,8 gam dd CuSO4bão hòa ở 100oC
- Ở 100oC, độ tan của CuSO4là 75,4 gam
0 Tức trong 175,4 gam dung dịch bão hòa có 75,4 gam CuSO4và 100 gam H2O
⟹ 35,8 gam ⟶ 15,4 gam CuSO4
Gọi x là số mol CuSO4.5H2O kết tinh
Bước 2:Tính khối lượng tinh thể CuSO4.5H2O
- Ở 20oC, độ tan của CuSO4là 20,26 gam
- Tức trong 120,26 gam dung dịch bão hòa có 20,26 gam CuSO4và 100 gam H2O
Theo đề: (35,8 - 17,86 - 250x) gam (15,4 - 160x) gam
⟹ 120,26.(15,4 - 160x) = 20,26.(35,8 - 17,86 - 250x)
⟹ x = 0,105
⟹ mCuSO4.5H2O= 0,105.250 = 26,25 gam.
Đáp án cần chọn là: A
Câu 13:
 Xem đáp án
Xem đáp án
Bước 1: Tính số mol KAl(SO4)2.12H2O kết tinh
- Gọi x là số mol KAl(SO4)2.12H2O kết tinh.
- Vì nhiệt độ không đổi nên độ tan cũng không đổi do đó nồng độ dung dịch bão hòa không đổi.
- Giả sử không thoát hơi nước thì 200 gam nước sẽ hòa tan tối đa x mol KAl(SO4)2.12H2O được dung dịch bão hòa ở 20oC.
- Phương trình nồng độ dung dịch bão hòa:
\[C{\rm{\% }} = \frac{{{m_{ct}}}}{{{m_{{\rm{dd}}}}}}.100{\rm{\% }} = \frac{{258x}}{{474x + 200}}.100{\rm{\% }} = 5,56{\rm{\% }}\]
→ x = 0,048.
Bước 2: Tính mKAl(SO4)2.12H2O
- mKAl(SO4)2.12H2O= 0,048.474 = 22,75 gam.
Đáp án cần chọn là: B
Câu 14:
 Xem đáp án
Xem đáp án
Bước 1: Đặt ẩn cho mCuSO4.5H2O; mCuSO44%
Gọi mCuSO4.5H2O= x (g); mdd(CuSO4 4%)= y (g).
Bước 2: Tính mCuSO4.5H2O; mCuSO44%
- mdd(CuSO4 8%)= mCuSO4.5H2O+ mdd(CuSO4 4%)
⟹ x + y = 500 (1)
- Khối lượng CuSO4có trong tinh thể CuSO4.5H2O là \[m = n.M = \frac{x}{{250}}.160 = \frac{{16x}}{{25}}\left( g \right)\]
Khối lượng CuSO4có trong dung dịch CuSO44% là\[{m_{ct}} = \frac{{{m_{{\rm{dd}}}}.C{\rm{\% }}}}{{100{\rm{\% }}}} = \frac{{y.4}}{{100}} = \frac{y}{{25}}\left( g \right)\]
Khối lượng CuSO4có trong 500 g dung dịch CuSO48%:
\[{m_{ct}} = \frac{{{m_{{\rm{dd}}}}.C{\rm{\% }}}}{{100{\rm{\% }}}} = \frac{{500.8}}{{100}} = 40\](g)
BTKL ⟹\[\frac{{16x}}{{25}} + \frac{y}{{25}} = 40\](2)
Từ (1)(2) ⟹ \[x{\rm{ }} = {\rm{ }}100/3{\rm{ }} \approx {\rm{ }}33,33{\rm{ }}\left( g \right);{\rm{ }}y{\rm{ }} = {\rm{ }}1400/3{\rm{ }} \approx {\rm{ }}466,67{\rm{ }}\left( g \right)\]
Vậy cần lấy 33,33 gam tinh thể CuSO4.5H2O và 466,67 gam dung dịch CuSO44% để điều chế 500 gam dung dịch CuSO48%.
Đáp án cần chọn là: B
Câu 15:
 Xem đáp án
Xem đáp án
Bước 1:Tính \[{m_{RS{O_4}}}\] ban đầu, mddbão hòa
\[{m_{RSO4(bd)}} = \frac{{30}}{{100}}.160 = 48(gam)\]
- mdd bão hòa(sau khi kết tinh)= 160 - 28,552 = 131,478 gam
Bước 2:Tính mRSO4mRSO4 ở 20oC, mRSO4mRSO4 trong RSO4.nH2O bị kết tinh
- Ở 20oC: SRSO4= 35 gam, ta có:
mRSO4(dd 20oC)\[ = \frac{{35}}{{135}}.131,478 = 34,087gam\]
- Khối lượng RSO4trong RSO4.nH2O bị kết tinh là:
mRSO4 (kt)= mRSO4 (ban đầu)- mRSO4 (20 độ)= 48 - 34,087 = 13,913 gam
Bước 3:Biện luận tìm CTPT của muối ngậm nước
- Xét phân tử RSO4.nH2O ta có:
\[\frac{{{m_{RSO4}}}}{{{m_{H2O}}}} = \frac{{R + 96}}{{18n}} = \frac{{13,913}}{{28,552 - 13,913}} \to R = 17,142n - 96\]
Biện luận:
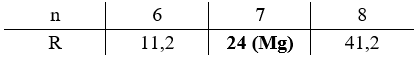
Vậy công thức của muối ngậm nước là MgSO4.7H2O.
Đáp án cần chọn là: B
Câu 16:
 Xem đáp án
Xem đáp án
- Công thức tinh thể là MgSO4.nH2O.
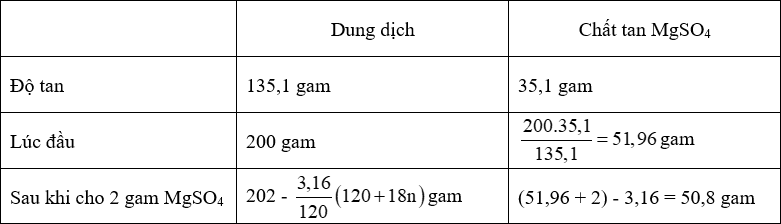
- Ta có:
+ 135,1 gam dd có chứa 35,1 gam MgSO4
+ [202 - \[\frac{{3,16}}{{120}}\] (120 + 18n)] gam dd có chứa 50,8 gam MgSO4.
⟹ [202 - \[\frac{{3,16}}{{120}}\] (120 + 18n)].35,1 = 135,1.50,8
⟹ n = 7
⟹ Công thức của tinh thể A là MgSO4.7H2O.
Đáp án cần chọn là: D
Câu 17:
 Xem đáp án
Xem đáp án
Bước 1: Tính mdd H2SO4 10%
- Giả sử có 1 mol M2Omphản ứng.
PTHH: M2Om+ mH2SO4⟶ M2(SO4)m+ mH2O
⟹ mdd H2SO4 10% =\[\frac{{98m}}{{10}}.100 = {\rm{ }}980m{\rm{ }}\left( g \right)\]
Bước 2: Tính mM2(SO4)mmM2(SO4)mvà tìm CT của oxit
- Khối lượng dung dịch thu được là: (3,2M + 16m) + 980m = 3,2M + 996m (g)
Số gam muối là: 2M + 96m (g)
- Ta có \[C\% {\rm{ }} = \;\frac{{2M + 96m}}{{2M + 996m}}.100{\rm{\% }} = {\rm{ }}12,9\% {\rm{ }} \Rightarrow M{\rm{ }} = {\rm{ }}18,65m\]
Nghiệm phù hợp là m = 3 và M = 56 (Fe).
Vậy oxit là Fe2O3.
Fe2O3+ 3H2SO4⟶ Fe2(SO4)3+ 3H2O
\[{n_{F{e_2}{O_3}}}\; = \frac{{3,2}}{{160}} = {\rm{ }}0,02{\rm{ }}mol\]
Bước 3: Xác định CT của tinh thể muối
Vì hiệu suất là 70% nên số mol Fe2(SO4)3tham gia kết tinh là: 0,02.70% = 0,014 mol
Nhận thấy số gam Fe2(SO4)3= 0,014.400 = 5,6 gam < 7,868 gam nên tinh thể là muối ngậm nước.
- Đặt CTHH của muối tinh thể là Fe2(SO4)3.nH2O.
Ta có: 0,014.(400 + 18n) = 7,868 ⟹ n = 9.
- Công thức của tinh thể là Fe2(SO4)3.9H2O.
Đáp án cần chọn là: A
Câu 18:
 Xem đáp án
Xem đáp án
Khối lượng BaCl2tan được trong 50 gam nước là 30 - 12,1 = 17,9 (gam).
Độ tan của BaCl2ở 200C là S = (17,9/50).100 = 35,8 gam.
Đáp án cần chọn là: A
