Tốc độ phản ứng, các yếu tố ảnh hưởng
-
1054 lượt thi
-
17 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Cho phản ứng hóa học sau :\[2{H_2}{O_2}\mathop \to \limits^{Mn{O_2}} 2{H_2}{O_{\left( I \right)}} + {O_{2\left( k \right)}}\]. Yếu tố nào sau đây không ảnh hưởng đến tốc độ của phản ứng trên ?
 Xem đáp án
Xem đáp án
Các yếu tố ảnh hưởng đến tốc độ của phản ứng trên :
- Nồng độ H2O2 : nếu tăng nồng độ H2O2 thì tốc độ phản ứng tăng.
- Thêm chất xúc tác : làm tăng tốc độ của phản ứng.
- Nhiệt độ : nếu tăng nhiệt độ thì tốc độ phản ứng tăng.
→ Yếu tố không ảnh hưởng đến tốc độ của phản ứng là áp suất vì chất tham gia không phải là chất khí.
Đáp án cần chọn là: A
Câu 2:
Cho phản ứng: 2NO + O2→ 2NO2xảy ra trong bình kín. Biết nhiệt độ của hệ không đổi. Tốc độ của phản ứng tăng hay giảm bao nhiêu lần khi áp suất của NO tăng 3 lần ?
 Xem đáp án
Xem đáp án
Gọi k là hằng số tốc độ phản ứng
→ Công thức tính tốc độ phản ứng theo k:\[{v_1} = k{\left( {\left[ {NO} \right]} \right)^2}\left[ {{O_2}} \right]\]
- Khi tăng áp suất của NO lên 3 lần → Nồng độ của NO tăng lên 3 lần, nồng độ của O2không đổi nên \[{v_2} = k{\left( {3\left[ {NO} \right]} \right)^2}{\left[ {{O_2}} \right]_1}\,\, = \,\,k.9.{\left( {\left[ {NO} \right]} \right)^2}\left[ {{O_2}} \right]\]\[\frac{{{v_2}}}{{{v_1}}} = \,\,\frac{{k.9.{{\left( {\left[ {NO} \right]} \right)}^2}\left[ {{O_2}} \right]\,}}{{k{{\left( {\left[ {NO} \right]} \right)}^2}\left[ {{O_2}} \right]}}\,\, = \,\,9\,\, \to \,\,{v_2} = \,\,9{v_1}\]→ Tốc độ phản ứng tăng lên 9 lần
- Ngược lại: Khi giảm áp suất của NO xuống 3 lần
→ Nồng độ của NO giảm đi 3 lần, nồng độ của O2không đổi
\[{v_2} = k{\left( {\frac{{\left[ {NO} \right]}}{3}} \right)^2}{\left[ {{O_2}} \right]_1}\,\, = \,\,k.\frac{{{{\left( {\left[ {NO} \right]} \right)}^2}}}{9}\left[ {{O_2}} \right]\]
\[ \to \,\,\frac{{{v_2}}}{{{v_1}}} = \,\,\frac{{k.\frac{{{{\left( {\left[ {NO} \right]} \right)}^2}}}{9}\left[ {{O_2}} \right]\,}}{{k{{\left( {\left[ {NO} \right]} \right)}^2}\left[ {{O_2}} \right]}}\,\, = \,\,\frac{1}{9}\,\, \to \,\,{v_2} = \,\,\frac{{{v_1}}}{9}\]
→ Tốc độ phản ứng giảm đi 9 lần
Đáp án cần chọn là: A
Câu 3:
Cho chất xúc tác MnO2vào 100 ml dung dịch H2O2, sau 60 giây thu được 33,6 ml khí O2(ở đktc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây là
 Xem đáp án
Xem đáp án
\[{n_{{O_2}}} = \,\,\frac{{0,0336}}{{22,4}}\,\, = \,\,0,0015\,\,mol\]
\[2{H_2}{O_2}\mathop \to \limits^{Mn{O_2}} 2{H_2}O{\rm{ }} + {\rm{ }}{O_2}\]
+) Theo phương trình phản ứng :\[{n_{{H_2}{O_2}}}\]phản ứng=\[2{n_{{O_2}}} = \,\,2.0,0015\,\, = \,\,0,003\,\,mol\]
+) Lượng H2O2phản ứng này chính là lượng H2O2biến đổi trong 60 giây
hay \[\frac{{0,003}}{{0,1}}\,\, = \,\,0,03\,\,mol/L\]
+) \[\bar v = \,\,\frac{{{\rm{\Delta }}C}}{{{\rm{\Delta }}t}}\]nên\[\bar v\,\, = \,\,\frac{{0,03}}{{60}}\,\, = \,\,{5.10^{ - 4}}\,\,mol/\left( {L.s} \right)\]
Đáp án cần chọn là: C
Câu 4:
Cho phản ứng:\[2S{O_2}\; + {\rm{ }}{O_2}\; \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\leftarrow\over{\smash{\rightarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \;2S{O_3}\]. Biết thể tích bình phản ứng không đổi. Tốc độ phản ứng tăng lên 4 lần khi
 Xem đáp án
Xem đáp án
Gọi k là hằng số tốc độ phản ứng=>Công thức tính tốc độ phản ứng theo k: v = k[SO2]2[O2]
- Khi tăng nồng độ của SO2lên 2 lần thì tốc độ phản ứng tăng lên 22= 4 lần
- Khi tăng nồng độ của SO2lên 4 lần thì tốc độ phản ứng tăng lên 42= 16 lần
- Khi tăng nồng độ của O2lên 2 lần thì tốc độ phản ứng tăng lên 2 lần
- Khi tăng đồng thời nồng độ SO2và O2lên 2 lần thì tốc độ phản ứng tăng lên 22.2 = 8 lần
Đáp án cần chọn là: A
Câu 5:
Phản ứng trong bình kín giữa các phân tử khí xảy ra theo phương trình:
A2+ 2B → 2AB
Tốc độ của phản ứng thay đổi như thế nào khi áp suất của A2tăng lên 6 lần?
 Xem đáp án
Xem đáp án
Gọi k là hằng số tốc độ phản ứng.
→ Công thức tính tốc độ phản ứng theo k:\[{v_1} = k\left[ {{A_2}} \right]{\left( {\left[ B \right]} \right)^2}\]
Khi áp suất của A2tăng lên 6 lần thì nồng độ của A2tăng lên 6 lần và nồng độ của B không đổi thì:\[{v_2}{\rm{\;}} = k.6.\left[ {{A_2}} \right]{\left( {\left[ B \right]} \right)^2}\]
\[ \to \,\,\frac{{{v_2}}}{{{v_1}}} = \,\,\frac{{k.6.\left[ {{A_2}} \right]{{\left( {\left[ B \right]} \right)}^2}}}{{k\left[ {{A_2}} \right]{{\left( {\left[ B \right]} \right)}^2}}}\,\, = \,\,6\,\, \to \,\,{v_2} = \,\,6{v_1}\]→ Tốc độ phản ứng tăng lên 6 lần.
Đáp án cần chọn là: A
Câu 6:
Cho phương trình hóa học của phản ứng: X + 2Y → Z + T.
Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/L. Sau 20 giây, nồng độ của chất X là 0,008 mol/L. Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là
 Xem đáp án
Xem đáp án
Tốc độ trung bình của phản ứng :\[\bar v\,\, = \,\,\frac{{{\rm{\Delta }}C}}{{{\rm{\Delta }}t}}\,\, = \,\frac{{0,01 - \,0,008}}{{20}}\,\, = \,\,{10^{ - 4}}\] mol/(L.s).
Đáp án cần chọn là: C
Câu 7:
Khi nhiệt độ tăng thêm 50oC thì tốc độ phản ứng hóa học tăng lên 1024 lần. Giá trị hệ số nhiệt độ của tốc độ phản ứng trên là
 Xem đáp án
Xem đáp án
Gọi nhiệt độ của phản ứng trước và sau khi tăng là t1, t2.
+) Tốc độ phản ứng tăng lên 1024 lần nên \[\frac{{{v_{{t_2}}}}}{{{v_{{t_1}}}}}\,\, = \,\,1024\]
mà\[{v_{{t_2}}} = \,\,{v_{{t_1}}}.{k^{\frac{{{t_2} - {t_1}}}{{10}}}}\,\, \to \,\,{k^{\frac{{{t_2} - {t_1}}}{{10}}}}\, = \,\,\frac{{{v_{{t_2}}}}}{{{v_{{t_1}}}}}\,\, = \,\,1024\,\,\,\,(1)\]
+) Theo bài ra ta có, nhiệt độ tăng thêm nên t2– t1=50oC
Thay vào (1) ta có\[{k^{\frac{{{t_2} - {t_1}}}{{10}}}}\, = \,\,1024\,\, \to \,\,{k^5}\,\, = \,\,{4^5}\,\, \to \,\,k\,\, = \,\,4\]
Vậy hệ số nhiệt độ của tốc độ phản ứng là 4.
Đáp án cần chọn là: C
Câu 8:
Tốc độ của phản ứng: H2+ I2\[ \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\leftarrow\over{\smash{\rightarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \] 2HI tăng lên bao nhiêu lần khi tăng nhiệt độ của phản ứng tăng từ 20oC lên 170oC? Biết rằng khi tăng nhiệt độ thêm 25oC thì tốc độ phản ứng tăng lên 3 lần.
 Xem đáp án
Xem đáp án
Tốc độ phản ứng tăng lên 3 lần nên \[\frac{{{v_{{t_2}}}}}{{{v_{{t_1}}}}}\,\, = \,\,3\]mà \[{v_{{t_2}}} = \,\,{v_{{t_1}}}.{k^{\frac{{{t_2} - {t_1}}}{{10}}}}\,\, \to \,\,{k^{\frac{{{t_2} - {t_1}}}{{10}}}}\, = \,\,\frac{{{v_{{t_2}}}}}{{{v_{{t_1}}}}}\,\, = \,\,3\,\,\,\,(1)\]
- Tăng nhiệt độ thêm 25oC thì t2– t1= 25oC
Thay vào (1) :\[{k^{\frac{{{t_2} - {t_1}}}{{10}}}}\, = \,\,{k^{2,5}} = 3\,\, \to \,\,k\,\,\, = \,1,552\]
- Khi phản ứng tăng từ 20oC lên 170oC thì t2– t1= 150oC
\[\,\, \to \frac{{{v_{{t_2}}}}}{{{v_{{t_1}}}}}\,\, = {k^{\frac{{{t_2} - {t_1}}}{{10}}}}\, = \,\,{1,552^{15}} = \,\,730\]
=>Tốc độ phản ứng tăng lên 730 lần.
Đáp án cần chọn là: B
Câu 9:
Khi nhiệt độ tăng thêm 10oC tốc độ phản ứng hóa học tăng thêm 3 lần. Để tốc độ phản ứng đó (đang tiến hành ở 300C) tăng lên 81 lần thì cần thực hiện ở nhiệt độ nào?
 Xem đáp án
Xem đáp án
Gọi nhiệt độ của phản ứng trước và sau khi tăng là t1, t2.
+) Tốc độ phản ứng tăng lên 3 lần nên \[\frac{{{v_{{t_2}}}}}{{{v_{{t_1}}}}}\,\, = \,\,3\]mà \[{v_{{t_2}}} = \,\,{v_{{t_1}}}.{k^{\frac{{{t_2} - {t_1}}}{{10}}}}\,\, \to \,\,{k^{\frac{{{t_2} - {t_1}}}{{10}}}}\, = \,\,\frac{{{v_{{t_2}}}}}{{{v_{{t_1}}}}}\,\, = \,\,3\,\,\,\,(1)\]
- Theo bài ra, nhiệt độ tăng thêm 10oC nên t2– t1= 10oC
Thay vào (1) ta có:\[{k^{\frac{{{t_2} - {t_1}}}{{10}}}}\, = \,\,3\,\, \to \,\,{k^1}\,\, = \,\,{3^1}\,\, \to \,\,k\,\, = \,\,3\]
- Khi tốc độ phản ứng tăng lên 81 lần và t1= 30oC.
Mà\[{k^{\frac{{{t_2} - 30}}{{10}}}}\, = \,\,\frac{{{v_{{t_2}}}}}{{{v_{{t_1}}}}}\,\, \to \,{3^{\frac{{{t_2} - {\kern 1pt} {\kern 1pt} 30}}{{10}}}}\, = \,\,{3^4}\,\, \to \,\,\frac{{{t_2} - \,\,30}}{{10}}\,\, = \,\,4\,\, \to \,\,{t_2}\,\, = \,\,{70^o}C\]
=>thực hiện phản ứng ở nhiệt độ 70oC
Đáp án cần chọn là: D
Câu 10:
Nồng độ ban đầu của Br2là a mol/lít, sau 50 giây nồng độ Br2còn lại là 0,01 mol/lít. Tốc độ trung bình của phản ứng trên tính theo Br2là 4.10-5mol(lít.s)-1. Giá trị của a là:
 Xem đáp án
Xem đáp án
Tốc độ trung bình của phản ứng là:
\[\begin{array}{*{20}{l}}{\bar v = \frac{{{\rm{\Delta }}{C_B}}}{t} = \frac{{{C_B}{\,_{dau}} - {C_B}{\,_{sau}}}}{t}}\\{ \Rightarrow \frac{{a - 0,01}}{{50}} = {{4.10}^{ - 5}}}\\{ \Rightarrow a = {{50.4.10}^{ - 5}} + 0,01 = 0,012\,(mol/l)}\end{array}\]
Đáp án cần chọn là: C
Câu 11:
Một phản ứng đơn giản xảy ra trong bình kín: 2NO (k) + O2 (k) \[ \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \] 2NO2 (k). Giữ nguyên nhiệt độ, nén hỗn hợp phản ứng xuống còn 1/3 thể tích. Kết luận nào sau đây không đúng ?
 Xem đáp án
Xem đáp án
Thể tích giảm dẫn đến áp suất tăng → cân bằng sẽ chuyển dịch theo chiều chống lại sự tăng áp suất → cân bằng chuyển dịch theo chiều thuận (chiều thuận giảm số phân tử khí)→ C đúng
Giả sử ban đầu khi ở trạng thái cân bằng: [NO] = a(M); [O2] = b (M); [NO2] = c (M)
→ Tốc độ chiều thuận: Vt= k[NO]2.[O2] = k.a2.b
→ Tốc độ chiều nghịch: Vn= k’[NO2]2= k’c
Khi giảm thể tích xuống 3 lần thì nồng độ các chất tăng lên 3 lần
Vthuận sau= k[3NO]2.[3O2] = 32.3 k[NO]2.[O2] = 27 k.a2.b = 27Vt→ Tốc độ phản ứng thuận tăng 27 lần → A đúng
Vnghịch sau= k’[3NO2]2= 32k’[NO2]2= 9 k’c = 9Vn → Tốc độ phản ứng nghịch tăng 9 lần → B đúng
Đáp án cần chọn là: D
Câu 12:
Để hoà tan một tấm Zn trong dd HCl ở 200C thì cần 27 phút, cũng tấm Zn đó tan hết trong dd HCl nói trên ở 400C trong 3 phút. Hỏi để hoà tan hết Tấm Zn đó trong dd HCl trên ở 550C thì cần bao nhiêu thời gian?
 Xem đáp án
Xem đáp án
Theo dữ kiện của đề bài ta sẽ có:
Cứ (40 - 20) = 20 độ C thì tốc độ phản ứng tăng 27 : 3 = 9 lần.
Suy ra ở nhiệt độ 55 độ C thì tốc độ phản ứng tăng \[{9^{\frac{{55 - 20}}{{20}}}}\]= 46,77 lần
Vậy thời gian để hòa tan hết mẫu Zn đó ở 55 độ C là 27 : 46,77 = 0,577 phút = 34,64s
Đáp án cần chọn là: B
Câu 13:
Cho phương trình hoá học của phản ứng tổng hợp amoniac:
Khi tăng nồng độ của H2lên 3 lần, tốc độ phản ứng thuận:
 Xem đáp án
Xem đáp án
V = k . [N2]. [H2]3
Khi tăng nồng độ của H2lên 3 lần =>V sẽ tăng lên 33 = 27 lần
Đáp án cần chọn là: C
Câu 14:
Khi nhiệt độ tăng lên 100C, tốc độ của một phản ứng hoá học tăng lên 3 lần. Người ta nói rằng tốc độ phản ứng hoá học trên có hệ số nhiệt độ bằng 3. Điều khẳng định nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Tốc độ sẽ tăng lên \[{3^{\frac{{50 - 20}}{{10}}}}\]= 33= 27 lần
Đáp án cần chọn là: C
Câu 15:
(B-2014) Thực hiện phản ứng sau trong bình kín: H2(k) + Br2(k) → 2HBr (k).
Lúc đầu nồng độ hơi Br2là 0,072 mol/l. Sau 2 phút, nồng độ hơi Br2 còn lại là 0,048 mol/l. Tốc độ
trung bình của phản ứng tính theo Br2trong khoảng thời gian trên là
 Xem đáp án
Xem đáp án
\[ = >{\rm{ }}v{\rm{ }} = {\rm{ }}\Delta C/\Delta t{\rm{ }} = {\rm{ }}\left( {0,072{\rm{ }}--{\rm{ }}0,048} \right){\rm{ }}/1{\rm{ }}20{\rm{ }} = {\rm{ }}{2.10^{ - 4}}\;mol/\left( {l.s} \right)\]
Đáp án cần chọn là: B
Câu 16:
(B-2009) Cho chất xúc tác MnO2vào 100 ml dung dịch H2O2, sau 60 giây thu được 3,36 ml khí O2(ở đktc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây trên là
 Xem đáp án
Xem đáp án
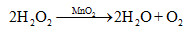
\[{n_{O2}}\; = {\rm{ }}{1,5.10^{ - 4}}\;mol\]
=>nH2O2phản ứng= 3.10-4mol
\[ = >{\rm{ }}\Delta {C_{H2O2}}\;\]= n/V = 3.10-4/0,1 = 3.10-3M
=>v = \[\Delta \] C/\[\Delta \] t = 3.10-3/ 60 = 5.10-5mol/(l.s)
Đáp án cần chọn là: D
Câu 17:
Phản ứng giữa hai chất A và B được biểu thị bằng phương trình hóa học sau
A + B → 2C
Tốc độ phản ứng này là V = K.[A].[B]. Thực hiện phản ứng này với sự khác nhau về nồng độ ban đầu của các chất:
Trường hợp 1: Nồng độ của mỗi chất là 0,01 mol/l.
Trường hợp 2: Nồng độ của mỗi chất là 0,04 mol/l
Trường hợp 3: Nồng độ của chất A là 0,04 mol/l, của chất B là 0,01 mol/l.
Tốc độ phản ứng ở trường hợp 2 và 3 lớn hơn so với trường 1 số lần là
 Xem đáp án
Xem đáp án
TH2, nồng độ mỗi chất tăng lên 4 lần =>v tăng lên: 4 . 4 = 16 lần
TH3, nồng độ mỗi chất A tăng lên 4 lần =>v tăng lên: 4 . 1 = 4 lần
Đáp án cần chọn là: C
