Trắc nghiệm Hóa học 10 Bài 9: Quy tắc octet có đáp án
-
527 lượt thi
-
15 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Theo quy tắc octet: Trong phản ứng hóa học, các nguyên tử có xu hướng
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Quy tắc octet: “Trong phản ứng hóa học, các nguyên tử có xu hướng hình thành lớp vỏ bền vững như của khí hiếm”.
Câu 2:
Cho nguyên tử các nguyên tố sau: Na (Z = 11); P (Z = 15); Ne (Z = 10). Trong các nguyên tử trên, nguyên tử có lớp electron ngoài cùng bền vững là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Nguyên tử khí hiếm có lớp electron ngoài cùng đã bão hòa với 8 electron (ngoại lệ là He với lớp electron ngoài cùng bão hòa 2 electron) nên các nguyên tử khí hiếm bền vững hơn rất nhiều so với các nguyên tử nguyên tố khác.
Cấu hình electron nguyên tử:
Na (Z = 11): 1s22s22p63s1 có 1 electron lớp ngoài cùng.
P (Z = 15): 1s22s22p63s23p3 có 5 electron lớp ngoài cùng.
Ne (Z = 10): 1s22s22p6 có 8 electron lớp ngoài cùng.
Nguyên tử có lớp electron ngoài cùng bền vững là Ne.
Câu 3:
Nguyên tử chlorine có Z = 17. Xu hướng cơ bản của nguyên tử chlorine khi hình thành liên kết hóa học là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cấu hình electron nguyên tử của chlorine (Cl): 1s22s22p63s23p5 (có 7 electron ở lớp vỏ ngoài cùng).
Xu hướng cơ bản của nguyên tử chlorine khi hình thành liên kết hóa học là nhận thêm 1 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài cùng như của khí hiếm Ar (thay vì Cl phải nhường đi 7 electron để có lớp vỏ ngoài cùng là 2s22p6 – khó khăn hơn rất nhiều).
Câu 4:
Oxygen có Z = 8, xu hướng cơ bản của nguyên tử oxygen khi hình thành liên kết hóa học là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Cấu hình electron của nguyên tử oxygen (Z = 8): 1s22s22p4.
Nguyên tử oxygen có 6 electron lớp ngoài cùng xu hướng nhận thêm 2 electron để đạt được lớp vỏ bền vững như của khí hiếm (8 electron lớp ngoài cùng).
Câu 5:
Các phi kim với 5, 6 hoặc 7 electron ở lớp ngoài cùng có xu hướng
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Các phi kim với 5, 6 hoặc 7 electron ở lớp ngoài cùng có xu hướng nhận 3, 2 hoặc 1 electron để đạt 8 electron ở lớp ngoài cùng. Trong cùng chu kì, các nguyên tử có lớp electron ngoài cùng với 7 electron (các halogen) dễ nhận thêm electron hơn nên có tính phi kim mạnh nhất.
Câu 6:
Nguyên tử sodium có Z = 11. Xu hướng cơ bản của nguyên tử sodium khi hình thành liên kết hóa học là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cấu hình electron nguyên tử của sodium (Z = 11): [Ne]3s1, có 1 electron ở lớp vỏ ngoài cùng.
Vậy xu hướng cơ bản của nguyên tử sodium khi hình thành liên kết hóa học là nhường đi 1 electron để đạt được lớp vỏ 8 electron ở lớp ngoài cùng như của khí hiếm Ne (thay vì sodium phải nhận thêm 7 electron để có lớp vỏ ngoài cùng là 3s23p6 – khó khăn hơn rất nhiều).
Câu 7:
Các kim loại có 1, 2 hoặc 3 electron ở lớp ngoài cùng có xu hướng
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Các kim loại có 1, 2 hoặc 3 electron ở lớp ngoài cùng có xu hướng nhường 1, 2 hoặc 3 electron để tạo thành ion dương tương ứng có 8 electron ở lớp ngoài cùng. Trong cùng chu kì, nguyên tử có 1 electron ở lớp ngoài cùng (các kim loại kiềm) dễ nhường electron hơn nên có tính kim loại mạnh nhất.
Câu 8:
Phân tử H2 được hình thành từ
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phân tử H2 được hình thành từ 2 nguyên tử H bởi sự góp chung electron. Sau khi hình thành liên kết, xung quanh mỗi nguyên tử H có 1 đôi electron chung, giống lớp vỏ bền vững của khí hiếm He.
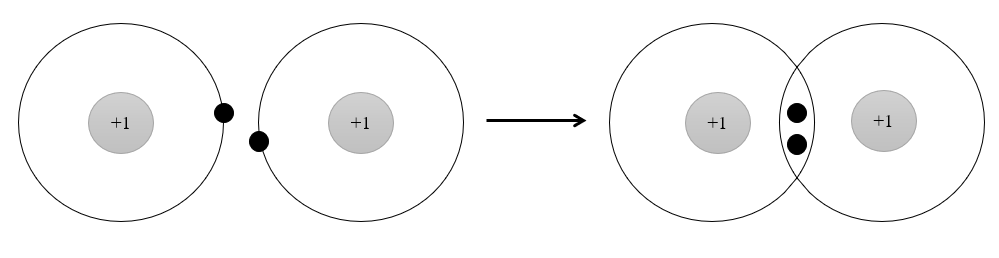
Câu 9:
Nguyên tử P (Z = 15) có xu hướng
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Cấu hình electron của nguyên tử P (Z = 15): 1s22s22p63s23p3.
Nguyên tử P có 5 electron ở lớp ngoài cùng có xu hướng nhận 3 electron để đạt 8 electron ở lớp ngoài cùng bền vững như khí hiếm.
Câu 10:
Nguyên tử Al (Z = 13) có xu hướng
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cấu hình electron của nguyên tử Al (Z = 13): 1s22s22p63s23p1.
Nguyên tử Al có 3 electron ở lớp ngoài cùng có xu hướng nhường 3 electron để đạt 8 electron ở lớp ngoài cùng bền vững như khí hiếm.
Câu 11:
Nguyên tử nguyên tố nào sau đây có xu hướng nhường đi 1 electron khi hình thành liên kết hóa học?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Boron (Z = 5): 1s22s22p1 có 3 electron ở lớp ngoài cùng có xu hướng nhường 3 electron để đạt 2 electron ở lớp ngoài cùng bền vững như khí hiếm He.
Potassium (Z = 19): 1s22s22p63s23p64s1 có 1 electron ở lớp ngoài cùng có xu hướng nhường 1 electron để đạt 8 electron ở lớp ngoài cùng bền vững như khí hiếm.
Magnesium (Z = 12): 1s22s22p63s2 có 2 electron ở lớp ngoài cùng có xu hướng nhường 2 electron để đạt 8 electron ở lớp ngoài cùng bền vững như khí hiếm.
Flourine (Z = 9): 1s22s22p5 có 7 electron ở lớp ngoài cùng có xu hướng nhận 1 electron để đạt 8 electron ở lớp ngoài cùng bền vững như khí hiếm.
Câu 12:
Cation R+ có cấu hình electron ở phân lớp ngoài cùng là 2p6. Phần trăm khối lượng của R trong oxide cao nhất là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Cấu hình electron của R+: 1s22s22p6.
Nguyên tử R nhường 1 electron để tạo thành cation R+:
R R+ + 1e.
Cấu hình electron của nguyên tử R: 1s22s22p63s1 (Z = 11).
R là Na, có hóa trị I.
Oxide cao nhất của R là: Na2O.
\[\% {m_R} = \frac{{2 \times 23}}{{62}} \times 100\% \approx 74,19\% \].
Câu 13:
Cation M+ và anion X- đều có cấu hình electron phân lớp ngoài cùng là 3p6. Cho đơn chất M tác dụng với đơn chất X thu được sản phẩm là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cấu hình electron của cation M+ và anion X-: 1s22s22p63s23p6.
Nguyên tử M nhường 1 electron để tạo thành cation M+:
M M+ + 1e.
Cấu hình electron của nguyên tử M: 1s22s22p63s23p64s1 (Z = 19) M là kim lọai K.
Nguyên tử X nhận 1 electron để trở thành anion X-:
X + 1e X-.
Cấu hình electron của nguyên tử X: 1s22s22p63s23p5 (Z = 17) X là phi kim Cl.
Cho đơn chất M tác dụng với đơn chất X: 2K + Cl2 2KCl.
Câu 14:
Cho 6,72 gam một kim loại M tác dụng với dung dịch H2SO4 loãng, dư, thu được 2,688 lít khí (ở đktc). Kim loại M là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Gọi hóa trị của kim loại M là n.
Phương trình hóa học: 2M + nH2SO4 M2(SO4)n + nH2.
\[{n_{{H_2}}}\]= 0,12 (mol) nM = \[\frac{{2{n_{{H_2}}}}}{n} = \frac{{0,24}}{n}\] (mol).
MM = \[\frac{{6,72 \times n}}{{0,24}}\]= 28n.
Chọn n = 2 MM = 56 (amu) M là kim loại Fe.
Câu 15:
Cho 8,8 gam một hỗn hợp hai kim loại nằm ở hai chu kì liên tiếp và đều thuộc nhóm IIA của bảng tuần hoàn tác dụng với lượng dư dung dịch HCl, sau phản ứng thu được 6,72 lít khí ở đktc. Hai kim loại đó là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Gọi công thứ chung của hai kim loại là \[\overline R \] (hóa trị II).
Phương trình hóa học: \[\overline R \] + 2HCl \[\overline R \]Cl2 + H2.
\[{n_{\overline R }}\]= \[{n_{{H_2}}}\]= 0,3 (mol) \[{M_{\overline R }} = \frac{{8,8}}{{0,3}} \approx 29,33\](amu).
Hai kim loại là: Mg (M = 24) và Ca (M = 40).
