Trắc nghiệm Hóa học 10 Bài 11: Liên kết cộng hóa trị có đáp án
-
582 lượt thi
-
15 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Liên kết cộng hóa trị là liên kết được hình thành bởi
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Liên kết cộng hóa trị là liên kết được hình thành bởi một hay nhiều cặp electron chung giữa hai nguyên tử.
Câu 2:
Liên kết giữa nguyên tử H và F trong phân tử HF được tạo nên bởi
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Nguyên tử H có cấu hình electron là 1s1; nguyên tử Cl có cấu hình electron là 1s22s22p5. Để đạt được cấu hình của khí hiếm gần nhất, mỗi nguyên tử này đều cần thêm 1 electron. Vì vậy, mỗi nguyên tử H và F cùng góp 1 electron để tạo nên 1 cặp electron chung.
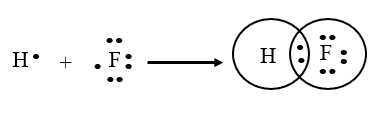
Công thức cấu tạo của HF là: H – F.
Câu 3:
Công thức biểu diễn cấu tạo phân tử qua các liên kết (cặp electron chung) và các electron riêng gọi là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Công thức Lewis là công thức biểu diễn cấu tạo phân tử qua các liên kết (cặp electron chung) và các electron riêng.
Câu 4:
Nếu giữa hai nguyên tử chỉ có một cặp electron chung thì cặp electron này được biểu diễn
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Nếu giữa hai nguyên tử chỉ có một cặp electron chung thì cặp electron này được biểu diễn bằng một nối đơn (–) và gọi là liên kết đơn.
Nếu giữa hai nguyên tử có hai cặp electron chung thì hai cặp electron này được biểu diễn bằng một nối đôi (=) và gọi là liên kết đôi.
Nếu giữa hai nguyên tử có ba cặp electron chung thì ba cặp electron này được biểu diễn bằng một nối ba () và gọi là liên kết ba.
Câu 5:
Công thức cấu tạo của CO2 là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cấu hình electron nguyên tử của C (Z = 6): 1s22s22p2.
Cấu hình electron của nguyên tử O (Z = 8): 1s22s22p4.
Nguyên tử C cần thêm 4 electron để đạt được cấu hình bền vững của khí hiếm gần nhất; nguyên tử O cần 2 electron để đạt được cấu hình của khí hiếm gần nhất.
Mỗi nguyên tử O góp chung 2 electron, nguyên tử C góp chung 4 electron chia đều cho 2 nguyên tử O.
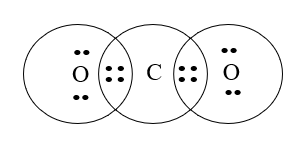
Công thức cấu tạo của CO2 là O=C=O.
Câu 6:
Liên kết giữa 2 nguyên tử N trong phân tử N2 là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cấu hình electron của nguyên tử N (Z = 7): 1s22s22p3.
Nguyên tử N có 5 electron lớp ngoài cùng.
Mỗi nguyên tử N cần 3 electron để đạt được cấu hình electron của khí hiếm gần nhất. Do đó, mỗi nguyên tử N góp chung 3 electron.
Công thức cấu tạo của N2 là NN.
Liên kết giữa 2 nguyên tử N trong phân tử N2 là liên kết ba.
Câu 7:
Liên kết mà cặp electron chung được đóng góp từ một nguyên tử được gọi là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Liên kết mà cặp electron chung được đóng góp từ một nguyên tử được gọi là liên kết cho – nhận.
Câu 8:
Trong phân tử nào đây có chứa liên kết cho nhận?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Trong phân tử SO2 có liên kết cho – nhận.
Giải thích:
Cấu hình electron của nguyên tử S (Z = 16): [Ne]3s23p4.
Cấu hình electron của nguyên tử O (Z = 8); 1s22s22p4.
Nguyên tử S có 6 electron ở lớp ngoài cùng. Khi hình thành phân tử SO2, nguyên tử S đã dùng 2 electron độc thân góp chung với 2 electron độc thân của một trong hai nguyên tử O. Nguyên tử S sử dụng một cặp electron để dùng chung với nguyên tử O còn lại.
Công thức cấu tạo của SO2:
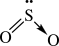
(Liên kết cho – nhận được biểu diễn bằng mũi tên )
Loại A, vì: Liên kết trong phân tử HCl là liên kết cộng hóa trị có cực.
Loại B, vì: Liên kết trong phân tử O2 là liên kết cộng hóa trị không cực.
Loại C, vì: Liên kết trong phân tử NaCl là liên kết ion.
Câu 9:
Nguyên tử A và B có độ âm điện lần lượt là (A) , (B) ((B) ≥ (A) ). Hiệu độ âm điện giữa hai nguyên tử A, B là = (B) - (A). Nếu liên kết giữa hai nguyên tử A và B là liên kết cộng hóa trị có cực thì
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Sự khác biệt về hiệu độ âm điện () giữa hai nguyên tử A và B có thể biểu diễn kiểu liên kết giữa hai nguyên tử đó.
0 ≤ < 0,4: Liên kết cộng hóa trị không cực.
0,4 ≤ < 1,7: Liên kết cộng hóa trị có cực.
≥ 1,7: Liên kết ion.
Câu 10:
Liên kết giữa hai nguyên tử Cl trong phân tử Cl2 là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
= 0 nên liên kết giữa hai nguyên tử Cl là liên kết cộng hóa trị không cực.
Câu 11:
Cho biết độ âm điện của nguyên tử H và Cl lần lượt là 2,2 và 3,2. Liên kết giữa nguyên tử H và Cl trong phân tử HCl là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
= (Cl) - (H) = 3,2 – 2,2 = 1,0.
Nhận xét: 0,4 ≤ < 1,7 liên kết giữa nguyên tử H và Cl là liên kết cộng hóa trị có cực (cặp electron chung bị lệch về phía nguyên tử Cl).
Câu 12:
Liên kết ba gồm
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Liên kết đơn còn gọi là liên kết , liên kết đôi gồm 1 liên kết và 1 liên kết , liên kết ba gồm 1 liên kết và 2 liên kết .
Câu 13:
Cho các phát biểu sau:
(1) Trong phân tử HCl, cặp electron chung bị lệch về phía nguyên tử H.
(2) Liên kết kém bền hơn liên kết .
(3) Liên kết được tạo nên từ xen phủ trục của hai AO gọi là liên kết sigma ().
(4) Liên kết được tạo nên từ xen phủ bên của hai AO gọi là liên kết pi ().
Trong các phát biểu trên, số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phát biểu đúng: (3), (4).
Phát biểu (1) không đúng, vì: Trong phân tử HCl, cặp electron chung bị lệch về phía nguyên tử có độ âm điện lớn hơn là Cl.
Phát biểu (2) không đúng, vì: Liên kết bền hơn liên kết bởi vùng xen phủ AO chứa electron chung chắn giữa hai hạt nhân, làm giảm lực đẩy giữa chúng.
Câu 14:
Năng lượng cần thiết để phá vỡ một loại liên kết xác định trong phân tử ở thể khí, tại 25oC và 1 bar được gọi là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Năng lượng cần thiết để phá vỡ một loại liên kết xác định trong phân tử ở thể khí, tại 25oC và 1 bar được gọi là năng lượng liên kết.
Câu 15:
Cho biết năng lượng liên kết của H–F là 565 KJ mol-1; H–Cl là 431 KJ mol-1; H–Br là 364 KJ mol-1; H–I là 297 KJ mol-1. Trong các liên kết trên, liên kết nào bền nhất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Năng lượng liên kết càng lớn, liên kết đó càng bền.
So sánh độ bền liên kết: H–F > H–Cl > H–Br > H–I.
