50 câu trắc nghiệm Phản ứng oxi hóa - khử nâng cao (P1) (có đáp án)
-
1188 lượt thi
-
25 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Khi cho Cu2S tác dụng với HNO3 thu được hỗn hợp sản phẩm gồm: Cu(NO3)2 ; H2SO4 ; NO và H2O. Số mol electron mà 1 mol Cu2S đã nhường là:
 Xem đáp án
Xem đáp án
Đáp án D.
Câu 2:
Khi cho Cu2S tác dụng với HNO3 thu được hỗn hợp sản phẩm gồm: Cu(NO3)2; H2SO4; NO và H2O. Hệ số cân bằng của HNO3 là:
 Xem đáp án
Xem đáp án
Đáp án B.
3Cu2S + 22HNO3 → 6Cu(NO3)2 + 3H2SO4 + 10NO + 8H2O
Câu 3:
Cho phản ứng :
Sau khi cân bằng, tổng các hệ số (có tỉ lệ nguyên và tối giản nhất) là:
 Xem đáp án
Xem đáp án
Đáp án B.
5Fe2+ + MnO4- + 8H+ → 5Fe3+ + Mn2+ + 4H2O
Tổng các hệ số (có tỉ lệ nguyên và tối giản nhất) là = 5 + 1+ 8 + 5+ 1+4 = 24.
Câu 4:
Trong phản ứng đốt cháy CuFeS2 tạo ra sản phẩm CuO, Fe2O3 và SO2 thì một phân tử CuFeS2 sẽ:
 Xem đáp án
Xem đáp án
Đáp án D.
Câu 7:
Trong dãy các chất sau, dãy chất nào thường là chất oxi hóa khi tham gia các phản ứng oxi hóa – khử:
 Xem đáp án
Xem đáp án
Đáp án A.
Trong các hợp chất, số oxi hóa lần lượt là:
Câu 8:
Cho sơ đồ phản ứng:
Biết khi cân bằng tỉ lệ số mol giữa N2O và N2 là 3: 2.
Tỉ lệ mol lần lượt là :
 Xem đáp án
Xem đáp án
Đáp án D.
Pt sau cân bằng:
Câu 9:
Cho sơ đồ phản ứng :
Hệ số của HNO3 sau khi cân bằng là (biết tỉ lệ số mol giữa N2O và N2 là 3: 2)
 Xem đáp án
Xem đáp án
Đáp án C.
Ta có: tỉ lệ số mol giữa N2O và N2 là 3: 2
Pt sau cân bằng: 44Al + 162HNO3 44Al(NO3)3 + 6N2 + 9N2O + 81H2O.
Câu 10:
Cho các chất và ion sau : Zn; Cl2; FeO; Fe2O3; SO2; H2S; Fe2+ ; Cu2+ ; Ag+. Số lượng chất và ion vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa là:
 Xem đáp án
Xem đáp án
Đáp án D.
Chất và ion vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa là: Cl2, FeO, SO2, Fe2+.
Câu 11:
Cho sơ đồ phản ứng :
aFeS + bH+ + cNO3- → Fe3+ + SO42- + NO + H2O
Sau khi cân bằng, tổng hệ số a + b + c là (biết hệ số của phản ứng là các số nguyên, tối giản)
 Xem đáp án
Xem đáp án
Đáp án D.
FeS + 4H+ + 3NO3- → Fe3+ + SO42- + 3NO + 2H2O
Tổng hệ số a + b + c = 1 + 4 + 3= 8
Câu 12:
Hòa tan hết 1,84 gam hỗn hợp Cu và Fe trong dung dịch HNO3 dư, thu được 0,01 mol NO và 0,04 mol NO2. Số mol Fe và Cu trong hỗn hợp ban đầu lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án B.
Gọi nCu = y, nFe = x mol
Áp dụng định luật bảo toàn e ta có: 3x+2y = 0,07 (1)
Khối lượng hai kim loại = 1,84 g: 56x+64y = 1,84 (2).
Giải 1,2 ta có: x = 0,01, y = 0,02 (mol)
Câu 13:
Cho dãy các chất và ion : Cl2, F2, SO2, Na+, Ca2+, Fe2+, Al3+, Mn2+, S2-, Cl-. Số chất và ion trong dãy đều có tính oxi hoá và tính khử là:
 Xem đáp án
Xem đáp án
Đáp án B.
Chất và ion vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa là: Cl2, SO2, Fe2+, Mn2+.
Câu 14:
Cho m gam Cu phản ứng hết với dung dịch HNO3 thu được 8,96 lít (đktc) hỗn hợp khí NO và NO2 có tỉ khối đối với H2 là 19. Giá trị của m là:
 Xem đáp án
Xem đáp án
Đáp án A.
Gọi
Ta có: (1)
Giải 1,2 ta có mol
Bảo toàn e: 2y = 0,8 => y = 0,4 (mol). => mCu = 0,4.64 = 25,6 (g).
Câu 15:
Cho từng chất : Fe, FeO, Fe(OH)2, Fe3O4, Fe2O3, Fe(NO3)3, Fe(NO3)2, FeSO4, Fe2(SO4)3, FeCO3 lần lượt phản ứng với HNO3 đặc nóng. Số lượng phản ứng thuộc loại phản ứng oxi hoá – khử là:
 Xem đáp án
Xem đáp án
Đáp án D.
Phản ứng thuộc loại phản ứng oxi hoá – khử xảy ra giữa HNO3 với lần lượt các chất: Fe, FeO, Fe(OH)2, Fe3O4, Fe(NO3)2, FeSO4, FeCO3. (Hợp chất mà trong đó Fe chưa đạt số oxi hóa cao nhất là +3).
Câu 16:
Xét phản ứng sau:
Phản ứng (1), (2) thuộc loại phản ứng :
 Xem đáp án
Xem đáp án
Đáp án C.
Sự thay đổi số oxi hóa xảy ra chỉ trên 1 nguyên tố là phản ứng tự oxi hóa – khử.
Câu 17:
Hòa tan 4,59 gam Al bằng dung dịch HNO3 dư thu được hỗn hợp khí NO và N2O có tỉ khối hơi đối với hiđro bằng 16,75 (ngoài ra không có sản phẩm khử nào khác). Thể tích (đktc) NO và N2O thu được lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án B
Gọi số mol NO và N2O lần lượt là x và y mol
Theo bài ra:
(1)
Bảo toàn electron có:
Từ (1) và (2) có x = 0,09 và y = 0,03
Vậy VNO = 0,09.22,4 = 2,016 lít
Câu 18:
Cho các phản ứng oxi hoá – khử sau:
Trong số các phản ứng oxi hoá – khử trên, số phản ứng oxi hoá – khử nội phân tử là:
 Xem đáp án
Xem đáp án
Đáp án C
Phản ứng oxi hóa khử nội phân tử là phản ứng mà sự thay đổi số oxi hóa xảy ra tại các nguyên tố trong cùng 1 phân tử. Các phản ứng oxi hóa – khử nội phân tử là: 2, 5, 7, 10
Câu 19:
Cho các phản ứng oxi hoá – khử sau :
(1) 3I2 + 3H2O HIO3 + 5HI
(2) 2HgO → 2Hg + O2
(3) 4K2SO3 → 3K2SO4 + K2S
(4) NH4NO3 → N2O + 2H2O
(5) 2KClO3 → 2KCl + 3O2
(6) 3NO2 + H2O → 2HNO3 + NO
(7) 4HClO4 → 2Cl2 + 7O2 + 2H2O
(8) 2H2O2 → 2H2O + O2
(9) Cl2 + Ca(OH)2 → CaOCl2 + H2O
(10) 2KMnO4 → K2MnO4 + MnO2 + O2
Trong số các phản ứng oxi hoá – khử trên, số phản ứng tự oxi hoá – khử là :
 Xem đáp án
Xem đáp án
Đáp án A
- Phản ứng tự oxi hóa – tự khử là phản ứng trong đó sự tăng giảm số oxi hóa xảy ra trên cùng một nguyên tố. Các phản ứng tự oxi hóa – tự khử là: 1, 3, 4, 6, 8, 9.
Câu 20:
Cho sơ đồ phản ứng:
Cu2S+HNO3→Cu(NO3)2+H2SO4+NO2+H2O
Hệ số cân bằng của Cu2S và HNO3 trong phản ứng là:
 Xem đáp án
Xem đáp án
Đáp án B.
Cu2S + 14HNO3 → 2Cu(NO3)2 + H2SO4 + 10NO2 + 6H2O
Câu 21:
Hoà tan 2,64 gam hỗn hợp Fe và Mg bằng dung dịch HNO3 loãng, dư, chỉ thu được sản phẩm khử là 0,896 lít (đktc) hỗn hợp khí gồm NO và N2, có tỉ khối so với H2 bằng 14,75. % theo khối lượng của sắt trong hỗn hợp ban đầu là
 Xem đáp án
Xem đáp án
Đáp án C.
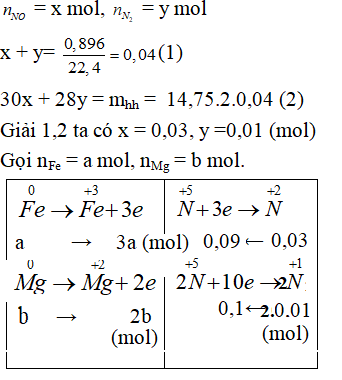
Ta có: (Bảo toàn e).
Giải (*), (**): mol
Câu 22:
Có phản ứng:
X HNO3 Fe(NO3)3 + NO + H2O
Số chất X có thể thực hiện phản ứng trên là:
 Xem đáp án
Xem đáp án
Đáp án C
X là các hợp chất của Fe+2: Fe(NO3)2, FeO, Fe(OH)2 và Fe0, Fe3O4
Câu 23:
Cho sơ đồ phản ứng:
 Xem đáp án
Xem đáp án
Đáp án A.
Ta có các quá trình:
Fe3O4 là chất bị oxi hóa, HNO3 vừa là môi trường vừa là chất bị khử.
Cứ 28 phân tử HNO3 tham gia phản ứng chỉ có 1 phân tử đóng vai trò là chất bị khử, 27 phân tử còn lại đóng vai trò là môi trường.
