Trắc nghiệm tổng hợp Hóa 10 Chủ đề 2: Bảng tuần hoàn các nguyên tố hóa học có đáp án
Trắc nghiệm Hóa 10 Dạng 1. Câu hỏi lí thuyết Bảng tuần hoàn các nguyên tố hóa học có đáp án
-
1685 lượt thi
-
50 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
Nguyên tố X có số thứ tự ô là 20. Xác định chu kì, nhóm của X trong bảng tuần hoàn các nguyên tố hóa học?
 Xem đáp án
Xem đáp án
Cấu hình electron nguyên tử X: 1s22s22p63s23p64s2 hay [Ar]4s2.
Vậy X ở chu kì 4 do có 4 lớp electron; nhóm IIA do 2 electron hóa trị, nguyên tố s.
Câu 2:
Nguyên tố R có số hiệu nguyên tử bằng 15. Vị trí của R trong bảng tuần hoàn các nguyên tố hóa học là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cấu hình electron nguyên tử R: 1s22s22p63s23p3.
Vậy R thuộc:
+ Ô 15 (do số hiệu nguyên tử là 15).
+ Chu kì 3 (do có 3 lớp electron).
+ Nhóm VA (do có 5 electron hóa trị, nguyên tố p).
Câu 3:
Nguyên tố X thuộc chu kì 3, nhóm VIA. Cấu hình electron của nguyên tử X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
X ở chu kì 3 nên có 3 lớp electron;
X ở nhóm VIA nên có 6 electron ở lớp ngoài cùng.
Cấu hình electron của X là: 1s22s22p63s23p4.
Câu 4:
Số nguyên tố trong chu kì 3 và chu kì 5 lần lượt là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Chu kì 3 có 8 nguyên tố; chu kì 5 có 18 nguyên tố.
Câu 5:
Chu kì là tập hợp các nguyên tố, mà nguyên tử của các nguyên tố này có cùng
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Chu kì là tập hợp các nguyên tố hóa học mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp thành từng hàng theo chiều tăng dần của điện tích hạt nhân từ trái qua phải.
Câu 6:
Nhận định nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Trong chu kì, các nguyên tố được xếp theo chiều điện tích hạt nhân tăng dần.
Nhận định C sai vì nhóm là tập hợp các nguyên tử có cấu hình electron tương tự nhau.
Nhận định D sai vì đầu chu kì 1 là phi kim hydrogen.
Câu 7:
Các nguyên tố nhóm B trong bảng tuần hoàn là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Các nguyên tố nhóm B trong bảng tuần hoàn là các nguyên tố d và các nguyên tố f.
Câu 8:
Ion X2+ có 10 electron. Trong bảng tuần hoàn, X thuộc ô số
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
X → X2+ + 2e
Vậy số electron của X là 10 + 2 = 12.
Trong bảng tuần hoàn X thuộc ô số 12.
Câu 9:
Cấu hình electron nào sau đây của nguyên tố phi kim?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Loại A do là khí hiếm He.
Loại B do là kim loại (nguyên tố d).
Loại C do là khí hiếm (có 8 electron ở lớp ngoài cùng).
Chọn D là phi kim (có 7 electron ở lớp ngoài cùng).
Câu 10:
Ở trạng thái cơ bản, nguyên tử của nguyên tố R có 3 lớp electron và có 3 electron ở phân lớp ngoài cùng. Số hiệu nguyên tử của R là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cấu hình electron nguyên tử R: 1s22s22p63s23p3
⇒ Số hiệu nguyên tử R = số electron = 15.
Câu 11:
Nhóm nào sau đây có tính phi kim và có cấu hình electron lớp ngoài cùng dạng ns2np5?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Nhóm halogen có cấu hình electron lớp ngoài cùng dạng ns2np5.
Câu 12:
Nguyên tử nguyên tố X có tổng các electron trên phân lớp p là 7. Vậy X thuộc loại nguyên tố nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
X có tổng các electron trên phân lớp p là 7 nên cấu hình electron của X như sau:
1s22s22p63s23p1.
Vậy X thuộc nguyên tố p.
Câu 13:
Nguyên tử nguyên tố X có cấu hình electron như sau: [Ne]3s23p1. Số electron lớp ngoài cùng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Lớp ngoài cùng là lớp thứ 3, số electron trên lớp thứ 3 là 3 electron.
Câu 14:
Nguyên tố A có số hiệu nguyên tử là 18, vị trí của A trong bảng tuần hoàn là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cấu hình electron nguyên tử A: 1s22s22p63s23p6.
Vậy A ở chu kì 3 do có 3 lớp electron; nhóm VIIIA do có 8 electron hóa trị, nguyên tố p.
Câu 15:
Ion Y- có cấu hình electron 1s22s22p63s23p6. Vị trí của Y trong bảng tuần hoàn (chu kì, nhóm) là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Y + 1e → Y-
Vậy cấu hình electron của Y là: 1s22s22p63s23p5
Vậy Y ở chu kì 3 (do có 3 lớp electron), nhóm VIIA (do 7 electron hóa trị, nguyên tố p).
Câu 16:
Cation R+ có cấu hình electron 1s22s22p63s23p6. Vị trí của nguyên tố R trong bảng tuần hoàn các nguyên tố hóa học là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
R → R+ + 1e
Cấu hình electron nguyên tử R là: 1s22s22p63s23p64s1.
Vậy R ở chu kì 4 (do có 4 lớp electron); nhóm IA (do có 1 electron hóa trị, nguyên tố s).
Câu 17:
X có cấu hình e ở phân lớp ngoài cùng là 3d34s2. X thuộc
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
X thuộc chu kì 4 do có 4 lớp electron; nhóm VB do có 5 electron hóa trị, nguyên tố d.
Câu 18:
Các nguyên tố thuộc cùng một nhóm A trong bảng tuần hoàn sẽ có cùng
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Các nguyên tố thuộc cùng một nhóm A trong bảng tuần hoàn sẽ có cùng hóa trị cao nhất với oxygen.
Câu 19:
Nguyên tử của nguyên tố X có electron cuối cùng được điền vào phân lớp 4s1. Nguyên tử của nguyên tố Y có electron cuối cùng được điền vào phân lớp 3p3. Số proton của X và Y lần lượt là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cấu hình electron của X: 1s22s22p63s23p64s1
⇒ Số proton của X = số electron = 19.
Cấu hình electron của Y: 1s22s22p63s23p3
⇒ Số proton của Y = số electron = 15.
Câu 20:
Cho biết số hiệu nguyên tử của các nguyên tố X và Y lần lượt là ZX = 13, ZY = 17. Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cấu hình electron nguyên tử X: 1s22s22p63s23p1
⇒ X là kim loại do có 3 electron ở lớp ngoài cùng.
Cấu hình electron nguyên tử Y: 1s22s22p63s23p5
⇒ Y là phi kim do có 7 electron ở lớp ngoài cùng.
Câu 21:
Một nguyên tố hóa học X ở chu kì 3, nhóm VA. Cấu hình electron của nguyên tử X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
X ở chu kì 3 nên có 3 lớp electron; X thuộc nhóm VA nên có 5 electron ở lớp ngoài cùng.
Cấu hình electron nguyên tử X: 1s22s22p63s23p3.
Câu 22:
Nguyên tố hóa học calcium (kí hiệu Ca) có số hiệu nguyên tử là 20, thuộc chu kì 4, nhóm IIA. Phát biểu nào sau đây về calcium là sai?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phát biểu A đúng: Ca có số electron = số hiệu nguyên tử = 20.
Phát biểu B đúng: Ca ở chu kì 4 nên có 4 lớp electron; Ca ở nhóm IIA nên lớp ngoài cùng có 2 electron.
Phát biểu C đúng: Nguyên tử Ca có số proton = số electron = 20.
Phát biểu D sai: Ca là một kim loại do ở nhóm IIA, có 2 electron ở lớp ngoài cùng.
Câu 23:
Nguyên tố X có số hiệu nguyên tử bằng 15. Hydroxide cao nhất của nó có tính chất gì?
Câu 24:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Li (Z = 3): 1s22s1 ⇒ Li thuộc chu kì 2, nhóm IA.
O (Z = 8): 1s22s22p4 ⇒ O thuộc chu kì 2, nhóm VIA.
F (Z = 9): 1s22s22p5 ⇒ F thuộc chu kì 2, nhóm VIIA.
Na (Z = 11): 1s22s22p63s1 ⇒ Na thuộc chu kì 3, nhóm IA.
Ta có:
+ Li và Na thuộc cùng nhóm IA, theo quy luật biến đổi bán kính ta có bán kính Na > Li.
+ Li, O, F thuộc cùng chu kì 2, theo quy luật biến đổi bán kính ta có bán kính Li > O > F.
Vậy chiều tăng dần bán kính nguyên tử từ trái sang phải là: F, O, Li, Na.
Câu 25:
Trong bảng tuần hoàn, M ở nhóm IIIA, X ở nhóm VA còn Y ở nhóm VIA. Oxide cao nhất của M, X, Y có công thức là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Trong công thức oxide cao nhất RxOy, hóa trị của nguyên tố R bằng số thứ tự của nhóm A.
Oxide cao nhất của M, X, Y có công thức lần lượt là: M2O3, X2O5, YO3.
Câu 26:
Bán kính của các nguyên tử 12Mg, 19K và 17Cl giảm theo thứ tự là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Mg (Z = 12): 1s22s22p63s2 ⇒ Mg ở chu kì 3, nhóm IIA.
K (Z = 19): 1s22s22p63s23p64s1 ⇒ K ở chu kì 4, nhóm IA.
Cl (Z = 17): 1s22s22p63s23p5 ⇒ Cl ở chu kì 3, nhóm VIIA.
Lấy thêm Na ở chu kì 3, nhóm IA làm mốc so sánh.
Ta có:
+ Na, Mg, Cl thuộc cùng chu kì 3, theo quy luật biến đổi bán kính có bán kính Na > Mg > Cl.
+ Na và K thuộc cùng nhóm IA, theo quy luật biến đổi bán kính có bán kính K > Na.
Vậy bán kính K > Na > Mg > Cl hay bán kính K > Mg > Cl.
Câu 27:
Nguyên nhân của sự biến đổi tuần hoàn tính chất các nguyên tố là sự biến đổi tuần hoàn
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nguyên nhân của sự biến đổi tuần hoàn tính chất các nguyên tố là sự biến đổi tuần hoàn
cấu hình electron lớp ngoài cùng của nguyên tử.
Câu 28:
Nguyên tố nào trong số các nguyên tố sau đây có công thức oxide cao nhất ứng với công thức R2O3?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
|
Nguyên tố |
Mg |
Al |
Si |
P |
|
Công thức oxide cao nhất |
MgO |
Al2O3 |
SiO2 |
P2O5 |
Câu 29:
Công thức oxide cao nhất của nguyên tố 17R là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Cấu hình electron nguyên tử R: 1s22s22p63s23p5
R thuộc nhóm VIIA, công thức oxide cao nhất của R là R2O7.
Câu 30:
Trong cùng một chu kỳ, theo chiều từ trái qua phải, hoá trị cao nhất của nguyên tố đối với oxygen
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Trong cùng một chu kỳ, theo chiều từ trái qua phải, hoá trị cao nhất của nguyên tố đối với oxygen tăng dần.
Câu 31:
Độ âm điện của các nguyên tố biến đổi như thế nào trong bảng hệ thống tuần hoàn?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Độ âm điện là đại lượng đặc trưng cho khả năng hút electron khi hình thành liên kết hóa học.
Độ âm điện của các nguyên tố trong bảng hệ thống tuần hoàn biến đổi tương tự giống tính phi kim.
Câu 32:
Phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Dựa vào quy luật biến đổi tính kim loại, tính phi kim xác định được kim loại mạnh nhất là francium, phi kim mạnh nhất là fluorine.
Câu 33:
Nguyên tố R trong hợp chất khí với hydrogen có dạng RH2 thì công thức oxide cao nhất của R là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Theo bài ra xác định được R thuộc nhóm VIA, hóa trị cao nhất của R với oxygen là VI.
Công thức oxide cao nhất của R là RO3.
Câu 34:
Cho các nguyên tố 4Be, 11Na, 12Mg, 19K. Tính base của các hydroxide được xếp theo thứ tự:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Be (Z = 4): 1s22s2 ⇒ Be thuộc chu kì 2, nhóm IIA.
Na (Z = 11): 1s22s22p63s1 ⇒ Na thuộc chu kì 3, nhóm IA.
Mg (Z = 12): 1s22s22p63s2 ⇒ Mg thuộc chu kì 3, nhóm IIA.
K (Z = 19): 1s22s22p63s23p64s1 ⇒ K thuộc chu kì 4, nhóm IA.
Ta có:
Be và Mg thuộc cùng nhóm IIA, theo quy luật biến đổi có tính kim loại Mg > Be.
Na và K thuộc cùng nhóm IA, theo quy luật biến đổi có tính kim loại K > Na.
Na và Mg thuộc cùng chu kì 3, theo quy luật biến đổi có tính kim loại Na > Mg.
Vậy chiều tăng dần tính kim loại: Be < Mg < Na < K.
Chiều tăng dần tính base của các hydroxide: Be(OH)2 < Mg(OH)2 < NaOH < KOH.
Chú ý: Tính base của các hydroxide biến thiên cùng chiều với tính kim loại.
Câu 35:
Nguyên tố R thuộc chu kì 3, nhóm VIIA của bảng tuần hoàn các nguyên tố hóa học. Công thức oxide cao nhất của R là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
R thuộc nhóm VIIA nên R có hóa trị VII trong hợp chất oxide cao nhất.
Công thức oxide cao nhất của R là: R2O7.
Câu 36:
Hydroxide nào có tính acid mạnh nhất trong các hydroxide sau đây? Cho biết hợp chất này được dùng để phân hủy các quặng phức tạp; phân tích khoáng vật hoặc làm chất xúc tác.
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Silicic acid: H2SiO3
Sulfuric acid: H2SO4
Phosphoric acid: H3PO4
Perchloric acid: HClO4.
Ta có Si, P, S, Cl thuộc cùng chu kì 3. Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính acid của các hydroxide tương ứng tăng dần.
Vậy tính acid: H2SiO3 < H3PO4 < H2SO4 < HClO4.
Câu 37:
Cho các nguyên tử X, Y, T, R cùng chu kỳ và thuộc nhóm A trong bảng tuần hoàn hóa học. Bán kính nguyên tử như hình vẽ:
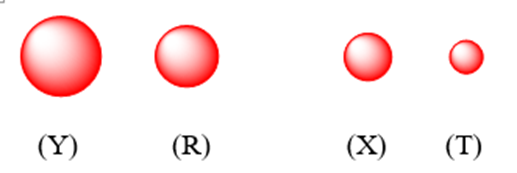
Nguyên tố có độ âm điện lớn nhất là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Độ âm điện là đại lượng đặc trưng cho khả năng hút electron khi hình thành liên kết hóa học.
Nguyên tử có bán kính càng nhỏ, độ âm điện càng lớn.
Vậy T có độ âm điện lớn nhất.
Câu 38:
Hợp chất oxide cao nhất của R có công thức RO3. Nguyên tố R có thể là trường hợp nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Hợp chất oxide cao nhất của R có công thức RO3 nên R có hóa trị cao nhất là VI, hay R thuộc nhóm VIA.
Vậy R là sulfur.
Câu 39:
Trong một nhóm A của bảng tuần hoàn, đi từ trên xuống dưới thì điều khẳng định nào đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Trong một nhóm A, theo chiều tăng của điện tích hạt nhân (chiều từ trên xuống dưới) bán kính nguyên tử tăng dần.
Câu 40:
Một nguyên tố R có cấu hình electron là 1s22s22p3 thì công thức hợp chất với hydrogen và oxide cao nhất là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
R có cấu hình electron là 1s22s22p3 ⇒ R thuộc nhóm VA.
⇒ Hóa trị của R trong oxide cao nhất là V; hóa trị của R trong hợp chất khí với H là III.
Công thức hợp chất với hydrogen và oxide cao nhất là RH3 và R2O5.
Câu 41:
Các nguyên tố 12Mg, 13Al, 5B và 6C được sắp xếp theo thứ tự tăng dần độ âm điện là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Mg (Z = 12): 1s22s22p63s2 ⇒ Mg thuộc chu kì 3, nhóm IIA.
Al (Z = 13): 1s22s22p63s23p1 ⇒ Al thuộc chu kì 3, nhóm IIIA.
B (Z = 5): 1s22s22p1 ⇒ B thuộc chu kì 2, nhóm IIIA.
C (Z = 6): 1s22s22p2 ⇒ C thuộc chu kì 2, nhóm IVA.
Ta có:
+) Mg và Al thuộc cùng chu kì 3, theo quy luật biến đổi độ âm điện ta có độ âm điện Mg < Al.
+) B và C thuộc cùng chu kì 2, theo quy luật biến đổi độ âm điện ta có độ âm điện B < C.
+) B và Al thuộc cùng nhóm IIIA, theo quy luật biến đổi độ âm điện ta có độ âm điện B > Al.
Vậy chiều tăng dần độ âm điện là: Mg < Al < B < C.
Câu 42:
Nguyên tố X có công thức oxide cao nhất là X2O5. Vậy công thức của X với hydrogen là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Nguyên tố X có công thức oxide cao nhất là X2O5 ⇒ hóa trị của X trong oxide cao nhất là V; X thuộc nhóm VA.
Vậy hóa trị của X trong hợp chất với H là III, công thức hợp chất của X với H là XH3.
Câu 43:
Nguyên tử của nguyên tố R có cấu hình electron là 1s22s22p63s23p4. R có công thức oxide cao nhất là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Nguyên tử của nguyên tố R có cấu hình electron là 1s22s22p63s23p4 nên R thuộc nhóm VIA. Hóa trị của R trong oxide cao nhất là VI.
Vậy công thức oxide cao nhất của R là RO3.
Câu 44:
Acid nào sau đây mạnh nhất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Ta có: Si, P, S, Cl cùng thuộc chu kì 3 trong bảng tuần hoàn.
Theo quy luật biến đổi tính chất ta có tính acid: H2SiO3 < H3PO4 < H2SO4 < HClO4.
Vậy trong 4 acid trên HClO4 có tính acid mạnh nhất.
Câu 45:
Hydroxide nào sau đây mạnh nhất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Ta có:
+) Na, Mg, Al cùng thuộc chu kì 3, theo quy luật biến đổi tính hydroxide ta có tính hydroxide: NaOH > Mg(OH)2 > Al(OH)3.
+) Be và Mg cùng thuộc nhóm IIA, theo quy luật biến đổi tính hydroxide ta có tính hydroxide: Mg(OH)2 > Be(OH)2.
Vậy trong 4 hydroxide trên, NaOH có tính base mạnh nhất.
Câu 46:
Độ âm điện của các nguyên tố: Na, Mg, Al, Si được xếp theo chiều tăng dần là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Ta có các nguyên tố Na, Mg, Al, Si cùng thuộc chu kì 3 của bảng tuần hoàn.
Dựa trên quy luật biến đổi độ âm điện có độ âm điện: Na < Mg < Al < Si.
Câu 47:
Phân lớp ngoài cùng của hai nguyên tử A, B lần lượt là 3p và 4s; biết tổng số electron của hai phân lớp đó bằng 7 và phân lớp 4s của nguyên tử B chưa bão hòa electron. Nhận định nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Do phân lớp 4s của B chưa bão hòa electron nên B có 1 electron ở phân lớp 4s ⇒ B là kim loại (do có 1 electron ở lớp ngoài cùng).
Số electron trên phân lớp 3p của A là : 7 – 1 = 6.
Cấu hình electron của A là: 1s22s22p63s23p6.
Vậy A là khí hiếm do có 8 electron ở lớp ngoài cùng.
Câu 48:
Ion có cấu hình electron tương tự của Ar là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Ca (Z = 20): 1s22s22p63s23p64s2 hay [Ar]4s2.
Ca → Ca2+ + 2e
Vậy Ca2+ có cấu hình electron tương tự khí hiếm Ar.
Câu 49:
Các electron của nguyên tử nguyên tố X được phân bố trên 3 lớp, lớp thứ ba có 6 electron. Số đơn vị điện tích hạt nhân của nguyên tử nguyên tố X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Cấu hình electron của X là: 1s22s22p63s23p4.
Vậy số đơn vị điện tích hạt nhân của X = số electron = 16.
Câu 50:
Nguyên tử của nguyên tố nào sau đây luôn luôn nhường 1 electron trong các phản ứng hóa học?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Na (Z = 11): 1s22s22p63s1
Na có 1 electron ở lớp ngoài cùng, luôn luôn có xu hướng nhường đi 1 electron khi tham gia các phản ứng hóa học.
