15 câu trắc nghiệm Luyện tập: Thành phần nguyên tử cực hay (có đáp án)
-
823 lượt thi
-
15 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Hạt X và Y có cấu tạo như sau:
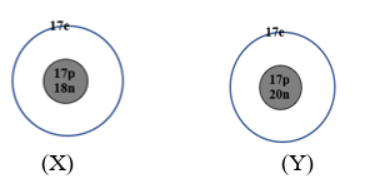
Phát biểu nào sau đây về X và Y là đúng?
 Xem đáp án
Xem đáp án
Đáp án A
Hạt X và Y có cùng số proton và khác nhau về số nơtron nên là đồng vị của cùng một nguyên tố hóa học
Câu 2:
Một nguyên tố X có 2 đồng vị là và . Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án B
Số khối của là
Số khối của là
Lấy có
Câu 3:
Trong các phát biểu sau đây, phát biểu nào đúng?
 Xem đáp án
Xem đáp án
Đáp án D
A sai vì theo mô hình nguyên tử của tôm - sơn nguyên tử gồm các hạt điện tích dương xen kẽ các hạt điện tích âm.
B sai vì sự kết hợp một hạt proton và một hạt electron không tạo thành nơtron.
C sai vì khối lượng của proton hoặc nơtron lớn hơn khối lượng của electron khoảng 1840 lần.
Câu 4:
Nguyên tử A có tổng số hạt mang điện và hạt không mang điện là 28, trong đó số hạt mang điện gấp 1,8 lần số hạt không mang điện. A là
 Xem đáp án
Xem đáp án
Đáp án C
Gọi các hạt proton, nơtron và electron trong A là p, n và e (trong đó p = e)
Tổng số hạt mang điện trong nguyên tử A là 28 → p + e + n = 28
Hay 2p + n = 28 (1)
Trong nguyên tử, số hạt mang điện gấp 1,8 lần số hạt không mang điện nên:
p + e = 1,8n hay 2p – 1,8n = 0 (2)
Từ (1) và (2) có p = 9 và n = 10.
Vậy A là flo (F).
Câu 5:
Trong tự nhiên tìm được hai đồng vị của nguyên tố X. Khảo sát cho thấy cứ 100 nguyên tử của X thì có 73 nguyên tử . Biết rằng nguyên tử khối trung bình của X là 63,546, số khối của đồng vị còn lại là
 Xem đáp án
Xem đáp án
Đáp án B
Đặt số khối của đồng vị còn lại là x
Theo đề bài ta có:
Câu 6:
Cho biết:
| Nguyên tố | Đồng vị | Khối lượng nguyên tử trung bình |
| Brom | 79,90 | |
| Li | 6,94 |
Phát biểu nào sau đây là sai?
 Xem đáp án
Xem đáp án
Đáp án C
Sai vì ít gặp trong tự nhiên
Câu 7:
Thực nghiệm chỉ ra rằng các nguyên tử bền có tỉ lệ số nơtron/số proton nằm trong khoảng (trừ trường hợp nguyên tử H). Một nguyên tử X bền có tổng số hạt (proton, nơtron, electron) là 13. X là nguyên tử của nguyên tố nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án B
Ta có:
.
Đó là nguyên tử của nguyên tố beri
Câu 8:
Hợp chất Z được tạo bởi hai nguyên tố X và Y có công thức trong đó Y chiếm 72,73% về khối lượng. Biết rằng trong phân tử Z, tổng số hạt (proton, nơtron, electron) là 66, số proton là 22. Nguyên tố Y là
 Xem đáp án
Xem đáp án
Đáp án A
Gọi số hạt proton, nơtron của X là , số hạt proton, nơtron của Y là
Theo đề ta có:
Vậy: Y là oxi và X là cacbon
Giá trị thỏa mãn các phương trình.
Câu 9:
Oxit X có công thức . Tổng số hạt cơ bản (p, n, e) trong X là 92, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 28. X là chất nào dưới đây (biết rằng trong hạt nhân nguyên tử oxi có 8 proton và 8 nơtron)?
 Xem đáp án
Xem đáp án
Đáp án B
Tổng số hạt cơ bản (p, n, e) trong X là 92
X có số hạt mạng điện nhiều hơn số hạt không mang điện là 28
Giải hệ R là na
Câu 10:
Ở 20oCkhối lượng riêng của Au là Trong tinh thể Au, các nguyên tử Au là những hình cầu chiếm 75% thể tích toàn khối tinh thể, phần còn lại là các khe rỗng giữa các quả cầu. Khối lượng mol của Au là 196,97. Bán kính nguyên tử gần đúng của Au ở là
 Xem đáp án
Xem đáp án
Đáp án B
Giả sử trong 1 mol Au.
Thể tích thực của Au là:
Thể tích 1 nguyên tử Au là:
Bán kính:
Câu 11:
Tổng số proton, nơtron, electron trong nguyên tử của hai nguyên tố X và M lần lượt là 52 và 82. M và X tạo hơp chất , trong phân tử của hợp chất đó tổng số proton của các nguyên tử là 77. Xác định công thức của . Biết trong X có tỉ
 Xem đáp án
Xem đáp án
Đáp án A
Kí hiệu số proton, nơtron, electron trong nguyên tố X là Z, N, E
Theo đầu bài ta có: Z + N + E = 52 → 2Z + N = 52
Với những nguyên tố bền (trừ hiđro): Z ≤ N ≤ 1,52 Z
→ 3Z ≤ 2Z+ N ≤ 1,52Z + 2Z
→ 3Z ≤ 52 ≤ 3,52Z → 14,77 ≤ Z ≤ 17,33
Với Z = 15 → N = 22; tỉ lệ N: Z = 22 : 15 = 1,47 > 1,22 (loại)
Với Z = 16 → N = 20; tỉ lệ N: Z = 20 : 16 = 1,25 > 1,22 (loại)
Với Z = 17 → N = 18; tỉ lệ N: Z = 18 : 17 = 1,06. X là clo
Kí hiệu số p, n, e của M là Z’, N’, E’
Theo đầu bài ta có: 2Z’ + N’ = 82 → 3Z' < 82 < 3,52Z'
Ta có Z’ = 77 – 17a
mà a nguyên là Fe.
Công thức của hợp chất là
Câu 12:
Một loại khí X có chứa 2 đồng vị . Cho Cl2 tác dụng với H2 rồi lấy sản phẩm hoà tan vào nước thu được dung dịch X. Chia dung dịch X thành hai phần bằng nhau:
- Phần thứ nhất cho tác dụng vừa đủ với 125 ml dung dịch Ba(OH)2 0,88M.
- Phần thứ hai cho tác dụng với AgNO3 vừa đủ ta thu được 31,57 gam kết tủa.
Thành phần % số nguyên tử của mỗi đồng vị lần lượt là?
 Xem đáp án
Xem đáp án
Đáp án D
Gọi phần trăm số nguyên tử của là x, là (100 – x).
Vậy thành phần phần trăm mỗi loại đồng vị của clo là : (75% ); (25%).
Câu 14:
Nguyên tử X có chứa 13 hạt electron và 14 hạt nơtron. Kí hiệu của nguyên tử X là
 Xem đáp án
Xem đáp án
Đáp án C
Số hiệu nguyên tử (Z) = số proton = số electron = 13.
Số khối (A) = số proton + số nơtron = 27.
Kí hiệu nguyên tử :
Câu 15:
Cho những nguyên tử của các nguyên tố sau:
Những nguyên tử nào sau đây là đồng vị của nhau ?
 Xem đáp án
Xem đáp án
Đáp án C
Các nguyên tử 1, 2 và 3 có cùng số proton nhưng khác nhau số nơtron nên là đồng vị của cùng một nguyên tố hóa học
