50 câu trắc nghiệm Phản ứng oxi hóa - khử nâng cao (P2) (có đáp án)
-
1148 lượt thi
-
25 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Cho phản ứng:
Fe3O4 + HNO3(loãng) → …..
Tỉ lệ giữa số phân tử Fe3O4 với số HNO3 đóng vai trò môi trường là:
 Xem đáp án
Xem đáp án
Đáp án C.
3Fe3O4 + 28HNO3loãng → 9Fe(NO3)3 + NO + 14H2O
Trong 28 phân tử HNO3 tham gia phản ứng, có 1 phân tử HNO3 đóng vai trò làm chất oxi hóa, 27 phân tử HNO3 đóng vai trò làm môi trường.
Tỉ lệ giữa số phân tử Fe3O4 với số HNO3 đóng vai trò môi trường = 3:27 =
Câu 2:
Hòa tan hoàn toàn hỗn hợp gồm 0,05 mol Ag và 0,03 mol Cu vào dung dịch HNO3 dư thu được hỗn hợp khí X gồm NO và NO2 có tỉ lệ mol tương ứng là 2 : 3. Thể tích khí X (đktc) là:
 Xem đáp án
Xem đáp án
Đáp án C.
Câu 3:
Hoà tan hoàn toàn a gam Al trong dd HNO3 loãng thấy thoát ra 44,8 lít hỗn hợp 3 khí NO, N2O và N2 có tỉ lệ mol tương ứng là 1:2:2. Giá trị của a là:
 Xem đáp án
Xem đáp án
Đáp án A.
Bảo toàn e ta có: 3x = 1,2 + 6,4 + 8 = 15,6 x =5,2 .
mAl = 5,2.27 = 140,4 (gam).
Câu 4:
Từ 2 phản ứng:
Cu + 2Fe3+ → Cu2+ +2Fe2+
Cu2+ + Fe → Cu + Fe2+
Có thể rút ra kết luận:
 Xem đáp án
Xem đáp án
Đáp án A.
Từ phản ứng: Cu + 2Fe3+ → Cu2+ + 2Fe2+
→ Tính oxi hóa của Fe3+ > Cu2+
Từ phản ứng: Fe + Cu2+ → Fe2+ + Cu
→ Tính oxi hóa của Cu2+ > Fe2+
Câu 5:
Cho phản ứng:
FeO + HNO3 → Fe(NO3)3 + NxOy + H2O
Sau khi cân bằng, hệ số của HNO3 là
 Xem đáp án
Xem đáp án
Đáp án D.
Ta có:
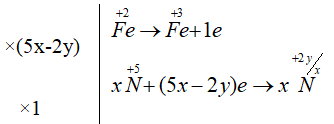
FeO + HNO3 → Fe(NO3)3 + NxOy + H2O
Câu 6:
Hòa tan hoàn toàn 13,0 gam Zn vào dung dịch HNO3 loãng, dư thu được dung dịch X và 0,448 lít khí N2 (đktc). Khối lượng muối trong dung dịch X là:
 Xem đáp án
Xem đáp án
Đáp án D.
nZn = 0,2 (mol),
Giả sử sản phẩm khử chỉ có N2.
Ta có: số mol e nhường = 0,4 > số mol e nhận = 0,2.
Vậy sản phẩm khử phải có NH4NO3.
Bảo toàn e ta có:
Câu 7:
Cho sơ đồ phản ứng : FeS2 + HNO3 Fe(NO3)3 + H2SO4 + NO + H2O
Sau khi cân bằng, tổng hệ số cân bằng của các chất trong phản ứng là:
 Xem đáp án
Xem đáp án
Đáp án B.
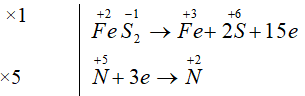
FeS2 + 8HNO3 → Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
Tổng hệ số cân bằng của các chất trong phản ứng là = 1 + 8+ 1+ 2+ 5 + 2= 19
Câu 8:
Cho 13,5 gam nhôm tác dụng vừa đủ với 2,5 lít dung dịch HNO3, phản ứng tạo ra muối nhôm và một hỗn hợp khí gồm NO và N2O (là sản phẩm khử, ngoài ra không còn sản phẩm khử nào khác). Tính nồng độ mol của dung dịch HNO3. Biết rằng tỉ khối của hỗn hợp khí đối với hiđro bằng 19,2.
 Xem đáp án
Xem đáp án
Chọn C
nAl = 0,5 mol
Bảo toàn e ta có:
Giải (1), (2) ta có:
Câu 9:
Cho 7,8 gam hỗn hợp X gồm Mg và Al tác dụng vừa đủ với 5,6 lít hỗn hợp khí Y (đktc) gồm Cl2 và O2 thu được 19,7 gam hỗn hợp Z gồm 4 chất. Phần trăm thể tích của oxi trong Y là:
 Xem đáp án
Xem đáp án
Đáp án C.
Ta có
Gọi
Ta có mol (1)
(2)
Giải (1) và (2) ta có x= 0,1 mol; y = 0,15 mol
Câu 10:
Cho 7,8 gam hỗn hợp X gồm Mg và Al tác dụng vừa đủ với 5,6 lít hỗn hợp khí Y (đktc) gồm Cl2 và O2 thu được 19,7 gam hỗn hợp Z gồm 4 chất. Phần trăm khối lượng của Al trong X là:
 Xem đáp án
Xem đáp án
Đáp án B.
Ta có
Gọi
Ta có
Giải (1), (2) ta có x = 0,1 mol; y = 0,15 mol
Gọi số mol Mg và Al lần lượt là a và b mol
Bảo toàn e ta có: 2a+3b=0,8 (**)
Giải (*) và (**), a=0,1, b=0,2 (mol)
Câu 11:
Cho phản ứng sau:
Na2SO3+KMnO4+KHSO4→Na2SO4+K2SO4+MnSO4+H2O
Sau khi cân bằng với hệ số là những số nguyên tối giản thì hệ số của K2SO4 là :
 Xem đáp án
Xem đáp án
Đáp án D.
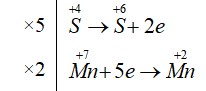
5Na2SO3+2KMnO4+6KHSO4→5Na2SO4+4K2SO4+2MnSO4+3H2O
Câu 12:
Trong những phản ứng sau đây, phản ứng nào là phản ứng oxi hóa – khử :
 Xem đáp án
Xem đáp án
Đáp án A.
Trong những phản ứng trên chỉ có phản ứng c), e), f) là những phản ứng oxi hóa - khử vì có sự thay đổi số oxi hóa của các nguyên tố.
Câu 13:
Cho sơ đồ phản ứng : Fe3O4 + HNO3 → Fe(NO3)3 + NxOy + H2O. Sau khi cân bằng, hệ số của phân tử HNO3 là:
 Xem đáp án
Xem đáp án
Đáp án C.
(5x-2y)Fe3O4 + (46x -18y)HNO3 (15x- 6y)Fe(NO3)3 + NxOy + (23x-9y)H2O
Câu 14:
Cho phương trình phản ứng sau:
C6H5C2H5+KMnO4→C6H5COOK+MnO2+K2CO3+KOH+H2O
Hệ số (là số nguyên tối giản) đứng trước chất bị khử khi phản ứng cân bằng là:
 Xem đáp án
Xem đáp án
Đáp án A.
KMnO4 là chất oxi hóa hay chất bị khử.
=> Hệ số cần tìm là 4.
Câu 15:
Cho phản ứng hoá học:
Cl2+KOH →KCl +KClO3+H2O
Tỉ lệ giữa số nguyên tử clo đóng vai trò chất oxi hoá và số nguyên tử clo đóng vai trò chất khử trong phương trình hoá học của phản ứng đã cho tương ứng là :
 Xem đáp án
Xem đáp án
Đáp án B.
Ta có:
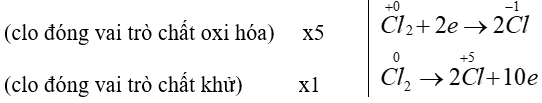
Câu 16:
Xét phản ứng :
Giá trị của x và y là:
 Xem đáp án
Xem đáp án
Đáp án D.
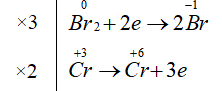
3Br2 + 2CrO2- + 8OH- 6Br- + 2CrO42- + 4H2O
Câu 17:
Cho 0,15 mol FexOy tác dụng với HNO3 đun nóng, thoát ra 0,05 mol NO. Công thức oxit sắt là
 Xem đáp án
Xem đáp án
Đáp án D.
Bảo toàn e ta có:
| X | 1 | 2 | 3 |
| Y | 1 | 2,5 (loại) | 4 |
| FeO |
Câu 18:
Cho phản ứng :
Số phân tử HNO3 đóng vai trò làm chất oxi hóa là?
 Xem đáp án
Xem đáp án
Đáp án B.
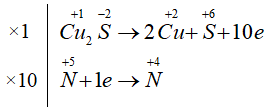
Cu2S + 14HNO3 → 2Cu(NO3)2 + H2SO4 + 10NO2 + 6H2O
Trong 14 phân tử HNO3 tham gia phản ứng, số phân tử HNO3 đóng vai trò làm chất oxi hóa là 10, còn 4 phân tử HNO3 đóng vai trò làm chất tạo môi trường.
Câu 19:
Cho biết các phản ứng xảy ra sau:
2FeBr2 + Br2 → 2FeBr3 (1) ;
2NaBr + Cl2 → 2NaCl + Br2 (2)
Phát biểu đúng là :
 Xem đáp án
Xem đáp án
Đáp án D.
Từ phương trình (2):
2NaBr + Cl2 → 2NaCl + Br2
ta suy ra tính oxi hóa của Cl2 mạnh hơn Br2.
Mặt khác từ (1):
2FeBr2 + Br2 → 2FeBr3
nên tính oxi hóa của Br2 mạnh hơn Fe3+.
Câu 20:
Cho phản ứng:
FeSO4 + K2Cr2O7 + H2SO4→ Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
Tổng hệ số cân bằng của chất oxi hóa và chất khử là:
 Xem đáp án
Xem đáp án
Đáp án C.
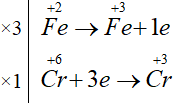
6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
Chất khử: FeSO4
Chất oxi hóa: K2Cr2O7
Tổng hệ số cân bằng của chất oxi hóa và chất khử = 6 + 1 = 7.
Câu 21:
Thực hiện các thí nghiệm sau:
(I) Sục khí SO2 vào dung dịch KMnO4.
(II) Sục khí SO2 vào dung dịch H2S.
(III) Sục hỗn hợp khí NO2 và O2 vào nước.
(IV) Cho MnO2 vào dung dịch HCl đặc, nóng.
(V) Cho Fe2O3 vào dung dịch H2SO4 đặc, nóng.
Số thí nghiệm có phản ứng oxi hoá - khử xảy ra là:
 Xem đáp án
Xem đáp án
Đáp án C.
Các phương trình oxi hóa khử là I, II, III, IV.
Các pt phản ứng xảy ra:
Câu 22:
Trong phản ứng:
Số phân tử HCl đóng vai trò chất khử bằng k lần tổng số phân tử HCl tham gia phản ứng. Giá trị của k là:
 Xem đáp án
Xem đáp án
Đáp án D.
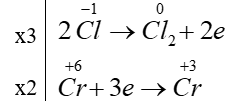
Số phân tử HCl đóng vai trò chất khử /tổng số phân tử HCl tham gia phản ứng
=
Câu 23:
Cho các phản ứng:
(a) Sn + HCl (loãng) →
(b) Fe + H2SO4 (loãng) →
(c) MnO2 + HCl (đặc) →
(d) Cu + H2SO4 (đặc) →
(e) FeSO4 + KMnO4 + H2SO4 →
Số phản ứng mà H của axit đóng vai trò chất oxi hoá là:
 Xem đáp án
Xem đáp án
Đáp án C.
Các phương trình: a,b.
(a)
Chất oxi hóa ( sự thay đổi số oxi hóa xảy ra tại H).
(b)
Chất oxi hóa (sự thay đổi số oxi hóa xảy ra tại H).
(c)
Chất khử (sự thay đổi số oxi hóa xảy ra tại Cl).
(d)
Chất oxi hóa (sự thay đổi số oxi hóa xảy ra tại S).
(e)
Môi trường
Câu 24:
Cho các phản ứng sau:
Số phản ứng trong đó HCl thể hiện tính khử là:
 Xem đáp án
Xem đáp án
Đáp án A.
Không thay đổi số oxi hóa
Chất khử
Chất oxi
Câu 25:
Hai kim loại X, Y và các dung dịch muối của chúng có các phản ứng hoá học sau:
(1) X + 2Y3+ → X2+ + 2Y2+
(2) Y + X2+ → Y2+ + X
Phát biểu đúng là:
 Xem đáp án
Xem đáp án
Đáp án D.
Từ phương trình 1 có: Tính oxi hóa của Y3+ > X2+
