Bài tập Liên kết ion có đáp án
-
165 lượt thi
-
17 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Hơn 50% dược phẩm sử dụng trong y tế được sản xuất dưới dạng muối với mục đích thúc đẩy sự hấp thu các dược chất vào máu, tăng cường hiệu quả điều trị. Trong đó, thường gặp nhất là các muối hydrochloride, sodium hoặc sulfate.
Muối thường là các hợp chất chứa liên kết ion. Liên kết ion là gì?

 Xem đáp án
Xem đáp án
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Câu 2:
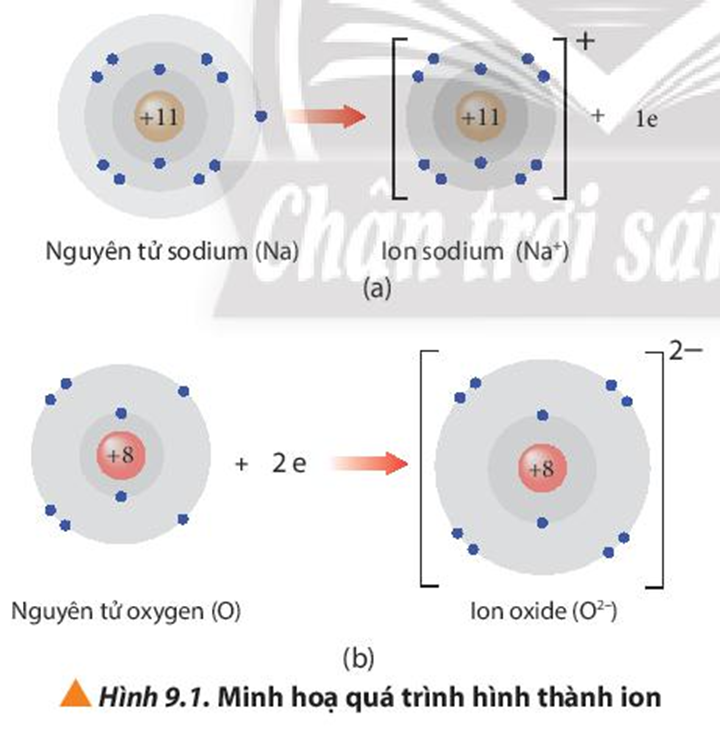
Quan sát Hình 9.1, nhận xét số electron trên lớp vỏ với số proton trong hạt nhân của mỗi ion tạo thành
 Xem đáp án
Xem đáp án
- Ion sodium: có 10 electron ở lớp vỏ ít hơn số proton trong hạt nhân là 11 proton.
- Ion oxide: có 10 electron ở lớp vỏ nhiều hơn số proton trong hạt nhân là 8 proton.
Câu 3:
Trình bày cách tính điện tích của các ion thu được khi nguyên tử nhường hoặc nhận thêm electron trong Hình 9.1
 Xem đáp án
Xem đáp án
Cách tích điện tích của ion thu được khi nguyên tử nhường hoặc nhận thêm electron:
Điện tích ion = số đơn vị điện tích hạt nhân – số electron của ion
- Ví dụ:
+ Ion sodium: điện tích = 11 – 10 = 1 ⇒ Điện tích là +1
+ Ion oxide: điện tích = 8 – 10 = -2 ⇒ Điện tích là -2
Câu 4:
Ion Na+ và ion O2- thu được có bền vững về mặt hóa học không? Chúng có cấu hình electron giống cấu hình electron nguyên tử của nguyên tố nào?
 Xem đáp án
Xem đáp án
- Ion Na+ có 10 electron ở lớp vỏ và có 2 lớp electron ⇒ Giống cấu hình electron nguyên tử của nguyên tố Ne ⇒ Bền vững về mặt hóa học.
- Ion O2- có 10 electron ở lớp vỏ và có 2 lớp electron ⇒ Giống cấu hình electron nguyên tử của nguyên tố Ne ⇒ Bền vững về mặt hóa học.
Câu 5:
Trong các nguyên tố kim loại và phi kim, nguyên tử của những nguyên tố nào có xu hướng tạo thành cation hoặc anion? Giải thích
 Xem đáp án
Xem đáp án
- Các nguyên tố kim loại dễ nhường electron ⇒ Tạo thành cation.
- Các nguyên tố phi kim dễ nhận electron ⇒ Tạo thành anion.
Câu 6:
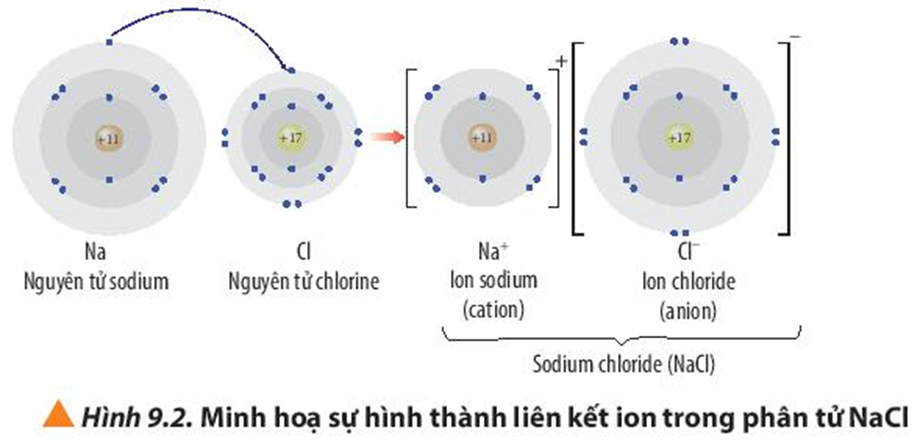
Quan sát Hình 9.2, hãy trình bày sự hình thành liên kết ion trong phân tử NaCl khi sodium tác dụng với chlorine
 Xem đáp án
Xem đáp án
+ Nguyên tử Na (Z = 11) nhường đi 1 electron ở lớp ngoài cùng trở thành ion mang điện tích dương, kí hiệu là Na+.
+ Nguyên tử Cl (Z = 17) nhận 1 electron từ nguyên tử Na trở thành ion mang điện tích âm, kí hiệu là Cl-.
Các ion Na+ và Cl- hút nhau tạo thành liên kết trong phân tử NaCl.
Phương trình hóa học: 2Na + Cl2 → 2NaCl.
Câu 7:
Các ion Na+ và Cl- có cấu hình electron nguyên tử của các khí hiếm tương ứng nào?
 Xem đáp án
Xem đáp án
- Ion Na+ có 10 electron ở lớp vỏ, lớp ngoài cùng có 8 electron và có 2 lớp electron
⇒ Giống cấu hình electron của khí hiếm Ne: 1s22s22p6
- Ion Cl- có 18 electron ở lớp vỏ và có 3 lớp electron
⇒ Giống cấu hình electron của khí hiếm Ar: 1s22s22p63s23p6
Câu 8:
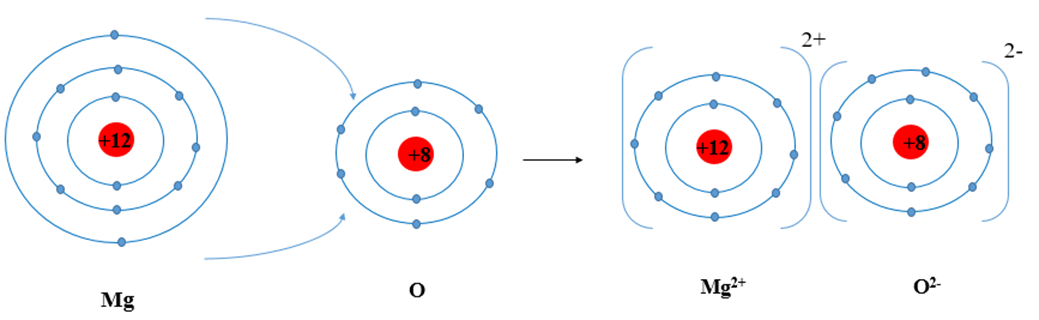
Trình bày sự hình thành liên kết ion trong phân tử MgO khi magnesium tác dụng với oxygen.
 Xem đáp án
Xem đáp án
- Nguyên tử Mg (Z = 12): 1s22s22p63s2 ⇒ Có 2 electron ở lớp ngoài cùng.
⇒ Có xu hướng nhường 2 electron để đạt cấu hình electron của khí hiếm tạo thành ion Mg2+
- Nguyên tử O (Z = 8): 1s22s22p4 ⇒ Có 6 electron ở lớp ngoài cùng.
⇒ Có xu hướng nhận 2 electron để đạt cấu hình electron của khí hiếm tạo thành ion O2-
⇒ Nguyên tử O sẽ nhận 2 electron của nguyên tử Mg tạo thành ion O2-.
- Hai ion là Mg2+ và O2- liên kết với nhau tạo thành phân tử MgO
Câu 9:
Quan sát Hình 9.3, cho biết:
a) Tinh thể NaCl có cấu trúc của hình khối nào.
b) Các ion Na+ và Cl- phân bố trong tinh thể như thế nào
c) Xung quanh mỗi loại ion có bao nhiêu ion ngược dấu gần nhất
 Xem đáp án
Xem đáp án
a) Tinh thể NaCl có cấu trúc là hình lập phương.
b) Các ion Na+ và Cl- được xếp xen kẽ nhau đều đặn trên các đỉnh của hình lập phương.
c) Xung quanh mỗi loại ion có 6 ion ngược dấu gần nhất.
Ví dụ: xung quanh ion Na+ có 6 ion Cl-
Câu 10:
Em hiểu thế nào về tinh thể ion?
 Xem đáp án
Xem đáp án
Tinh thể ion là hợp chất ion ở dạng rắn. Chúng gồm các ion liên kết với nhau bằng lực hút tĩnh điện tạo thành một mạng tinh thể.
Câu 11:
Quan sát các bước trong Hình 9.4, cho biết cần bao nhiêu thanh nối và khối cầu mỗi loại để lắp ráp thành mô hình một ô mạng tinh thể NaCl.
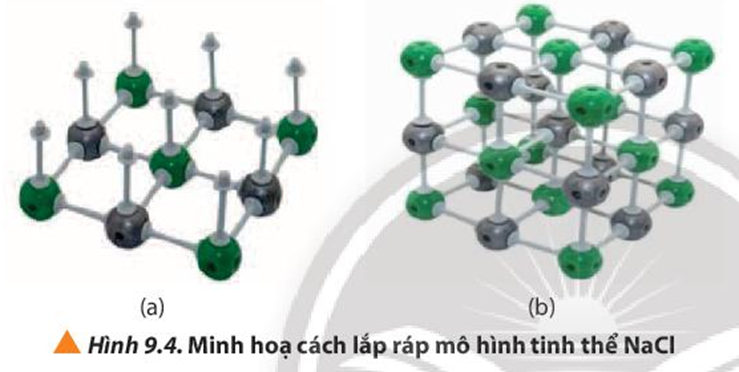
 Xem đáp án
Xem đáp án
Cần 12 thanh nối cho một lớp của tinh thể hình lập phương.
Tinh thể gồm 3 lớp ⇒ 12.3 = 36 thanh nối
3 lớp này được ghép với nhau bằng các thanh nối thẳng đứng ⇒ Gồm 9.2 = 18 thanh nối
Tổng cộng cần: 36 + 18 = 54 thanh nối
Câu 13:
Ion Mg2+ có cấu hình electron giống cấu hình electron của khí hiếm nào?
A. Helium
B. Neon
C. Argon
D. Krypton
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cấu hình electron của nguyên tử Mg (Z = 12): 1s22s22p63s2
Nguyên tử Mg nhường 2 electron tạo thành ion Mg2+ có cấu hình electron là:
1s22s22p6 giống với cấu hình electron của khí hiếm neon.
Câu 14:
Cho các ion sau: Ca2+, F-, Al3+ và N3-. Số ion có cấu hình electron của khí hiếm neon là
A. 4
B. 2
C. 1
D. 3
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- Cấu hình electron của nguyên tử Ca (Z = 20): 1s22s22p63s23p64s2
Nguyên tử Ca nhường 2 electron tạo thành ion Ca2+ có cấu hình electron là:
1s22s22p6 3s23p6 giống với cấu hình electron của khí hiếm Ar.
- Cấu hình electron của nguyên tử F (Z = 9): 1s22s22p5
Nguyên tử F nhận 1 electron tạo thành ion F- có cấu hình electron là:
1s22s22p6 giống với cấu hình electron của khí hiếm neon.
- Cấu hình electron của nguyên tử Al (Z = 13): 1s22s22p63s23p1
Nguyên tử Al nhường 3 electron tạo thành ion Al3+ có cấu hình electron là:
1s22s22p6 giống với cấu hình electron của khí hiếm neon.
- Cấu hình electron của nguyên tử N (Z = 7): 1s22s22p3
Nguyên tử N nhận 3 electron tạo thành ion N3- có cấu hình electron là:
1s22s22p6 giống với cấu hình electron của khí hiếm neon.
Vậy có 3 ion là F-, Al3+ và N3- có cấu hình electron giống với cấu hình electron của khí hiếm Ne.
Câu 15:
Potassium và magnesium là các nguyên tố thiết yếu đối với cơ thể sinh vật sống.
a) Viết cấu hình electron của các ion được tạo thành từ nguyên tử của các nguyên tố này. Chúng có cấu hình electron của những nguyên tử khí hiếm nào?
b) Có hợp chất ion nào chỉ tạo bởi các ion trên với nhau không? Vì sao?
 Xem đáp án
Xem đáp án
a) – Potassium (K, Z = 19) có cấu hình electron là: 1s22s22p63s23p64s1
Nguyên tử K nhường 1 electron tạo thành ion K+ có cấu hình electron là: 1s22s22p63s23p6 giống với cấu hình electron của khí hiếm Ar.
- Cấu hình electron của nguyên tử Mg (Z = 12): 1s22s22p63s2
Nguyên tử Mg nhường 2 electron tạo thành ion Mg2+ có cấu hình electron là:
1s22s22p6 giống với cấu hình electron của khí hiếm neon.
b) Không có hợp chất ion nào chỉ tạo bởi các ion K+ và Mg2+ với nhau vì hai ion này cùng mang điện tích dương. Hợp chất ion chỉ được tạo bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Câu 16:
Hoàn thành những thông tin còn thiếu trong bảng sau:
|
Công thức hợp chất ion |
Cation |
Anion |
|
CaF2 |
? |
? |
|
? |
K+ |
O2- |
 Xem đáp án
Xem đáp án
|
Công thức hợp chất ion |
Cation |
Anion |
|
CaF2 |
Ca2+ |
F- |
|
K2O |
K+ |
O2- |
Câu 17:
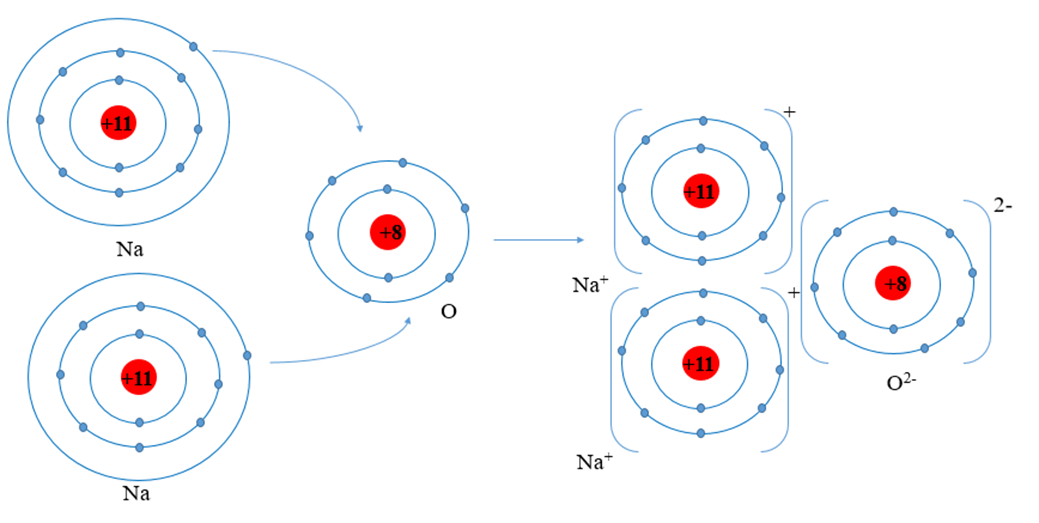
Sodium oxide (Na2O) có trong thành phần thủy tinh và các sản phẩm gốm sứ. Trình bày sự hình thành liên kết ion trong phân tử sodium oxide.
 Xem đáp án
Xem đáp án
- Nguyên tử Na (Z = 11): 1s22s22p63s1 ⇒ Có 1 electron ở lớp ngoài cùng
⇒ Có xu hướng nhường 1 electron để đạt cấu hình electron của khí hiếm tạo thành ion Na+
- Nguyên tử O (Z = 8): 1s22s22p4 ⇒ Có 6 electron ở lớp ngoài cùng
⇒ Có xu hướng nhận 2 electron để đạt cấu hình electron của khí hiếm tạo thành ion O2-
⇒ Nguyên tử O nhận 2 electron của hai nguyên tử Na tạo thành ion là O2-.
- Hai ion Na+ và 1 ion O2- liên kết với nhau tạo thành phân tử Na2O.