Bài tập Liên kết ion có đáp án
-
79 lượt thi
-
10 câu hỏi
-
20 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Do trong hợp chất NaCl, giữa các ion có lực hút tĩnh điện rất mạnh nên làm cho NaCl có nhiệt độ nóng chảy cao, có khả năng dẫn điện khi nóng chảy hoặc khi hòa tan trong dung dịch.
Câu 2:
Hoàn thành các sơ đồ tạo thành ion sau:
a) Li ⟶ Li+ + ? b) Be ⟶ ? + 2e
c) Br + ? ⟶ Br– d) O + 2e ⟶ ?
 Xem đáp án
Xem đáp án
a) Li ⟶ Li+ + 1e
b) Be ⟶ Be2+ + 2e
c) Br + e ⟶ Br–
d) O + 2e ⟶ O2-
Câu 3:
Viết cấu hình electron của các ion K+, Mg2+, F-, S2. Mỗi cấu hình đó giống với cấu hình electron của nguyên tử khí hiếm nào?
 Xem đáp án
Xem đáp án
- Cấu hình electron của K là 1s2 2s2 2p6 3s2 3p6 4s1.
K ⟶ K+ + e
⇒ Cấu hình electron của K+ là 1s2 2s2 2p6 3s2 3p6.
⇒ Cấu hình electron của K+ giống với khí hiếm Ar.
- Cấu hình electron của Mg là 1s2 2s2 2p6 3s2.
Mg ⟶ Mg2+ + 2e
⇒ Cấu hình electron của Mg2+ là 1s2 2s2 2p6.
⇒ Cấu hình electron của Mg2+ giống với khí hiếm Ar.
- Cấu hình electron của F là 1s2 2s2 2p5.
F + e ⟶ F-
⇒ Cấu hình electron của F– là 1s2 2s2 2p6.
⇒ Cấu hình electron của F– giống với khí hiếm Ne.
- Cấu hình electron của S là 1s2 2s2 2p6 3s2 3p4.
S + 2e ⟶ S2–
⇒ Cấu hình electron của S2– là 1s2 2s2 2p6 3s2 3p6.
⇒ Cấu hình electron của S2– giống với khí hiếm Ar.
Câu 4:
Vì sao một ion O2- kết hợp được với hai ion Li+?
 Xem đáp án
Xem đáp án
Ta có:
O + 2e ⟶ O2–
Li ⟶ Li+ + e
Do số electron mà 1 nguyên tử O nhận gấp đôi số electron mà 1 nguyên tử Li nhường nên một ion O2– kết hợp được với hai ion Li+.
Câu 5:
 Xem đáp án
Xem đáp án
Liên kết ion thường được hình thành giữa kim loại điển hình và phi kim điển hình.
⇒ Các cặp ion có thể kết hợp với nhau để tạo liên kết ion là: Na+ và O2–, Mg2+ và O2–, Na+ và Cl–, Mg2+ và Cl–.
Câu 6:
Mô tả sự tạo thành liên kết ion trong:
a) Calcium oxide.
b) Magnesium chloride.
 Xem đáp án
Xem đáp án
a) Khi kim loại calcium kết hợp với phi kim oxygen, tạo thành các ion Ca2+ và O2–, các ion này có điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
Biểu diễn sự hình thành liên kết ion trong phân tử CaO như sau:
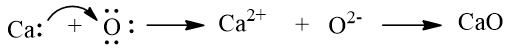
b) Khi kim loại magnesium kết hợp với phi kim chlorine, tạo thành các ion Mg2+ và Cl–, các ion này có điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
Biểu diễn sự hình thành liên kết ion trong phân tử MgCl2 như sau:
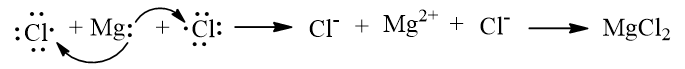
Câu 7:
Lắp ráp mô hình tinh thể NaCl
Chuẩn bị: bộ mô hình tinh thể NaCl.
Tiến hành:
- Chọn hình cầu có màu sắc khác nhau đại diện cho ion Na+ và ion Cl-.
- Lắp các hình cầu và que nối theo mẫu (Hình 11.1b).
Quan sát mô hình và xác định số ion gần nhất bao quanh một ion trái dấu ở giữa mô hình
 Xem đáp án
Xem đáp án
- Lắp mô hình như hình sau:
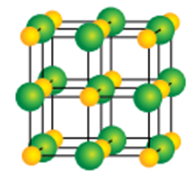
Trong đó, quả cầu quả nhỏ màu vàng đại diện cho ion Cl- còn quả cầu to hơn màu xanh đại diện cho ion Na+.
- Quan sát mô hình vừa lắp, ta thấy: mỗi ion Na+ được bao quanh bởi 6 ion Cl- gần nhất và mỗi ion Cl- cũng được bao quanh bởi 6 ion Na+ gần nhất.
Câu 8:
Thử tính dẫn điện của hợp chất
Chuẩn bị: muối ăn dạng hạt, dung dịch muối ăn bão hoà, dung dịch nước đường, dụng cụ thử tính dẫn điện, cốc thuỷ tinh.

Tiến hành: Sử dụng dụng cụ thử tính dẫn điện như Hình 11.3, lần lượt cho chân kim loại của dụng cụ thử tính dẫn điện tiếp xúc với:
- Dung dịch nước đường.
- Muối ăn khan.
- Dung dịch muối ăn bão hoà.
Nếu đèn sáng thì chất dẫn điện, nếu đèn không sáng thì chất không dẫn điện.
Quan sát hiện tượng và cho biết trường hợp nào dẫn điện, trường hợp nào không dẫn điện. Giải thích. Xem đáp án
Xem đáp án
- Các em tự tiến hành thí nghiệm.
- Quan sát hiện tượng thấy:
+ Đèn sáng khi cắm vào dung dịch muối ăn bão hòa.
⇒ Dung dịch muối ăn bão hòa dẫn được điện.
+ Đèn không sáng khi cắm vào muối ăn khan, dung dịch nước đường.
⇒ Muối ăn khan, dung dịch nước đường không dẫn điện.
Giải thích:
- Muối ăn là hợp chất ion nên tan nhiều trong nước. Khi tan trong nước, các ion Na+ và Cl- bị tách khỏi mạng lưới tinh thể, chuyển động khá tự do và là tác nhân dẫn điện.
- Muối ăn khan tức là ở trạng thái rắn, các ion không di chuyển tự do được nên muối ăn khan không dẫn điện.
- Đường không phải hợp chất ion nên dung dịch đường không dẫn được điện.
Câu 9:
a) Vì sao muối ăn có nhiệt độ nóng chảy cao (801oC)?
b) Hợp chất ion dẫn điện trong trường hợp nào? Vì sao? Xem đáp án
Xem đáp án
a) Muối ăn (NaCl) là tinh thể ion, giữa các ion Na+ và Cl- có lực hút tĩnh điện rất mạnh nên muối ăn khó nóng chảy hay có nhiệt độ nóng chảy cao.
b) Các hợp chất ion ở trạng thái nóng chảy hoặc dung dịch sẽ dẫn điện, vì:
- Khi nóng chảy hoặc tan trong nước, các ion bị tách khỏi mạng lưới tinh thể, chuyển động khá tự do và là tác nhân dẫn điện.
- Ở trạng thái rắn, các ion không di chuyển tự do được nên hợp chất ion không dẫn điện.
Câu 10:
Giải thích một số tính chất đặc trưng của hợp chất ion và một số ứng dụng phổ biến của chúng trong đời sống.
 Xem đáp án
Xem đáp án
- Trong tinh thể ion, giữa các ion có lực hút tĩnh điện rất mạnh nên các hợp chất ion thường là chất rắn, khó nóng chảy, khó bay hơi ở điều kiện thường.
Ví dụ: Nhiệt độ nóng chảy của MgO là 2800°C.
- Các hợp chất ion thường tan nhiều trong nước. Khi tan trong nước, các ion bị tách khỏi mạng lưới tinh thể, chuyển động khá tự do và là tác nhân dẫn điện. Ở trạng thái nóng chảy, hợp chất ion dẫn điện.
- Do lực hút tĩnh điện rất mạnh giữa các ion nên các tinh thể ion khá rắn chắc, nhưng khá giòn.
⇒ Đây là tính chất đặc trưng của tinh thể ion.
Một số ứng dụng phổ biến của hợp chất ion trong đời sống:
- Potassium hydroxide là hợp chất ion được dùng làm chất dẫn điện trong pin alkaline (pin kiềm).

- Máy lọc không khí tạo ion âm.

