Bài tập Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng có đáp án
-
191 lượt thi
-
13 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Trong tự nhiên có những phản ứng xảy ra rất nhanh, như phản ứng nổ của pháo hoa, phản ứng cháy của que diêm, … nhưng cũng có những phản ứng xảy ra chậm hơn, như quá trình oxi hóa các kim loại sắt, đồng trong khí quyển, sự ăn mòn vỏ tàu biển làm bằng thép,… Để đánh giá mức độ nhanh hay chậm của một phản ứng hóa học cần dùng đại lượng nào? Cách tính ra sao?

 Xem đáp án
Xem đáp án
Để đánh giá mức độ nhanh hay chậm của một phản ứng hóa học ta dùng đại lượng tốc độ phản ứng hóa học.
- Tốc độ phản ứng của phản ứng hóa học là đại lượng đặc trưng cho sự biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
- Tốc độ phản ứng kí hiệu là v, có đơn vị: (đơn vị nồng độ)/ (đơn vị thời gian).
+ Xét phản ứng đơn giản có dạng: aA + bB → cC + dD
+ Mối quan hệ giữa nồng độ và tốc độ tức thời của phản ứng hóa học được biểu diễn bằng biểu thức:
+ Trong đó:
k là hằng số tốc độ phản ứng;
CA; CB là nồng độ (M) chất A, B tại thời điểm đang xét.
- Tốc độ trung bình của phản ứng là tốc độ được tính trong một khoảng thời gian phản ứng.
Trong đó:
: tốc độ trung bình của phản ứng
∆C = C2 – C1: sự biến thiên nồng độ
∆t = t2 – t1 : biến thiên thời gian
C1, C2 là nồng độ của một chất tại hai thời điểm tương ứng t1 và t2.
Câu 2:
Quan sát hình trong phần Khởi động, nhận xét về mức độ nhanh hay chậm của phản ứng hóa học xảy ra trong đám cháy lá cây khô và thân tàu biển bị oxi hóa trong điều kiện tự nhiên

 Xem đáp án
Xem đáp án
Phản ứng cháy xảy ra nhanh hơn, có phát sáng và tỏa nhiệt mạnh, lá cây nhanh chóng bị chuyển thành tro.
Phản ứng oxi hóa kim loại trong thân tàu trong điều kiện tự nhiên xảy ra chậm hơn, một thời gian mới xuất hiện gỉ kim loại, không phát sáng, không tỏa nhiệt mạnh.
Câu 3:
Trong tự nhiên và cuộc sống, ở cùng điều kiện, nhiều chất khác nhau sẽ biến đổi hóa học nhanh, chậm khác nhau; với cùng một chất, trong điều kiện khác nhau cũng biến đổi hóa học nhanh, chậm khác nhau. Tìm các ví dụ minh họa cho 2 nhận định trên.
 Xem đáp án
Xem đáp án
- Ở cùng điều kiện, nhiều chất khác nhau sẽ biến đổi hóa học nhanh, chậm khác nhau.
Ví dụ: Trong cùng một môi trường nhiệt độ phòng:
+ Quá trình oxi hóa sắt (cửa sắt) tạo gỉ sắt xảy ra chậm (vài tháng hoặc vài năm).
+ Quá trình oxi hóa thức ăn xảy ra nhanh (vài tiếng, 1 ngày hoặc vài ngày).
- Với cùng một chất, trong điều kiện khác nhau cũng biến đổi hóa học nhanh, chậm khác nhau.
Ví dụ: Rau được bảo quản trong tủ lạnh sẽ giữ được lâu hơn rau để bên ngoài.
Câu 4:
Quan sát Hình 15.1, cho biết nồng độ của chất phản ứng và sản phẩm thay đổi như thế nào theo thời gian.
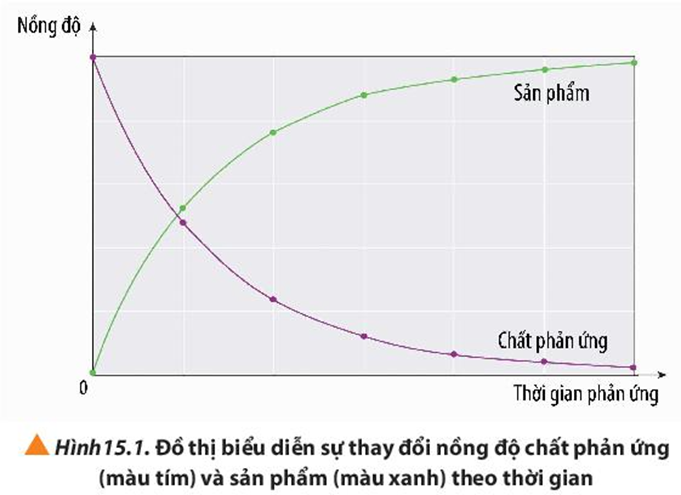
 Xem đáp án
Xem đáp án
- Nồng độ của chất phản ứng giảm dần theo thời gian.
- Nồng độ của chất sản phẩm tăng dần theo thời gian.
Câu 5:
Xét phản ứng phân hủy N2O5 ở 45oC
N2O5(g) → N2O4(g) + O2(g)
Sau 184 giây đầu tiên, nồng độ của N2O4 là 0,25M. Tính tốc độ trung bình của phản ứng theo N2O4 trong khoảng thời gian trên
 Xem đáp án
Xem đáp án
= 1,36.10-3 (M/s)
Vậy tốc độ trung bình của phản ứng theo N2O4 trong 184 giây đầu tiên là 1,36.10-3 (M/s)
Câu 6:
Theo định luật tác dụng khối lượng, tốc độ phản ứng thay đổi như thế nào khi tăng hoặc giảm nồng độ chất phản ứng
 Xem đáp án
Xem đáp án
Theo định luật tác dụng khối lượng tốc độ phản ứng tỉ lệ thuận với nồng độ các chất tham gia phản ứng.
⇒ Tốc độ phản ứng tăng khi tăng nồng độ chất phản ứng. Ngược lại, tốc độ phản ứng giảm khi giảm nồng độ chất phản ứng.
Câu 7:
Trong tự nhiên và cuộc sống, có nhiều phản ứng hóa học xảy ra với tốc độ khác nhau phụ thuộc vào nồng độ chất phản ứng, tìm các ví dụ minh họa
 Xem đáp án
Xem đáp án
- Khi ở nơi đông người trong không gian kín, ta cảm thấp khó thở và phải thở nhanh hơn.
Giải thích: Oxygen duy trì sự hô hấp, khi ở nơi đông người trong không gian kín nồng độ oxygen thấp hơn.
⇒ Nồng độ oxygen trong không khí không đủ để cung cấp cho mọi người.
⇒ Ta cảm thấp khó thở và phải thở nhanh hơn.
- Bệnh nhân suy hô hấp cần thở oxygen thay vì không khí (chứa 21% thể tích oxygen).
Giải thích: Bệnh nhân suy hô hấp khó khăn trong việc tự thở, dẫn đến thiếu oxygen cung cấp cho hoạt động của cơ thể. Trong bình khí nén oxygen, nồng độ oxygen cao hơn nồng độ oxygen có trong không khí giúp bệnh nhân thở dễ dàng hơn, cung cấp đủ oxygen cho các tế bào, giúp duy trì sự sống.
Câu 8:
Cho phản ứng đơn giản sau:
H2(g) + Cl2(g) → 2HCl(g)
a) Viết biểu thức tốc độ tức thời của phản ứng trên
b) Tốc độ phản ứng thay đổi thế nào khi nồng độ H2 giảm 2 lần và giữ nguyên nồng độ Cl2?
 Xem đáp án
Xem đáp án
H2(g) + Cl2(g) → 2HCl(g)
a) Biểu thức tốc độ tức thời của phản ứng viết theo định luật là:
b) Nồng độ H2 giảm 2 lần và giữ nguyên nồng độ Cl2
⇒
Vậy tốc độ phản ứng giảm một nửa khi nồng độ H2 giảm 2 lần và giữ nguyên nồng độ Cl2
Câu 9:
Dưới đây là một số hiện tượng xảy ra trong đời sống, hãy sắp xếp theo thứ tự tốc độ giảm dần:
Nướng bánh mì (1)
Đốt gas khi nấu ăn (2)
Lên men sữa chua tạo sữa chua (3)
Tấm tôn thiếc bị gỉ sét (4)
 Xem đáp án
Xem đáp án
Sắp xếp theo thứ tự tốc độ giảm dần: (2) > (1) > (3) > (4)
Câu 10:
Cho phản ứng đơn giản xảy ra trong bình kín: 2NO(g) + O2(g) → 2NO2(g)
a) Viết biểu thức tốc độ tức thời của phản ứng
b) Ở nhiệt độ không đổi, tốc độ phản ứng thay đổi thế nào khi
- nồng độ O2 tăng 3 lần, nồng độ NO không đổi?
- nồng độ NO tăng 3 lần, nồng độ O2 không đổi?
- nồng độ NO và O2 đều tăng 3 lần?
 Xem đáp án
Xem đáp án
a) Biểu thức tốc độ tức thời của phản ứng:
b) - nồng độ O2 tăng 3 lần, nồng độ NO không đổi
⇒ Tốc độ phản ứng tăng 3 lần
- nồng độ NO tăng 3 lần, nồng độ O2 không đổi
⇒ Tốc độ phản ứng tăng 9 lần
- nồng độ NO và O2 đều tăng 3 lần
⇒ Tốc độ phản ứng tăng 27 lần.
Câu 11:
Giải thích tại sao tốc độ tiêu hao của NO (M/s) và tốc độ tạo thành của N2 (M/s) không giống nhau trong phản ứng:
2CO(g) + 2NO(g) → 2CO2(g) + N2(g)
 Xem đáp án
Xem đáp án
Dựa vào tỉ lệ hệ số trong phương trình ta thấy nồng độ tiêu hao của NO nhanh gấp hai lần nồng độ tạo thành của N2.
Câu 12:
Cho phản ứng:
2N2O5(g) → 4NO2(g) + O2(g)
Sau thời gian từ giây 61 đến giây 120, nồng độ NO2 tăng từ 0,30 M lên 0,40 M. Tính tốc độ trung bình của phản ứng.
 Xem đáp án
Xem đáp án
Tốc độ trung bình của phản ứng là:
Câu 13:
Dữ liệu thí nghiệm của phản ứng:
SO2Cl2(g) → SO2(g) + Cl2(g) được trình bày ở bảng sau

a) Tính tốc độ trung bình của phản ứng theo SO2Cl2 trong thời gian 100 phút.
b) Sau 100 phút, nồng độ của SO2Cl2 còn lại là bao nhiêu?
c) Sau 200 phút, nồng độ của SO2 và Cl2 thu được là bao nhiêu?
 Xem đáp án
Xem đáp án
a) Tốc độ trung bình của phản ứng theo SO2Cl2 trong thời gian 100 phút.
(M/phút)
b) Sau 100 phút, nồng độ của SO2Cl2 còn lại là 1,00 – 0,13 = 0,87 M
c) Sau 200 phút, nồng độ của SO2Cl2 còn lại là: 0,78 M
⇒ Nồng độ của SO2Cl2 đã phản ứng là: 1,00 – 0,78 = 0,22 M
⇒ nồng độ của SO2 và Cl2 thu được là 0,22 M
