Bài tập Tính biến thiên enthalpy của phản ứng hóa học có đáp án
-
2669 lượt thi
-
16 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Methane cháy tỏa nhiệt lớn nên được dùng làm nhiên liệu. Khi trộn methane và oxygen với tỉ lệ thích hợp thì sẽ tạo ra hỗn hợp nổ.
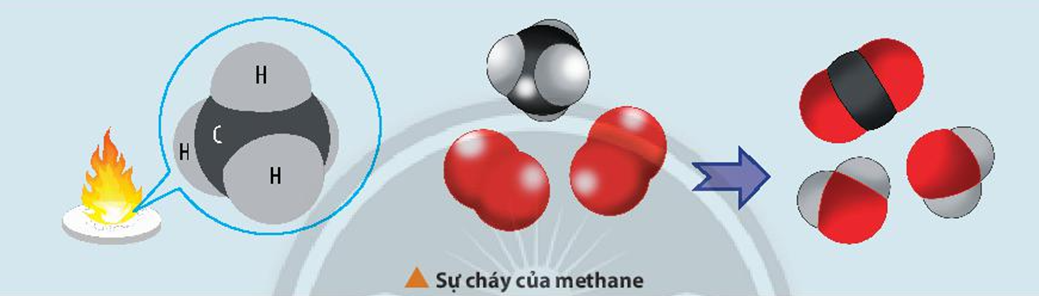
Biến thiên enthalpy của phản ứng trên được tính toán dựa trên các giá trị nào?
 Xem đáp án
Xem đáp án
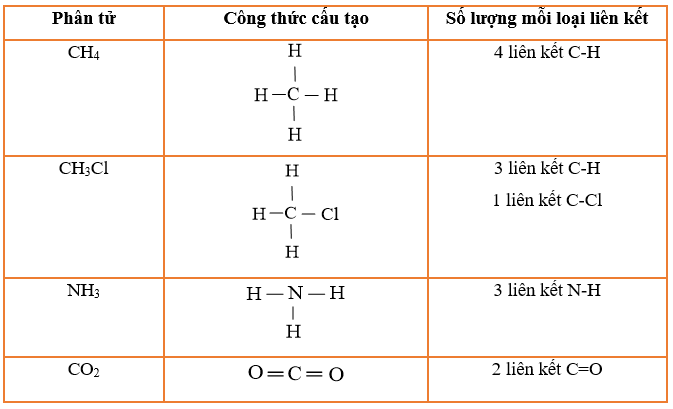
CH4(g) + 2O2(g) CO2(g) + 2H2O(l)
Biến thiên enthalpy của phản ứng cháy của methane có thể được tính theo hai cách:
- Cách 1: Dựa vào nhiệt tạo thành chuẩn của các chất.
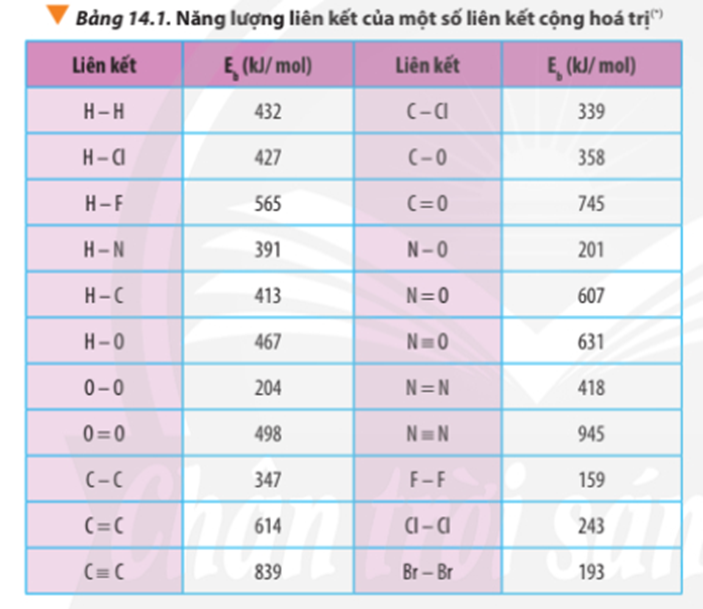
∆r = ∆f(CO2) + 2.∆f(H2O) – ∆f(CH4) – 2.∆f(O2)
- Cách 2: Dựa vào năng lượng liên kết của các chất.
∆r = Eb(CH4) + 2.Eb(O2) – Eb(CO2) – 2.Eb(H2O)
∆r = 4.Eb(C-H) + 2.Eb(O=O) – 2. Eb(C=O) – 2.2.Eb(O-H)
Câu 2:
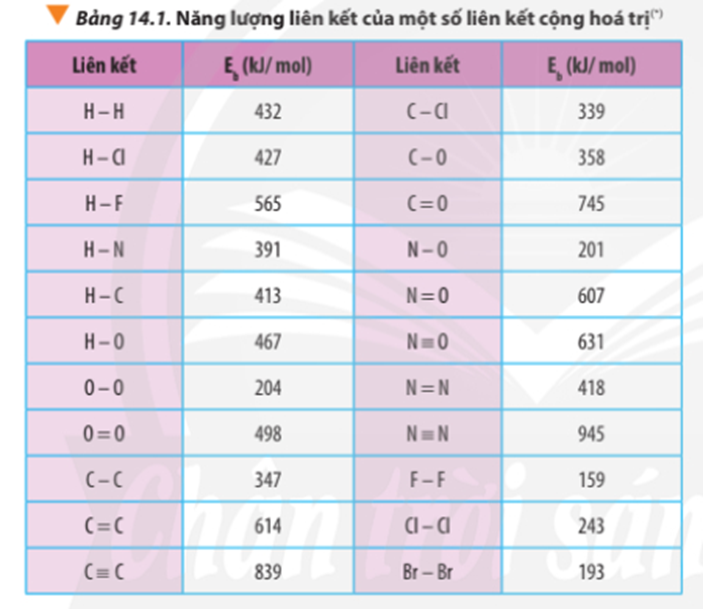
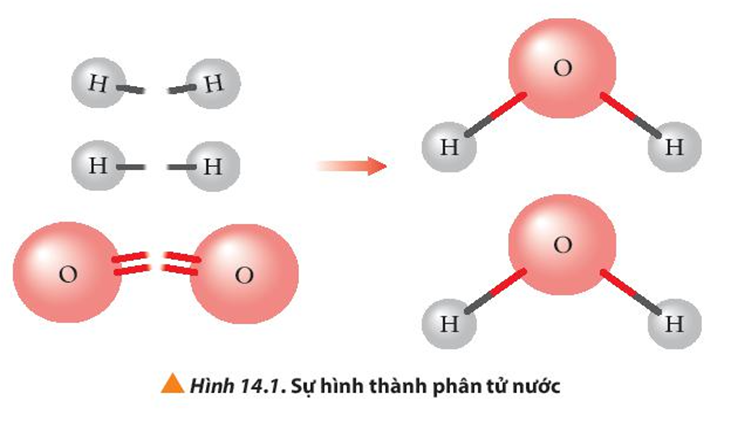
Quan sát Hình 14.1 cho biết liên kết hóa học nào bị phá vỡ, liên kết hóa học nào được hình thành khi H2 phản ứng với O2 tạo thành H2O (ở thể khí)?
 Xem đáp án
Xem đáp án
Khi H2 phản ứng với O2 tạo thành H2O (ở thể khí) liên kết H-H và O=O bị đứt ra, liên kết O-H được hình thành.
Câu 4:
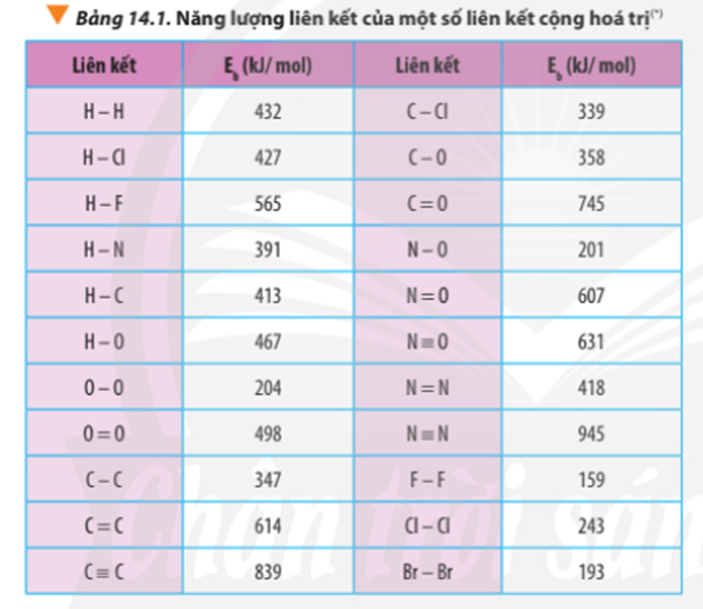
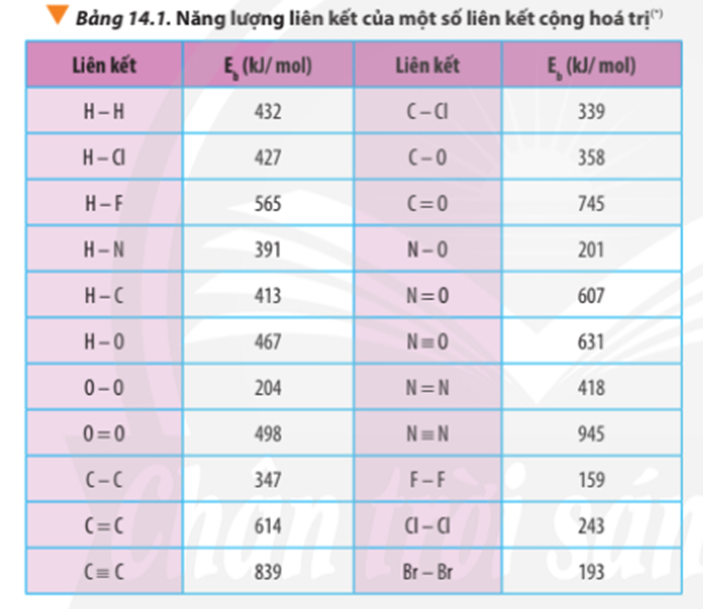
Dựa vào năng lượng liên kết ở Bảng 14.1, tính biến thiên enthalpy của phản ứng và giải thích vì sao nitrogen (N≡N) chỉ phản ứng với oxygen (O=O) ở nhiệt độ cao hoặc có tia lửa điện để tạo thành nitrogen monoxide (N=O).
N2(g) + O2(g) 2NO(g)
 Xem đáp án
Xem đáp án
N2(g) + O2(g) 2NO(g)
∆ r = Eb(N2) + Eb(O2) – 2Eb(NO)
∆ r = Eb(N≡N) + Eb(O=O) – 2Eb(N=O)
∆ r = 945 + 498 – 2.607 = 229 kJ
Ta thấy để phá vỡ 1 liên kết N≡N và 1 liên kết O=O để hình thành 2 liên kết N-O cần cung cấp nhiệt lượng lớn (229 kJ).
⇒ Cần thực hiện ở nhiệt độ cao hoặc có tia lửa điện thì phản ứng mới xảy ra.
Câu 5:
Xác định ∆ r của phản ứng sau dựa vào giá trị Eb ở Bảng 14.1:
CH4(g) + Cl2(g) CH3Cl(g) + HCl(g)
Hãy cho biết phản ứng trên tỏa nhiệt hay thu nhiệt?
 Xem đáp án
Xem đáp án
∆ r = Eb(CH4) + Eb(Cl2) – Eb(CH3Cl) – Eb(HCl)
∆ r = 4.Eb(C-H) + Eb(Cl-Cl) – 3Eb(C-H) – Eb(C-Cl) – Eb(H-Cl)
∆ r = 4.413 + 243 – 3.413 – 339 – 427
∆ r = -110 kJ < 0
⇒ Phản ứng tỏa nhiệt.
Câu 6:
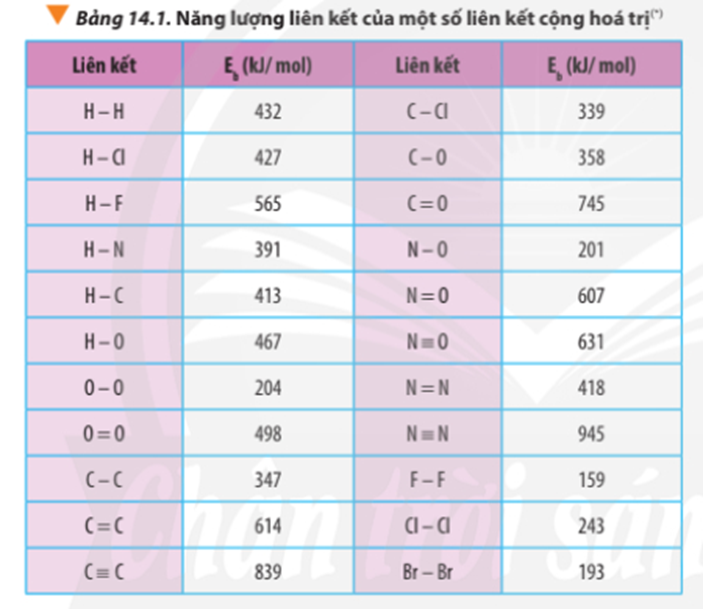
Dựa vào số liệu về năng lượng liên kết ở Bảng 14.1, hãy tính biến thiên enthalpy của 2 phản ứng sau:
2H2(g) + O2(g) 2H2O(g) (1)
C7H16(g) + 11O2(g) 7CO2(g) + 8H2O(g) (2)
So sánh kết quả thu được, từ đó cho biết H2 hay C7H16 là nhiên liệu hiệu quả hơn cho tên lửa (biết trong C7H16 có 6 liên kết C-C và 16 liên kết C-H)

 Xem đáp án
Xem đáp án
2H2(g) + O2(g) 2H2O(g) (1)
∆ r(1) = 2.Eb(H2) + Eb(O2) – 2.Eb(H2O)
∆ r(1) = 2.Eb(H-H) + Eb(O=O) – 2.2.Eb(O-H)
∆ r(1) = 2.432 + 498 – 2.2.467 = -506 kJ
C7H16(g) + 11O2(g) 7CO2(g) + 8H2O(g) (2)
∆ r(2) = Eb(C7H16) + 11.Eb(O2) – 7.Eb(CO2) – 8.Eb(H2O)
∆ r(2) = 6.Eb(C-C) + 16Eb(C-H) + 11.Eb(O=O) – 7.2.Eb(C=O) – 8.2.Eb(O-H)
∆ r(2) = 6.347 + 16.413 + 11.498 – 7.2.745 – 8.2.467 = -3734 kJ
Ta thấy: ∆ r(2) < ∆ r(1) ⇒ Phản ứng (2) xảy ra thuận lợi hơn phản ứng (1)
⇒ C7H16 là nhiên liệu hiệu quả hơn cho tên lửa.
Câu 7:
Tính ∆ r của hai phản ứng sau:
3O2(g) → 2O3(g) (1)
2O3(g) → 3O2(g) (2)
Liên hệ giữa giá trị ∆ r với độ bền của O3, O2 và giải thích, biết phân tử O3 gồm 1 liên kết đôi O=O và 1 liên kết đơn O-O.
 Xem đáp án
Xem đáp án
3O2(g) → 2O3(g) (1)
∆ r(1) = 3.Eb(O2) – 2.Eb(O3)
∆ r(1) = 3.Eb(O=O) – 2.[Eb(O-O) + Eb(O=O)]
∆ r(1) = 3.498 – 2.(204 + 498) = 90 kJ
2O3(g) → 3O2(g) (2)
∆ r(2) = 2.Eb(O3) - 3.Eb(O2)
∆ r(2) = 2.[Eb(O-O) + Eb(O=O)] - 3.Eb(O=O)
∆ r(2) = 2.(204 + 498) - 3.498 = -90 kJ
⇒Phản ứng (2) xảy ra thuận lợi hơn
Bên cạnh đó O3 kém bền hơn O2
⇒ ∆ r càng âm, chất tạo ra càng bền hơn.
Câu 8:
Tính biến thiên enthalpy của phản ứng phân hủy trinitroglycerin (C3H5O3(NO2)3), theo phương trình sau (biết nhiệt tạo thành của nitroglycerin là -370,15 kJ/mol):
4C3H5O3(NO2)3(s) → 6N2(g) + 12CO2(g) + 10H2O(g) + O2(g)
Hãy giải thích vì sao trinitroglycerin được ứng dụng làm thành phần thuốc súng không khói.
 Xem đáp án
Xem đáp án
4C3H5O3(NO2)3(s) → 6N2(g) + 12CO2(g) + 10H2O(g) + O2(g)
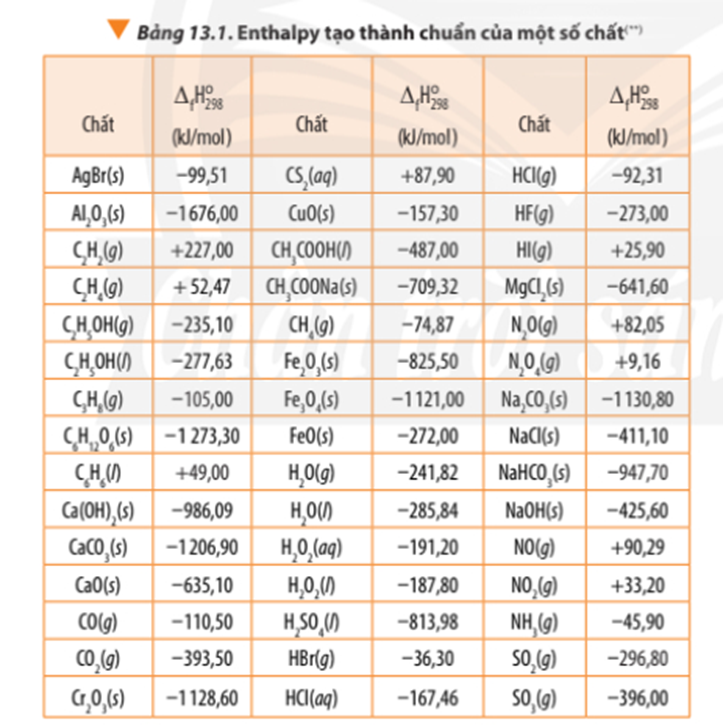
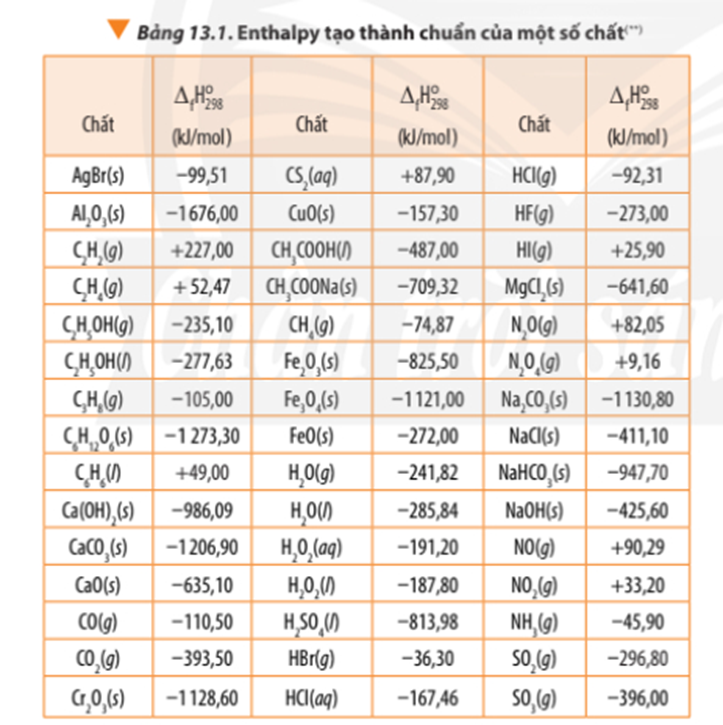
∆ r = 6.∆ f(N2) + 12. ∆ f(CO2) + 10. ∆ f(H2O) + ∆ f(O2) – 4. ∆ f(C3H5O3(NO2)3)
∆ r = 6.0 + 12.(-393,50) + 10.(-241,82) + 0 – 4.(-370,15) = -5659,6 kJ < 0
⇒ Phản ứng tỏa lượng nhiệt rất lớn và có khả năng sát thương cao.
⇒ Trinitroglycerin được ứng dụng làm thành phần thuốc súng không khói.
Câu 9:
Giá trị biến thiên enthalpy của phản ứng có liên quan tới hệ số các chất trong phương trình nhiệt hóa học không? Giá trị enthalpy tạo thành thường được đo ở điều kiện nào?
 Xem đáp án
Xem đáp án
- Giá trị biến thiên enthalpy của phản ứng có liên quan tới hệ số các chất trong phương trình nhiệt hóa học.
Khi tính giá trị biến thiên enthalpy của phản ứng thì cần nhân hệ số tỉ lượng với enthalpy tạo thành của các chất tương ứng.
- Giá trị enthalpy tạo thành thường được đo ở điều kiện chuẩn: Áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và thường chọn nhiệt độ 25oC (hay 298K)
Câu 10:
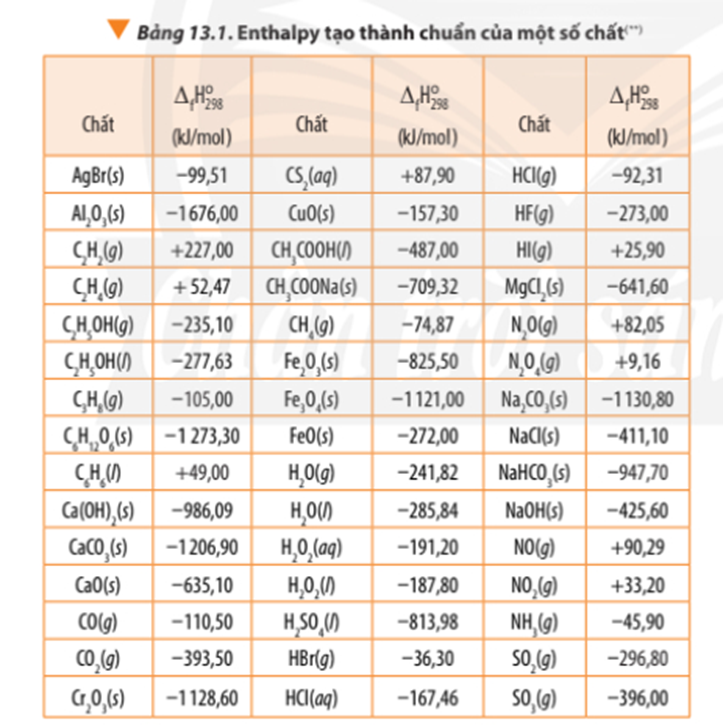
Dựa vào giá trị enthalpy tạo thành ở Bảng 13.1, hãy tính giá trị ∆ r của các phản ứng sau:
CS2(l) + 3O2(g) CO2(g) + 2SO2(g) (1)
4NH3(g) + 3O2(g) 2N2(g) + 6H2O(g) (2)
 Xem đáp án
Xem đáp án
CS2(l) + 3O2(g) CO2(g) + 2SO2(g) (1)
∆ r(1) = 1.∆ f(CO2) + 2.∆ f(SO2) - 1.∆ f(CS2) – 3.∆ f(O2)
∆ r(1) = -393,50 + 2.(-296,80) – 1.87,90 – 3.0 = -1075 kJ
4NH3(g) + 3O2(g) 2N2(g) + 6H2O(g) (2)
∆ r(2) = 2.∆ f(N2) + 6.∆ f(H2O) - 4.∆ f(NH3) – 3.∆ f(O2)
∆ r(2) = 2.0 + 6.(-241,82) – 4.(-45,9) – 3.0 = -1267,32 kJCâu 12:
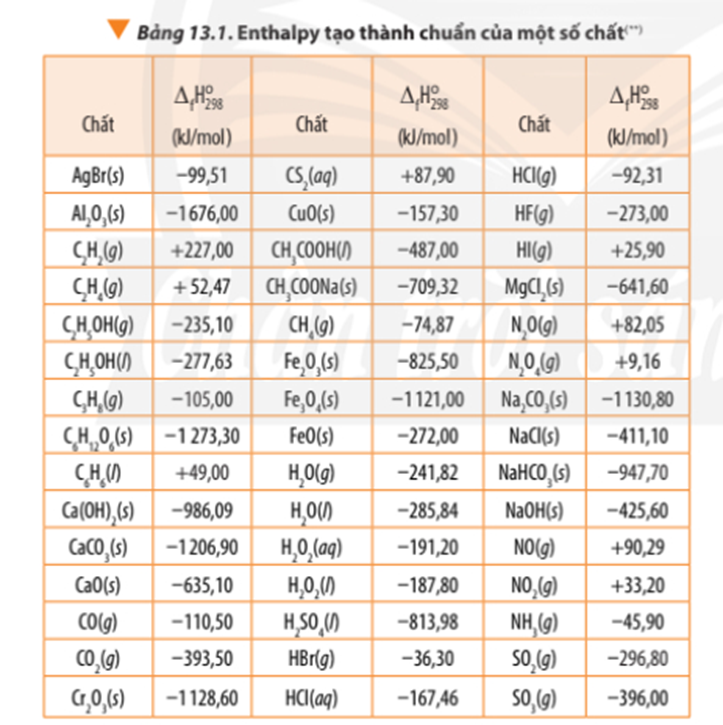
Dựa vào Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hoàn toàn 1 mol benzene C6H6(l) trong khí oxygen, tạo thành CO2(g) và H2O(l). So sánh lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g propane C3H8(g) với lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g benzenne C6H6(l).
 Xem đáp án
Xem đáp án
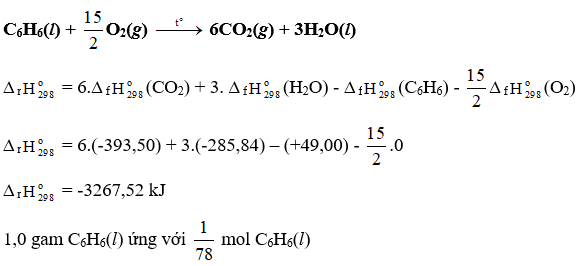
Đốt cháy 1 mol C6H6(l) tỏa ra 3267,52 kJ nhiệt lượng
⇒ Đốt cháy mol C6H6(l) tỏa ra là .3267,52 = 41,89 kJ nhiệt lượng
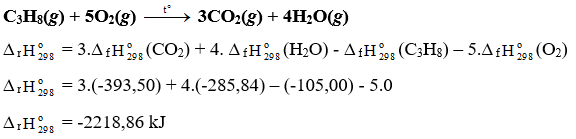
1,0 gam C3H8(g) ứng với mol C3H8(g)
Đốt cháy 1 mol C3H8(g) tỏa ra 2218,86 kJ nhiệt lượng
⇒ Đốt cháy mol C3H8(g) tỏa ra là .2218,86 = 50,43 kJ nhiệt lượng
Lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g propane C3H8(g) nhiều hơn khi đốt cháy hoàn toàn 1,0 g benzenne C6H6(l).
Câu 14:
Cho phương trình nhiệt hóa học sau:
SO2(g) + O2(g) SO3(g) ∆ r = -98,5 kJ
a) Tính lượng nhiệt giải phóng ra khi chuyển 74,6 g SO2 thành SO3.
b) Giá trị ∆ r của phản ứng: SO3(g) → SO2(g) + O2(g) là bao nhiêu?
 Xem đáp án
Xem đáp án
a) 74,6 g SO2 tương ứng với mol SO2
Đốt cháy hoàn toàn 1 mol SO2(g) sinh ra 98,5 kJ nhiệt lượng
⇒ Đốt cháy hoàn toàn mol SO2(g) sinh ra 98,5. = 114,81 kJ nhiệt lượng
b) Lượng nhiệt giải phóng ra khi chuyển 1 mol SO2 thành 1 mol SO3 là 98,5 kJ
⇒ Lượng nhiệt cần cung cấp để phân hủy 1 mol SO3 cũng là 98,5 kJ
⇒ Giá trị ∆ r của phản ứng: SO3(g) → SO2(g) + O2(g) là +98,5 kJ.
Câu 15:
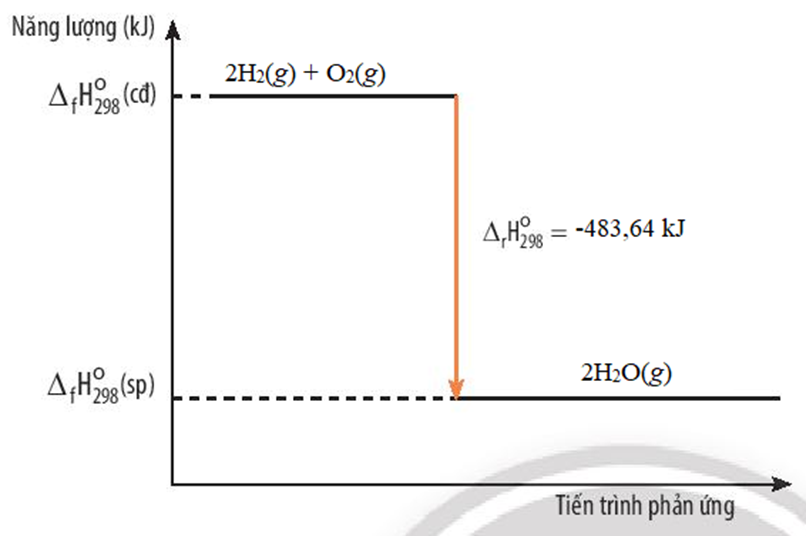
Khí hydrogen cháy trong không khí tạo thành nước theo phương trình hóa học sau:
2H2(g) + O2(g) → 2H2O(g) ∆ r = -483,64 kJ
a) Nước hay hỗn hợp của oxygen và hydrogen có năng lượng lớn hơn? Giải thích.
b) Vẽ sơ đồ biến thiên năng lượng của phản ứng giữa hydrogen và oxygen.
 Xem đáp án
Xem đáp án
a) ∆ r = Σ∆ f(sp) - Σ ∆ f(cđ) < 0
⇔ Σ∆ f(sp) < Σ ∆ f(cđ)
Vậy hỗn hợp của oxygen và hydrogen có năng lượng lớn hơn nước.
b) Sơ đồ biến thiên năng lượng của phản ứng giữa hydrogen và oxygen.
Câu 16:
Xét quá trình đốt cháy khí propane C3H8(g):
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
Tính biến thiên enthalpy chuẩn của phản ứng dựa vào nhiệt tạo thành của hợp chất (Bảng 13.1) và dựa vào năng lượng liên kết (Bảng 14.1). So sánh hai giá trị đó và rút ra kết luận.
 Xem đáp án
Xem đáp án
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
Tính theo nhiệt tạo thành của hợp chất:
∆ r = 3.∆ f(CO2) + 4. ∆ f(H2O) - ∆ f(C3H8) – 5.∆ f(O2)
∆ r = 3.(-393,50) + 4.(-241,82) – (-105,00) - 5.0
∆ r = -2042,78 kJ
Tính theo năng lượng liên kết:
∆ r = Eb(C3H8) + 5.Eb(O2) – 3Eb(CO2) – 4Eb(H2O)
∆ = 2.Eb(C-C) + 8.Eb(C-H) + 5.Eb(O=O) -3.2.Eb(C=O) - 4.2.Eb(O-H)
∆ r = 2.347 + 8.413 + 5.498 – 3.2.745 – 4.2.467
∆ r = -1718 kJ
Hai giá trị tính được gần bằng nhau.