Bài tập Tính chất vật lí và hóa học các đơn chất nhóm VIIA có đáp án
-
190 lượt thi
-
26 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Trong đèn halogen, bao quanh dây tóc làm bằng wolfram là các khí hiếm như krypton, xenon và một lượng nhỏ halogen như bromine hoặc iodine, giúp tăng tuổi thọ và duy trì độ trong suốt của vỏ bóng đèn. Đèn halogen được sử dụng trong các máy sưởi, lò nướng, bếp halogen hồng ngoại,… do đặc điểm tỏa nhiều nhiệt.
Nhu cầu về nước sạch là thiết yếu và cấp bách của con người, nước sạch được dùng cho sinh hoạt, ăn uống và sản xuất. Cách xử lí nước phổ biến hiện nay là sử dụng nước chlorine hoặc các chất có chứa chlorine để khử trùng nước
Nhóm halogen gồm những nguyên tố nào? Halogen có những tính chất và ứng dụng trong lĩnh vực nào?

 Xem đáp án
Xem đáp án
- Nhóm halogen gồm những nguyên tố thuộc nhóm VIIA trong bảng tuần hoàn các nguyên tố hóa học: fluorine (F), chlorine (Cl), bromine (Br), iodine (I), astatine (At), tennessine (Ts).
- Tính chất vật lí của các nguyên tố halogen:
+ Các halogen ít tan trong nước, tan nhiều trong dung môi hữu cơ không phân cực như hexane (C6H14), carbon tetrachloride (CCl4), …
Từ fluorine đến iodine:
+ Trạng thái tập hợp của đơn chất ở 20oC thay đổi: fluorine và chlorine ở thể khí, bromine ở thể lỏng, iodine ở thể rắn.
+ Màu sắc đậm dần: fluorine có màu lục nhạt, chlorine có màu vàng lục, bromine có màu nâu đỏ, iodine có màu đen tím.
+ Nhiệt độ nóng chảy và nhiệt độ sôi tăng dần.
- Tính chất hóa học: Tính chất hóa học đặc trưng của halogen là tính oxi hóa mạnh, tính oxi hóa giảm dần từ fluorine đến iodine.
- Ứng dụng: Các halogen có ứng dụng rất quan trọng trong đời sống và sản xuất.
Câu 2:
Quan sát Hình 17.1, cho biết vị trí nhóm halogen trong bảng tuần hoàn.
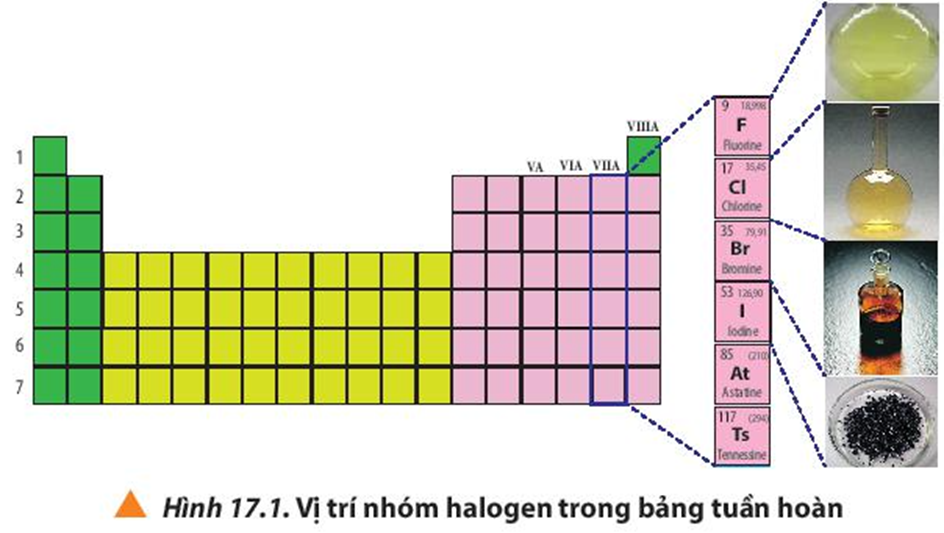
 Xem đáp án
Xem đáp án
Nhóm halogen gồm những nguyên tố thuộc nhóm VIIA trong bảng tuần hoàn các nguyên tố hóa học.
Câu 3:
Hãy kể tên một số chất chứa nguyên tố halogen
 Xem đáp án
Xem đáp án
Một số chất chứa nguyên tố halogen:
- Fluorapatite: Ca5(PO4)3F
- Cryolite: Na3AlF6
- Quặng halite: NaCl (thường gọi là muối mỏ)
- Sylvite: KCl
- Quặng bromargyrite (AgBr)
- Iodargyrite: AgI
Câu 4:
Từ các thông tin và quan sát Hình 17.2, nhận xét dạng tồn tại của các nguyên tố halogen trong tự nhiên

 Xem đáp án
Xem đáp án
Halogen trong tự nhiên không tồn tại ở dạng đơn chất, chủ yếu tồn tại dưới dạng muối của các ion halide (F-, Cl-, Br-, I-)
Câu 5:
Khoảng 71% bề mặt Trái Đất được bao phủ bởi biển và đại dương, phần còn lại là các lục địa và đảo. Theo em, hàm lượng nguyên tố halogen nào nhiều nhất trong tự nhiên?
 Xem đáp án
Xem đáp án
Cứ mỗi lít nước biển chứa khoảng 35 gam muối, phần lớn là sodium chloride (NaCl) hòa tan trong đó dưới dạng các ion Na+ và Cl-
Khoảng 71% bề mặt Trái Đất được bao phủ bởi biển và đại dương ⇒ Hàm lượng nguyên tố chlorine có nhiều nhất trong tự nhiên.
Câu 6:
Viết cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố halogen
 Xem đáp án
Xem đáp án
Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố halogen có dạng: ns2np5
Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố halogen:
+ F: 2s22p5
+ Cl: 3s23p5
+ Br: 4s24p5
+ I: 5s25p5
Câu 7:
Từ đặc điểm cấu hình electron lớp ngoài cùng của nguyên tử, nhận xét xu hướng hình thành liên kết trong phân tử halogen
 Xem đáp án
Xem đáp án
Do có 7 electron ở lớp ngoài cùng, chưa đạt cấu hình bền vững như khí hiếm, nên ở trạng thái tự do, hai nguyên tử halogen góp chung một cặp electron để hình thành phân tử halogen.
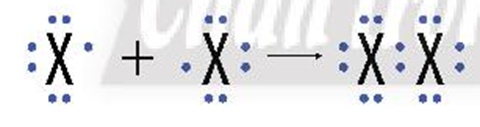
Với X là kí hiệu các nguyên tố halogen.
Công thức cấu tạo của phân tử halogen: X-X
Câu 8:
Dựa vào Bảng 17.1, nhận xét sự biến đổi về màu sắc, thể các chất ở điều kiện thường, nhiệt độ nóng chảy, nhiệt độ sôi của các đơn chất halogen
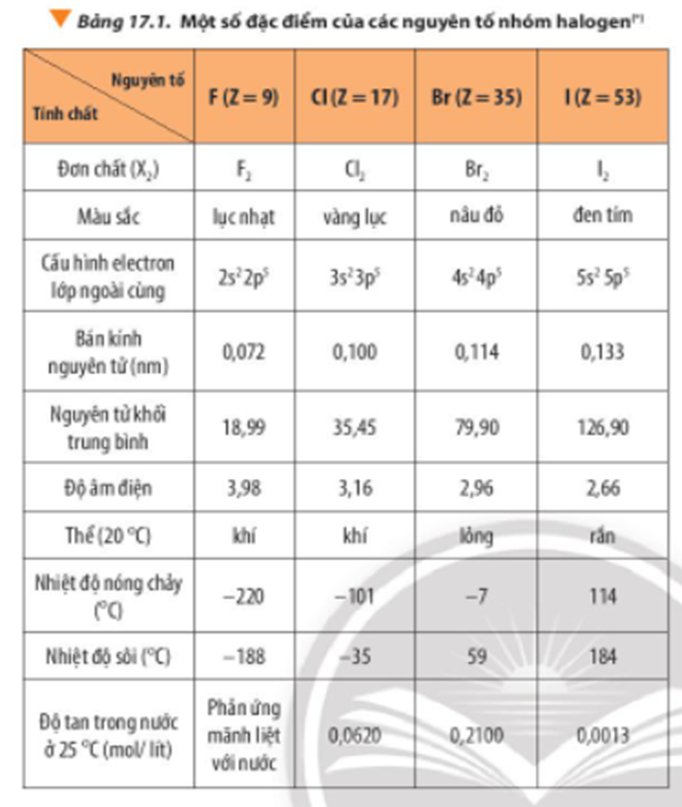
 Xem đáp án
Xem đáp án
Theo chiều tăng dần của điện tích hạt nhân nguyên tử (từ F2 đến I2)
- Màu sắc của các đơn chất halogen đậm dần.
- Trạng thái ở điều kiện thường: Từ thể khí chuyển sang thể lỏng và thể rắn.
- Nhiệt độ nóng chảy và nhiệt độ sôi tăng dần.
Câu 9:
Giải thích sự biến đổi nhiệt độ nóng chảy, nhiệt độ sôi từ fluorine đến iodine.
 Xem đáp án
Xem đáp án
Nhiệt độ nóng chảy và nhiệt độ sôi của đơn chất halogen bị ảnh hưởng bởi tương tác van der Waals giữa các phân tử. Từ fluorine đến iodine, khối lượng phân tử và bán kính nguyên tử tăng, làm tăng tương tác van der Waals, dẫn đến nhiệt độ nóng chảy và nhiệt độ sôi tăng.
Câu 10:
Ở điều kiện thường, hãy dự đoán astatine tồn tại ở thể khí, thể lỏng hay thể rắn. Giải thích
 Xem đáp án
Xem đáp án
Dựa vào quy luật biến đối trạng thái của các nguyên tố halogen theo chiều tăng dần điện tích hạt nhân: Từ thể khí chuyển sang thể lỏng và thể rắn.
Mà iodine tồn tại ở thể rắn ⇒ Ta có thể dự đoán astatine tồn tại ở thể rắn.
Câu 11:
Từ cấu tạo phân tử halogen và đặc điểm cấu hình electron lớp ngoài cùng của nguyên tử, nhận xét xu hướng hình thành liên kết của nguyên tử halogen trong các phản ứng hóa học
 Xem đáp án
Xem đáp án
Halogen có cấu hình electron lớp ngoài cùng là ns2np5, nên nguyên tử có xu hướng nhận thêm 1 electron hoặc dùng chung electron với nguyên tử khác để đạt cấu hình electron bền vững của khí hiếm tương ứng
Sơ đồ tổng quát: X + 1e → X-
Câu 12:
Trong phản ứng với kim loại, nhận xét sự biến đổi số oxi hóa của nguyên tử các nguyên tố halogen và viết các quá trình khử xảy ra
 Xem đáp án
Xem đáp án
Trong phản ứng với kim loại số oxi hóa của nguyên tử các nguyên tố halogen giảm. Mỗi nguyên tử halogen từ số oxi hóa 0 sẽ nhận thêm 1 electron thành số oxi hóa -1.
Các quá trình khử xảy ra:
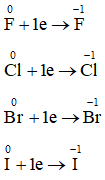
Câu 13:
Dựa vào điều kiện phản ứng với hydrogen và giá trị năng lượng liên kết của phân tử H – X, giải thích khả năng phản ứng của các halogen với hydrogen.

 Xem đáp án
Xem đáp án

Theo chiều từ F2 đến I2 khả năng phản ứng với H2 ở điều kiện khó khăn hơn.
Năng lượng liên kết của phân tử H-X giảm dần hay độ bên của phân tử HX giảm dần.
⇒ Khả năng phản ứng của các halogen với hydrogen giảm dần.Câu 14:
 Xem đáp án
Xem đáp án
Phản ứng của chlorine với dung dịch kiềm:
Trong phản ứng với dung dịch kiềm ở hai điều kiện nhiệt độ khác nhau, số oxi hóa của chlorine vừa tăng, vừa giảm sau phản ứng ⇒ Cl2 vừa đóng vai trò là chất khử, vừa đóng vai trò là chất oxi hóa
⇒ Phản ứng này thuộc loại phản ứng oxi hóa – khử.
Câu 15:
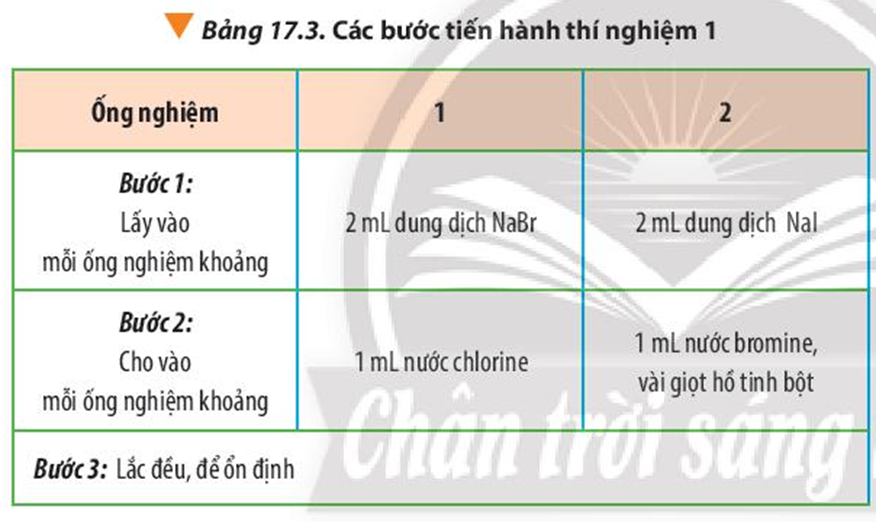
Tiến hành thí nghiệm 1, quan sát và ghi nhận hiện tượng.
Thí nghiệm 1: So sánh tính chất hóa học của halogen
Hóa chất: dung dịch NaBr, NaI, nước chlorine, nước bromine và dung dịch hồ tinh bột.
Dụng cụ: ống nghiệm, ống hút nhỏ giọt, kẹp gỗ, giá để ống nghiệm.
Tiến hành: Thực hiện các bước theo Bảng 17.3
 Xem đáp án
Xem đáp án
Hiện tượng:
- Ống nghiệm 1: Dung dịch từ không màu chuyển sang màu vàng.
- Ống nghiệm 2: Dung dịch không màu chuyển thành màu vàng, có hơi màu tím thoát ra. Khi cho thêm hồ tinh bột vào thấy dung dịch chuyển sang màu xanh tím.

Câu 16:
Dựa vào phương trình hóa học của các phản ứng, giải thích kết quả thí nghiệm 1.
 Xem đáp án
Xem đáp án
Giải thích kết quả thí nghiệm 1:
- Ống nghiệm 1: Dung dịch NaBr không màu của chuyển sang màu vàng của Br2 do có phản ứng.
Cl2 + 2NaBr → 2NaCl + Br2
- Ống nghiệm 2: Dung dịch NaI không màu chuyển thành màu vàng, có hơi màu tím thoát ra. Khi cho thêm hồ tinh bột vào thấy dung dịch chuyển sang màu xanh tím do I2 gặp hồ tinh bột.
Br2 + 2NaI → 2NaBr + I2
Câu 17:
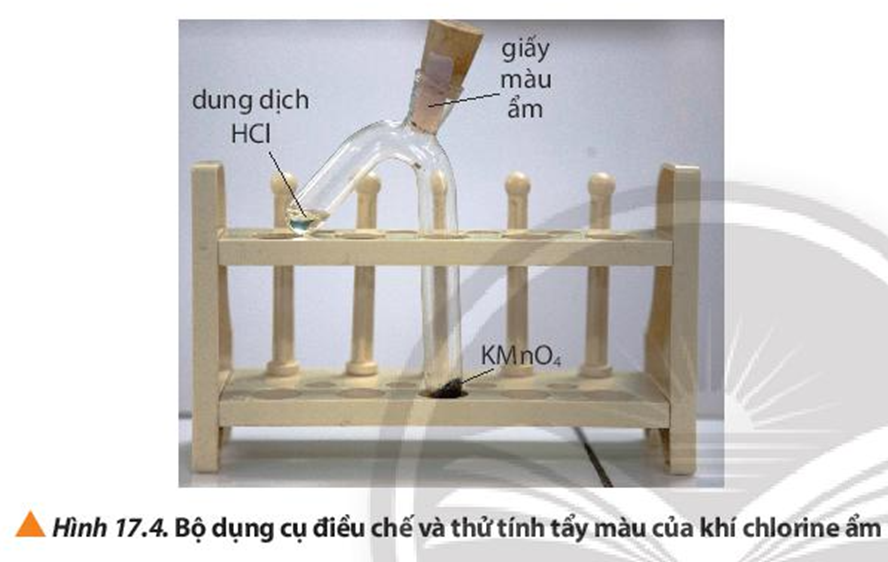
Tiến hành thí nghiệm 2, quan sát và ghi nhận hiện tượng.
Thí nghiệm 2: Tính tẩy màu của khí chlorine ẩm
Hóa chất: tinh thể potassium permanganate (KMnO4), dung dịch HCl đặc, giấy màu, nước cất.
Dụng cụ: ống nghiệm 2 nhánh, nút cao su, giá đỡ, thìa thủy tinh, ống hút nhỏ giọt.
Tiến hành:
Bước 1: Dùng thìa thủy tinh lấy một ít tinh thể KMnO4, cho vào nhánh dài của ống nghiệm. Dùng ống hút nhỏ giọt lấy khoảng 1 mL dung dịch HCl đặc cho vào nhánh ngắn của ống nghiệm. Lắp dụng cụ để điều chế khí Cl2 ẩm như Hình 17.4.
Lưu ý: Kiểm tra nút cao su phải được đậy kín trước khi thực hiện bước 2.
Bước 2: Nghiêng ống nghiệm sao cho dung dịch HCl tiếp xúc với KMnO4.
Phương trình hóa học của phản ứng điều chế khí Cl2:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
 Xem đáp án
Xem đáp án
Hiện tượng: KMnO4 tan trong HCl và KMnO4 bị mất màu. Có khí màu vàng lục thoát ra làm giấy màu ẩm bị mất màu.
Câu 18:
Dựa vào phương trình hóa học của các phản ứng, giải thích kết quả thí nghiệm 2.
 Xem đáp án
Xem đáp án
Phương trình hóa học của phản ứng điều chế khí Cl2:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
KMnO4 đã phản ứng với HCl tạo khí Cl2 có màu vàng lục.
Khí Cl2 tác dụng chậm với nước tạo thành HCl và HClO, trong đó HClO có tính oxi hóa mạnh nên có khả năng tẩy màu.
Cl2 + H2O ⇌ HCl + HClO
Câu 19:
Viết phương trình hóa học của các phản ứng sau:
Cu + Cl2 → (1)
Al + Br2 → (2)
Ca(OH)2 + Cl2 → (3)
KOH + Br2 (4)
Cl2 + KBr → (5)
Br2 + NaI → (6)
 Xem đáp án
Xem đáp án
Cu + Cl2 → CuCl2 (1)
2Al + 3Br2 → 2AlBr3 (2)
2Ca(OH)2 + 2Cl2 → CaCl2 + Ca(OCl)2 + 2H2O (3)
6KOH + 3Br2 5KBr + KBrO3 + 3H2O (4)
Cl2 + 2KBr → 2KCl + Br2 (5)
Br2 + 2NaI → 2NaBr + I2 (6)
Câu 20:
Tính tẩy màu của khí chlorine ẩm được ứng dụng vào lĩnh vực nào trong đời sống?
 Xem đáp án
Xem đáp án
Tính tẩy màu của khí chlorine ẩm được ứng dụng:
+ Tẩy trắng sợi, vải, giấy.
+ Sản xuất chất tẩy rửa.
+ Tiệt trùng nước sinh hoạt, nước trong các bể bơi.
Câu 21:
Nhận xét vai trò của halogen trong đời sống, sản xuất và y tế
 Xem đáp án
Xem đáp án
Halogen có vai trò rất quan trọng trong đời sống, sản xuất và y tế.
- Fluorine: được sử dụng để sản xuất các chất dẻo ma sát thấp: teflon phủ trên bề mặt chảo, thiết bị nhà bếp, dụng cụ thí nghiệm,… Hợp chất của fluorine dùng trong sản xuất nhôm, thuốc trừ sâu, chống gián,…. Một số muối fluorien được thêm vào thuốc đánh răng, tạo men răng,…

- Chlorine: được sử dụng để tẩy trắng, khử trùng nước, sản xuất dung môi hữu cơ,…

- Bromine: Điều chế thuốc an thần, thuốc trừ sâu, thuốc nhuộm, mực in, silver bromide,…

- Iodine: là nguyên tố vi lượng cần thiết cho cơ thể, giúp ngăn ngừa bướu cổ, thiểu năng trí tuệ. Hỗn hợp ethanol và iodine là chất sát trùng phổ biến. Hợp chất iodine được sử dụng làm chất xúc tác, dược phẩm, thuốc nhuộm,…
Câu 22:
Tìm hiểu thêm những ứng dụng khác của halogen trong thực tế.
 Xem đáp án
Xem đáp án
- Người ta sử dụng phản ứng giữa chlorine với dung dịch sodium hydroxide lạnh để tạo ra nước Javel có tính oxi hóa mạnh phục vụ mục đích sát khuẩn, vệ sinh gia dụng.
Cl2 + 2NaOH → NaCl + NaClO + H2O

- Ứng dụng làm đèn halogen: Sự kết hợp của khí halogen (iodine và bromine) và sợi wolfram tạo ra phản ứng hóa học chu trình halogen làm bổ sung wolfram cho dây tóc, tăng tuổi thọ và duy trì độ trong suốt của vỏ bóng đèn.

- Fluorine được dùng làm chất sinh hàn trong tủ lạnh. Ngoài ra còn dùng trong công nghiệp hạt nhân để làm giàu 235U.
- Hợp chất của bromine được dùng nhiều trong công nghiệp dầu mỏ, hóa chất cho nông nghiệp.
Câu 23:
Tại sao có thể sử dụng nước Javel để tẩy những vết mực trên áo trắng, nhưng lại không nên sử dụng trên vải quần, áo có màu?
 Xem đáp án
Xem đáp án
Nước Javel (hỗn hợp NaCl và NaClO) có tính oxi hóa mạnh, có tính tẩy màu nên có thể tẩy được vết mực trên áo trắng nhưng không nên sử dụng trên vải quần, áo màu vì nước Javel sẽ làm mất màu của quần áo đó.
Câu 24:
Hoàn thành các phương trình minh họa tính chất hóa học của các nguyên tố halogen
a) Cl2 + H2 →
b) F2 + Cu →
c) I2 + Na →
d) Cl2 + Fe →
e) Br2 + Ca(OH)2 →
f) Cl2 + KOH
g) Br2 + KI →
 Xem đáp án
Xem đáp án
a) Cl2 + H2 2HCl
b) F2 + Cu → CuF2
c) I2 + 2Na 2NaI
d) 3Cl2 + 2Fe 2FeCl3
e) 2Br2 + 2Ca(OH)2 → CaBr2 + Ca(OBr)2 + 2H2O
f) 3Cl2 + 6KOH 5KCl + KClO3 + 3H2O
g) Br2 + 2KI → 2KBr + I2
Câu 25:
Giải thích vì sao các nguyên tố halogen không tồn tại ở dạng đơn chất trong tự nhiên.
 Xem đáp án
Xem đáp án
Halogen có cấu hình electron lớp ngoài cùng là ns2np5, nên nguyên tử dễ dàng nhận thêm 1 electron hoặc dùng chung electron với nguyên tử khác để đạt cấu hình electron bền vững của khí hiếm tương ứng từ đó tạo nên các hợp chất hóa học.
Vì vậy các nguyên tố halogen không tồn tại ở dạng đơn chất trong tự nhiên.
Câu 26:
Chlorine B (C6H5ClNNaO2S) là chất thường được sử dụng để sát khuẩn trên các bề mặt, vật dụng hoặc dùng để khử trùng, sát khuẩn, xử lí nước sinh hoạt. Ở nồng độ cao, chloramine B có tác dụng diệt nấm mốc, vi khuẩn, virus gây bệnh cho người. Chloramine B có dạng viên nén (mỗi viên có khối lượng 0,3 – 2,0 gam) và dạng bột. Chloramine B 25% (250 mg chlorine hoạt tính trong một viên nén như hình bên) được dùng phổ biến, vì tiện dụng khi pha chế và bảo quản.
a) Nồng độ chloramine B khi hòa tan vào nước đạt 0,001% có tác dụng sát khuẩn dùng trong xử lí nước sinh hoạt. Cần dùng bao nhiêu viên nén chloramine B 25% (loại viên 1 gam) để xử lí bình chứa 200 lít nước?
b) Chloramine B nồng độ 2% dùng để xịt trên các bề mặt vật dụng nhằm sát khuẩn, virus gây bệnh. Để pha chế dung dịch này, sử dụng chloramine B 25% dạng bột, vậy cần bao nhiêu gam bột chloramine B 25% pha với 1 lít nước để được dung dịch sát khuẩn 2%

 Xem đáp án
Xem đáp án
a) 200 lít nước ⇔ 200 000 g nước
250 mg = 0,25 g
Đặt x là số viên nén chloramine B 25% (loại viên 1 gam)
⇒ m chất tan = 0,25x (gam)
Áp dụng công thức tính nồng độ phần trăm:
⇔
⇔ x = 8
Vậy cần dùng 8 viên nén chloramine B 25% (loại viên 1 gam) để xử lí bình chứa 200 lít nước.
b) 1 lít nước ⇔ 1 kg nước = 1000 g nước.
Đặt y là khối lượng chloramine B 25% dạng bột cần dùng
⇒ m chất tan = 0,25.y (gam)
Áp dụng công thức tính nồng độ phần trăm:
⇔
⇔ y = 81,6 gam
Vậy cần dử dụng 81,6 gam chloramine B 25% dạng bột pha với 1 lít nước để được dung dịch sát khuẩn 2%.
