Đề kiểm tra Học kì 1 Hóa 10 - Bộ sách Kết nối tri thức có đáp án (Đề 2)
-
1220 lượt thi
-
31 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Trong các sản phẩm sau, sản phẩm nào không phải là sản phẩm của hóa học?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Thực phẩm biến đổi gen là sản phẩm của sinh học.
Câu 2:
Hạt nhân của nguyên tử nguyên tố A có 24 hạt, trong đó số hạt không mang điện là 12. Số electron trong A là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Số electron = số proton = 24 – 12 = 12 (hạt).
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Số proton = số hiệu nguyên tử (Z) = 13.
Số neutron = A – Z = 27 – 13 = 14.
Câu 4:
Có những phát biểu sau đây về các đồng vị của một nguyên tố hóa học:
(1) Các đồng vị có tính chất hóa học giống nhau.
(2) Các đồng vị có tính chất vật lí khác nhau.
(3) Các đồng vị có cùng số electron ở vỏ nguyên tử.
(4) Các đồng vị có cùng số proton nhưng khác nhau về số khối.
Trong các phát biểu trên, số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Cả 4 phát biểu đều đúng.
Câu 5:
Orbital nguyên tử là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Orbital nguyên tử là khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron lớn nhất.
Câu 6:
Lớp M có số orbital tối đa bằng
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Lớp M (n = 3) có số orbital tối đa là n2 = 32 = 9.
Câu 7:
Sự phân bố electron theo ô orbital nào dưới đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Trường hợp A, D sai vì 2 electron trong cùng một ô AO phải có chiều tự quay ngược nhau.
Trường hợp C sai vì số electron độc thân chưa đạt tối đa.
Câu 8:
Cho các nguyên tố với số hiệu nguyên tử sau: X (Z = 1); Y (Z = 7); E (Z = 12); T (Z = 19). Dãy gồm các nguyên tố kim loại là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
X (Z = 1): 1s1 Þ X là phi kim (trường hợp đặc biệt hydrogen).
Y (Z = 7): 1s22s22p3 Þ Y là phi kim (do có 5 electron ở lớp ngoài cùng).
E (Z = 12): 1s22s22p63s2 Þ E là kim loại (do có 2 electron ở lớp ngoài cùng).
T (Z = 19): 1s22s22p63s23p64s1 Þ T là kim loại (do có 1 electron ở lớp ngoài cùng).
Câu 9:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Chu kì 3 của bảng hệ thống tuần hoàn có 8 nguyên tố.
Câu 10:
Hạt nhân nguyên tử Y có 15 proton. Vị trí của Y trong bảng tuần hoàn là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cấu hình electron nguyên tử Y: 1s22s22p63s23p3
Vậy Y ở:
+ Ô thứ 15 (Z = E = P = 15)
+ Chu kì 3 (do có 3 lớp electron).
+ Nhóm VA (do 5 electron hóa trị, nguyên tố p).
Câu 11:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Trong một nhóm, từ trên xuống dưới thì số lớp electron tăng dần.Câu 12:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Nguyên tố có độ âm điện lớn nhất là F (Z = 9), có cấu hình electron: 1s22s22p5.Câu 13:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Cấu hình electron nguyên tử R là: 1s22s22p63s23p5.
Vậy R thuộc nhóm VIIA, công thức oxide cao nhất của R là: R2O7.
Câu 14:
Nguyên tố X ở chu kì 3, nhóm IIA của bảng tuần hoàn. Cấu hình electron của nguyên tử nguyên tố X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
X ở chu kì 3 nên có 3 lớp electron.
X ở nhóm IIA nên có 2 electron ở lớp ngoài cùng.
Cấu hình electron của nguyên tử nguyên tố X: 1s²2s²2p63s².
Câu 15:
Nguyên tố K có số hiệu nguyên tử là 19. Phát biểu nào sau đây về K là không đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phát biểu A và C đúng vì số electron = số proton = số hiệu nguyên tử = 19.
Phát biểu B đúng vì cấu hình electron của K là: 1s22s22p63s23p64s1 Þ K có 4 lớp electron, lớp ngoài cùng có 1 electron.
Phát biểu D sai vì K là kim loại.
Câu 16:
Nitrogen (N) là nguyên tố thuộc nhóm VA, chu kì 2 của bảng tuần hoàn. Cho các phát biểu sau:
(a) Nguyên tử N có 2 lớp electron và có 5 electron lớp ngoài cùng.
(b) Công thức oxide cao nhất của N có dạng NO2 và là acidic oxide.
(c) Nguyên tố N có tính phi kim mạnh hơn nguyên tố O (Z = 8).
(d) Hydroxide ứng với oxide cao nhất của N có dạng HNO3 và có tính acid.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Các phát biểu đúng: a, d.
Ta có cấu hình electron N (Z = 7): 1s22s22p3
(b) sai vì công thức oxide cao nhất của N có dạng N2O5.
(c) Sai vì N và O cùng chu kì. Trong cùng chu kì theo chiều tăng dần của điện tích hạt nhân tính phi kim tăng dần nên tính phi kim O mạnh hơn N.
Câu 17:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
Câu 18:
Trong các hợp chất, nguyên tử magnesium đã đạt được cấu hình bền của khí hiếm gần nhất bằng cách
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Cấu hình electron nguyên tử Mg: 1s22s22p63s2
Mg có 2 electron ở lớp ngoài cùng, có xu hướng nhường đi 2 electron này để đạt được cấu hình electron bền vững của khí hiếm gần nhất.
Câu 19:
Công thức electron nào sau đây không đủ electron theo quy tắc octet?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Trong công thức 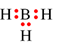 , nguyên tử B chưa đạt octet.
, nguyên tử B chưa đạt octet.
Câu 20:
Khi nguyên tử nhường hoặc nhận electron sẽ tạo thành
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Khi nguyên tử nhường hoặc nhận electron sẽ tạo thành ion.
Câu 21:
Quá trình tạo thành ion Ca2+ nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Ca (Z = 20): [Ar]4s2
Ca có 2 electron ở lớp ngoài cùng, có xu hướng nhường 2 electron này để đạt được cấu hình electron bền vững của khí hiếm.
Ca → Ca2+ + 2e.
Câu 22:
Liên kết ion là loại liên kết hoá học được hình thành nhờ lực hút tĩnh điện giữa các phần tử nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Liên kết ion là loại liên kết hoá học được hình thành nhờ lực hút tĩnh điện giữa cation và anion.
Câu 23:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phân tử KCl được hình thành do sự kết hợp giữa ion K+ và ion Cl-.
Câu 24:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Liên kết tạo thành do sự góp chung electron thuộc loại liên kết cộng hóa trị.
Câu 25:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Độ âm điện của: F > Cl > Br > I nên liên kết trong phân tử HF là phân cực nhất.
Câu 26:
Liên kết σ là liên kết được hình thành do
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Liên kết σ là liên kết được hình thành do sự xen phủ trục của hai orbital.
Câu 27:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Tương tác van der Waals được hình thành do tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử.
Câu 28:
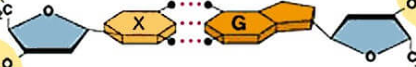
Các liên kết biểu diễn bằng dấu “•••” có vai trò quan trọng trong việc làm bền chuỗi xoắn đôi DNA. Đó là loại liên kết gì?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Liên kết hydrogen thường được biểu diễn bằng dầu “•••”Câu 29:
Vận dụng quy tắc octet để giải thích sự tạo thành liên kết trong phân tử F2. Biết F (Z = 9).
 Xem đáp án
Xem đáp án
F (Z = 9): 1s22s22p5.
Khi hình thành liên kết hóa học trong phân tử F2, nguyên tử fluorine có 7 electron hóa trị, mỗi nguyên tử fluorine cần thêm 1 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử fluorine góp chung 1 electron.
Phân tử F2 được biểu diễn: 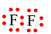 . Xung quanh mỗi nguyên tử F đều có 8 electron.
. Xung quanh mỗi nguyên tử F đều có 8 electron.
Câu 31:
 Xem đáp án
Xem đáp án
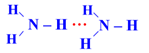
- Nhiệt độ sôi của NH3 cao hơn nhiệt độ sôi của PH3 do NH3 tạo được liên kết hydrogen liên phân tử còn PH3 thì không:
- NH3 có độ tan trong nước lớn hơn PH3 do NH3 tạo được liên kết hydrogen với H2O:

