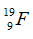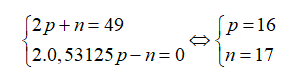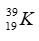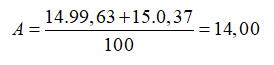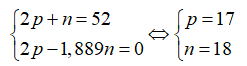Đề thi giữa kì 1 Hóa 10 có đáp án (Bài số 1 - Đề 3)
-
1075 lượt thi
-
30 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 3:
Một nguyên tử được đặc trưng cơ bản bằng
 Xem đáp án
Xem đáp án
Chọn đáp án D
Số đơn vị điện tích hạt nhân Z và số khối A đặc trưng cho hạt nhân và cũng đặc trưng cho nguyên tử vì khi biết Z và A sẽ biết được số proton, số notron và số electron.
Câu 4:
Nguyên tử có số e là 13 thì cấu hình lớp ngoài cùng là
 Xem đáp án
Xem đáp án
Chọn D
Cấu hình electron của nguyên tử đó là:
→ Cấu hình electron lớp ngoài cùng là:
Câu 5:
Trong nguyên tử X các e được phân bố trên 3 lớp, lớp thứ 3 có 8e. Điện tích hạt nhân của nguyên tử X là
 Xem đáp án
Xem đáp án
Chọn C
Cấu hình electron của X là:
Số hiệu nguyên tử X = số electron = 18.
Điện tích hạt nhân X là 18+.
Câu 7:
Có bao nhiêu electron trong ion ?
 Xem đáp án
Xem đáp án
Chọn A
Crom có p = e = 24 hạt, có e = 21 (do đã nhường 3 e).
Câu 10:
Cho số hiệu nguyên tử của cacbon, nitơ, oxi và flo lần lượt là 6, 7, 8, 9 và số khối của chúng lần lượt là 12, 14, 16, 19. Xét kí hiệu nào sau đây viết sai?
 Xem đáp án
Xem đáp án
Chọn D
Kí hiệu đúng là
Câu 11:
Kí hiệu nào trong số các kí hiệu của các phân lớp sau là sai?
 Xem đáp án
Xem đáp án
Chọn A
Không có phân lớp 2d.
Câu 12:
A có điện tích hạt nhân là 25. Vậy A là?
 Xem đáp án
Xem đáp án
Chọn A
Trật tự phân mức năng lượng:
Electron cuối cùng được điền vào phân lớp d theo trật tự phân mức năng lượng. Vậy A là nguyên tố d.
Câu 14:
Cho 2 kí hiệu nguyên tử: và chọn câu trả lời đúng
 Xem đáp án
Xem đáp án
Chọn D
A sai vì điện tích của hạt nhân A là 11+, điện tích của hạt nhân B là 12+.
B sai vì A có 11 electron và B có 12 electron.
C sai vì A và B có số proton khác nhau nên không là đồng vị của nhau.
Câu 16:
Nguyên tử của nguyên tố A có tổng số electron trong các phân lớp p là 7. Nguyên tử của nguyên tố B có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của A là 8. Số đơn vị điện tích hạt nhân của A và B là
 Xem đáp án
Xem đáp án
Chọn A
Cấu hình electron của A là
→ Số đơn vị điện tích hạt nhân của A là 13.
Số hạt mang điện trong A là 13.2 = 26 → Số hạt mang điện trong B là 26 + 8 = 34.
→ Số đơn vị điện tích hạt nhân của B là 34 : 2 = 17.
Câu 17:
Nguyên tử của nguyên tố X có tổng số hạt cơ bản là 49, trong đó số hạt không mang điện bằng 0,53125 số hạt mang điện. Điện tích hạt nhân của X là
 Xem đáp án
Xem đáp án
Chọn D
Gọi số hạt proton, nơtron và electron trong X lần lượt là p, n và e.
Theo bài ra ta có:
Điện tích hạt nhân nguyên tử X là 16+.
Câu 18:
Trong nguyên tử một nguyên tố A có tổng số các loại hạt là 58. Biết số hạt proton ít hơn số hạt nơtron là 1 hạt. Kí hiệu của A là
 Xem đáp án
Xem đáp án
Chọn B
Tổng số hạt proton, nơtron và electron trong 1 nguyên tử nguyên tố A là 58:
p + e + n = 58 hay 2p + n = 58 (do p = e) (1)
Số hạt p ít hơn số hạt n là 1 hạt:
n- p =1 (2)
Giải (1), (2) ta có p = e = 19, n = 20
Vậy A có số hiệu nguyên tử = số p = 19; Số khối của A là 19 + 20 = 39.
→ Kí hiệu nguyên tử A là:
Câu 19:
Các đồng vị được phân biệt bởi yếu tố nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Các đồng vị được phân biệt bởi số nơtron.
Đồng vị là những nguyên tố hóa học có cùng số proton nhưng khác nhau về số nơtron.
Câu 21:
Dựa vào thứ tự mức năng lượng, xét xem sự xắp xếp các phân lớp nào sau đây sai?
 Xem đáp án
Xem đáp án
Chọn A
Mức năng lượng ở phân lớp 3d > 4s.
Câu 22:
Tổng số hạt cơ bản trong một nguyên tử là
 Xem đáp án
Xem đáp án
Chọn C
Tổng số hạt cơ bản trong Cr = p + n + e = A + e = 52 + 24 = 76.
Câu 23:
Nitơ trong thiên nhiên là hỗn hợp gồm hai đồng vị có % về số nguyên tử tương ứng là (99,63%) và (0,37%). Nguyên tử khối trung bình của nitơ là
 Xem đáp án
Xem đáp án
Chọn B
Câu 25:
Tổng số hạt n, p, e trong một nguyên tử X là 52, trong đó số hạt mang điện bằng 1,889 lần số hạt không mang điện. Kết luận nào không đúng?
 Xem đáp án
Xem đáp án
Chọn D
Theo bài ra ta có hệ phương trình:
Cấu hình electron của X là → X có 7e lớp ngoài cùng nên là phi kim.
Số khối của X là: 18 + 17 = 35.
Điện tích hạt nhân X là 17+.
Câu 27:
Một nguyên tố hoá học có thể có nhiều nguyên tử có khối lượng khác nhau vì lí do nào dưới đây?
 Xem đáp án
Xem đáp án
Chọn B
Câu 28:
Cho hai nguyên tố A và B có số hiệu nguyên tử lần lượt là 11 và 13. Cấu hình electron của A và B lần lượt là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Cấu hình electron của A là: 1s21s22p63s1
Cấu hình electron của B là: 1s22s22p63s23p1
Lưu ý: Cách viết cấu hình electron:
Bước 1: Xác định số electron của nguyên tử.
Bước 2: Điền các electron của nguyên tử vào các phân lớp theo sơ đồ năng lượng (đầy phân lớp trong mới điền ra phân lớp ngoài).
Sơ đồ mức năng lượng: 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p….
Bước 3: Khi bắt đầu có phân lớp 3d xuất hiện thì ta phải sắp xếp lại (không điền lại) các phân lớp thành từng lớp theo thứ tự tăng dần. Ta được cấu hình electron.