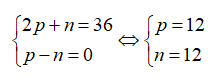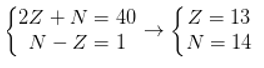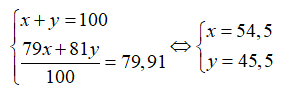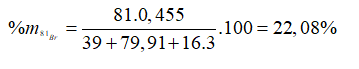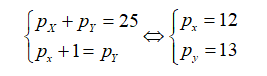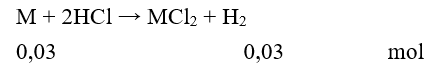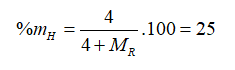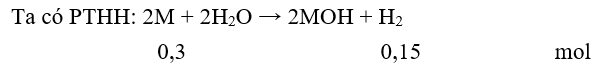Đề thi Hóa học 10 Giữa học kì 1 năm 2020 - 2021 có đáp án (Đề 3)
-
1122 lượt thi
-
30 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung, gọi là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 2:
Liên kết hoá học giữa H và O trong phân tử là liên kết
(Cho độ âm điện H và O lần lượt là 2,2 và 3,44)
 Xem đáp án
Xem đáp án
Đáp án C
Nguyên tử oxi có độ âm điện lớn hơn nhiều so với nguyên tử hiđro.
Ngoài ra, xét liên kết H – O, có hiệu độ âm điện 1,24
→ Liên kết cộng hóa trị phân cực
Câu 4:
Tổng số hạt trong nguyên tử một nguyên tố R là 36. Số hạt mang điện gấp đôi hạt không mang điện. R là
 Xem đáp án
Xem đáp án
Đáp án A
Gọi số proton, nơtron và electron của R lần lượt là p, n và e.
Ta có:
Vậy R là Mg.
Câu 5:
Nguyên tử các nguyên tố thuộc nhóm VA có số electron lớp ngoài cùng là
 Xem đáp án
Xem đáp án
Đâp án C
Số electron lớp ngoài cùng = STT nhóm A = 5.
Câu 6:
Cho nguyên tố X có số hiệu nguyên tử là 18, vị trí của nguyên tố trong bảng tuần hoàn các nguyên tố hoá học là
 Xem đáp án
Xem đáp án
Đáp án A
Cấu hình electron nguyên tử X:
X ở ô số 18 (z = 18), chu kỳ 3 (có 3 lớp e), nhóm VIIIA (8 electron lớp ngoài cùng, nguyên tố p).
Câu 7:
Nguyên tố R thuộc nhóm VIA. Công thức oxit cao nhất của R và công thức hợp chất khí với hiđro của R là
 Xem đáp án
Xem đáp án
Đáp án D
R thuộc nhóm VIA → Hóa trị của R trong oxit cao nhất là VI, hóa trị của R trong hợp chất khí với H là II.
→ Công thức oxit cao nhất của R và công thức hợp chất khi với hiđro lần lượt là và .
Câu 8:
Nguyên tử của nguyên tố R có 3 electron thuộc phân lớp 3d. Vị trí của nguyên tố R trong bảng tuần hoàn là vị trí nào sau đây
 Xem đáp án
Xem đáp án
Đáp án A
Cấu hình electron của nguyên tử R là:
R thuộc chu kỳ 4 do có 4 lớp electron, nhóm VB do 5 electron hóa trị và nguyên tố d. Nguyên tử R có 23 electron vậy R thuộc ô số 23.
Câu 9:
Có những tính chất sau đây của nguyên tố:
(1) Hóa trị của nguyên tố trong hợp chất với oxi;
(2) Bán kính nguyên tử;
(3) Tính kim loại – phi kim;
(4) Tính axit – bazơ của hợp chất hiđroxit.
Trong các tính chất trên, số tính chất biến đổi tuần hoàn trong một nhóm A là
 Xem đáp án
Xem đáp án
Đáp án C
Trong một nhóm A, các tính chất 1, 3, 4 biến đổi tuần hoàn.
Câu 10:
Tổng số các hạt proton, nơtron và electron trong nguyên tử của một nguyên tố là 40. Biết số hạt nơtron lớn hơn số hạt proton là 1. Cho biết nguyên tố trên thuộc loại nguyên tố nào?
 Xem đáp án
Xem đáp án
Đáp án B
Giả sử số proton, số nơtron, số electron của nguyên tố trên lần lượt là p; n và e.
Trong đó: p =e =z.
Ta có hpt:
Cấu hình electron của nguyên tố là:
Nhận thấy electron cuối cùng điền vào phân lớp p → nguyên tố trên thuộc loại nguyên tố p
Câu 11:
Bán kính nguyên tử của các nguyên tố: được xếp theo thứ tự tăng dần từ trái sang phải là
 Xem đáp án
Xem đáp án
Đáp án C
Ta có:
Li: [He] → Li ở chu kỳ 2, nhóm IA.
O: [He]→ O ở chu kỳ 2, nhóm VIA.
F: [He]→ F ở chu kỳ 2, nhóm VIIA.
Na: [He] → Na ở chu kỳ 3, nhóm IA.
Có Li và Na ở cùng nhóm IA, nên bán kính nguyên tử Na > Li.
Có Li, O và F cùng thuộc chu kỳ 2, nên bán kính nguyên tử Li > O > F.
Chiều tăng bán kính nguyên tử là: F < O < Li < Na.
Câu 12:
Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án D
A sai vì trong nguyên tử, số p = số e.
B sai vì nguyên tử có cùng số proton thuộc cùng nguyên tố hóa học.
C sai vì không phải nguyên tử nào cũng có số p = số n.
D đúng vì M có cấu hình electron nguyên tử: [Ne] nên thuộc chu kỳ 3, nhóm IA.
Câu 13:
Anion đơn nguyên tử Xn- có tổng số hạt mang điện là 18. Vị trí của nguyên tố X trong bảng tuần hoàn các nguyên tố hóa học là
 Xem đáp án
Xem đáp án
Đáp án D
Vì X có Z < 18 : 2= 9
Câu 14:
Hai nguyên tử của nguyên tố X và Y có cấu hình electron ở lớp ngoài cùng là 4pa và 4sb. Tổng số electron ở hai phân lớp ngoài cùng của X và Y là 7. Biết X không phải là khí hiếm. Vậy Y và X lần lượt là
 Xem đáp án
Xem đáp án
Đáp án B
X và Y có cấu hình electron ở lớp ngoài cùng là và
a + b = 7.
Mà X không phải là khí hiếm → a = 5, b = 2.
Cấu hình electron của X là
→ X có số hiệu nguyên tử = số electron = 35 → X là Br.
Cấu hình electron của Y là
→ Y có số hiệu nguyên tử = số electron = 20 → Y là Ca.
Câu 15:
Chỉ ra nội dung sai khi nói về ion:
 Xem đáp án
Xem đáp án
Đáp án B
Ion âm gọi là anion, ion dương gọi là cation.
Câu 16:
Trong tự nhiên Brom có hai đồng vị là và . Biết nguyên tử khối trung bình của Brom là 79,91. Phần trăm khối lượng đồng vị 81Br trong muối là (biết Br (K = 39), O (M = 16))
 Xem đáp án
Xem đáp án
Đáp án C
Gọi % số nguyên tử của mỗi đồng vị và là x và y. Ta có:
Giả sử có 1 mol , số mol = 0,455 mol
Câu 17:
Hai nguyên tố X và Y đứng kế tiếp nhau trong một chu kì và có tổng số proton trong hai hạt nhân là 25, trong đó X có số proton nhở hơn Y. Hai nguyên tố X và Y lần lượt là
 Xem đáp án
Xem đáp án
Đáp án A
Gọi số proton của X và Y lần lượt là và .
Theo bài ra ta có:
Vậy X là Mg còn Y là Al.
Câu 18:
A, T là hai nguyên tố thuộc cùng một phân nhóm chính và ở hai chu kỳ liên tiếp nhau trong bảng BTTH, có tổng số hạt mang điện trong nguyên tử của A và T là 64 (trong đó ). Cấu hình electron của nguyên tử A và T lần lượt là
 Xem đáp án
Xem đáp án
Đáp án A
Tổng số hạt mang điện trong A và T là 64 nên:
2 + 2 = 64 → + = 32 (1). Vậy A và T thuộc các chu kỳ nhỏ
hay + 8 = (2)
Từ (1) và (2) → ZA = 12 và ZT = 20.
Vậy cấu hình electron nguyên tử của A và T lần lượt là: [Ne] và [Ar].
Câu 19:
Cho 1,2 gam một kim loại thuộc nhóm IIA trong bảng HTTH tác dụng với HCl thu được 0,672 lít khí (đktc). Kim loại đó là
 Xem đáp án
Xem đáp án
Đáp án C
Gọi kim loại cần tìm là M
Vậy = 1,2 : 0,03 = 40. Do đó M là Ca.
Câu 20:
Oxit cao nhất cuả nguyên tố R là , trong hợp chất khí của R với hiđro có 25% hiđro về khối lượng. R là
 Xem đáp án
Xem đáp án
Đáp án A
Oxit cao nhất của R là nên R thuộc nhóm IVA. Công thức hợp chất khí của R là .
→ = 12. Vậy R là C.
Câu 21:
E là một nguyên tố có công thức hợp chất khí với H và oxit có hóa trị cao nhất của E lần lượt là: EHa và có 2a + 3b = 21. % khối lượng của O trong hiđroxit có hóa trị cao nhất của E là 65,306%. Nguyên tố E là
 Xem đáp án
Xem đáp án
Đáp án B
Từ công thức oxit cao nhất và công thức hợp chất khí với H ta có: a + b = 8.
Theo bài ra: 2a + 3b = 21
→ a = 3 và b = 5.
Vậy E thuộc nhóm VA.
Trường hợp 1: Công thức hiđroxit tương ứng của E là:
![]()
![]()
Trường hợp 2: Công thức hiđroxit tương ứng là
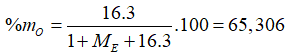
![]()
Câu 22:
Cho 8,5 gam hỗn hợp hai kim loại A, B thuộc hai chu kì liên tiếp ở nhóm IA vào nước thu được 3,36 lít khí H2. Hai kim loại A và B là
 Xem đáp án
Xem đáp án
Đáp án B
Đặt hai kim loại tương ứng với một kim loại là M
(giả sử → )
= 8,5 : 0,3 = 28,33. Vậy hai kim loại là Na (M = 23) và K (M = 39).
Câu 24:
Tổng số electron trong ion là:
 Xem đáp án
Xem đáp án
Đáp án D
Trong nguyên tử Cl, số e = số p = z = 17.
Ta có: Cl + 1e → Cl-
Vậy số electron của Cl- là 17 + 1 = 18.
Câu 25:
Trong bảng tuần hoàn, nguyên tố có tính phi kim mạnh nhất là
 Xem đáp án
Xem đáp án
Đáp án B
Phi kim mạnh nhất là Flo (F).
Câu 26:
Cation có cấu hình electron . Vậy M là nguyên tố:
 Xem đáp án
Xem đáp án
Đáp án C
M → + 1e
Vậy cấu hình e của M là . Do đó M ở chu kỳ 3, nhóm IA.
Câu 27:
Trong số các nguyên tử sau, chọn nguyên tử có số nơtron nhỏ nhất.
 Xem đáp án
Xem đáp án
Đáp án A
A: số n = 235 – 92 = 143
B: số n = 239 – 93 = 146
C: số n = 239 – 94 = 145.
D: số n = 243 – 95 = 148.
Câu 28:
Cho biết nguyên tố A ở chu kì 3, nhóm VIIA. Cấu hình electron của A là
 Xem đáp án
Xem đáp án
Đáp án A
A ở chu kỳ 3 nên có 3 lớp electron; A thuộc nhóm VIIA nên số electron lớp ngoài cùng là 7.
Cấu hình electron của A là
Câu 29:
Tính chất nào sau đây không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân?
 Xem đáp án
Xem đáp án
Đáp án C
Câu 30:
Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X, Y lần lượt là
 Xem đáp án
Xem đáp án
Đáp án C
Ta có cấu hình electron của Y là → Y là kim loại.
Cấu hình electron của X là → X là phi kim.