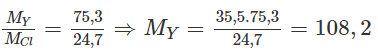Giải SBT Hóa học 10 Bài 22: Clo
-
54 lượt thi
-
16 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
PTHH nào sau đây biểu diễn đúng phản ứng của dây sắt nóng đỏ cháy trong khí
A. Fe + → Fe
B. 2Fe + 3Cl → 2Fe
C. 3Fe + 4 → Fe + 2Fe
D. Fe + → FeCl + Cl
 Xem đáp án
Xem đáp án
Đáp án B
Câu 2:
Lá đồng khi đốt nóng có thể cháy sáng trong khí A.
A là khí nào trong số các khí sau ?
A. CO B.
C. . D.
 Xem đáp án
Xem đáp án
Đáp án B
Câu 3:
Trong phản ứng : + → HCl + HClO phát biểu nào sau đây đúng ?
A. Clo chỉ đóng vai trò chất oxi hoá.
B. Clo chỉ đóng vai trò chất khử.
C. Clo vừa đóng vai trò chất oxi hoá, vừa đóng vai trò chất khử.
D. Nước đóng vai trò chất khử.
 Xem đáp án
Xem đáp án
Đáp án C
Câu 4:
Trong các phản ứng hóa học, để chuyển thành anion, nguyên tử clo đã
A. nhận thêm 1 electron
B. nhận thêm 1 proton
C. nhương đi 1 electron
D. nhường đi 1 nơtron
 Xem đáp án
Xem đáp án
Đáp án A
Câu 5:
Trong phòng thí nghiệm khí clo thường được điểu chế bằng cách oxi hóa hợp chất nào sau đây
A. NaCl B. HCl
C. KCl D. KMn
 Xem đáp án
Xem đáp án
Đáp án B
Câu 7:
Khối lượng đủ để tác dụng với kim loại nhôm tạo thành 26,7g Al là
A. 23,1g B. 21,3g
C. 12,3g D. 13,2g
 Xem đáp án
Xem đáp án
Đáp án B
Câu 8:
Số mol thu được khi cho 0,2 mol KCl tác dụng với dung dịch HCl đặc, dư là
A. 0,3 B. 0,4
C. 0,5 D. 0,6
 Xem đáp án
Xem đáp án
Đáp án D
Câu 9:
Khí điều chế bằng cách cho Mn tác dụng với dung dịch HCl đặc thường bị lẫn tạp chất là khí HCl. Có thể dùng dung dịch nào sau đây để loại tạp chất là tốt nhất
A. Dung dịch NaOH
B. Dung dịch AgN
C. Dung dịch NaCl
D. Dung dịch KMn
 Xem đáp án
Xem đáp án
Đáp án D
Câu 10:
Phản ứng nào sau đây được dùng để điều chế clo trong phòng thí nghiệm
A. 2NaCl → 2Na +
B. 2NaCl + 2O → + 2NaOH +
C. Mn + 4HCl → Mn + + O
D. + 2NaCl → 2NaF +
 Xem đáp án
Xem đáp án
Đáp án C
Câu 11:
Hỗn hợp nào sau đây có thể tồn tại ở bất kì điều kiện nào
A. và B. và
C. và D. và
 Xem đáp án
Xem đáp án
Đáp án C
Câu 12:
Phản ứng nào xảy ra khi sục khí clo vào dung dịch
 Xem đáp án
Xem đáp án
+ Khí clo tác dụng với nước tạo ra các axit :
+ O → HCl + HClO
+ Axit mạnh (HCl) tác dụng với muối :
2HCl + → 2NaCl + O + C
Câu 13:
Dẫn khí vào. Dung dịch KOH ở nhiệt độ thường.
Hãy viết PTHH của phản ứng xảy ra trong mỗi trường hợp. Cho biết vai trò của clo trong mỗi phản ứng oxi hoá - khử đó
 Xem đáp án
Xem đáp án
3 + 2KOH → KCl + KClO + 3O
Trong các phản ứng trên, clo vừa là chất oxi hoá, vừa là chất khử. Đó là các phản ứng tự oxi hoá, tự khử (hay còn gọi là phản ứng tự oxi hoá - khử).
Câu 14:
Dẫn khí vào. Dung dịch KOH đun nóng tới gần 100C.
Hãy viết PTHH của phản ứng xảy ra trong mỗi trường hợp. Cho biết vai trò của clo trong mỗi phản ứng oxi hoá - khử đó
 Xem đáp án
Xem đáp án
3KCl + 6KOH → 5KCl + KCl + 4O
Trong các phản ứng trên, clo vừa là chất oxi hoá, vừa là chất khử. Đó là các phản ứng tự oxi hoá, tự khử (hay còn gọi là phản ứng tự oxi hoá - khử).
Câu 15:
Nêu nguyên tắc của việc điều chế khí Cl2 trong phòng thí nghiệm. Viết PTHH của 5 phản ứng minh hoạ.
 Xem đáp án
Xem đáp án
Cho chất oxi hoá mạnh tác dụng với dung dịch HCl đặc (từng chất oxi hoá mạnh để oxi hoá ion clorua thành đơn chất clo).
Mn + 4HCl → Mn + + 2O
2KMn + 16HCl → 2KCl + 2Mn + 5 + 8O
KCl + 6HCl → KCl + 3 + 3O
CaO + 2HCl → Ca + + O
+ 14HCl → 2KCl + 2Cr + 3 + 7O
Câu 16:
Cho 2 nguyên tố X và Y thuộc hai chu kì liên tiếp () và cùng số thứ tự của nhóm trong bảng tuần hoàn (nhóm A và nhóm B).
- Nguyên tố X tạo thành hợp chất ion với clo ứng với công thức XC1.
- Nguyên tố Y cũng tạo thành hợp chất với clo hợp chất YC1 trong đó khối lượng của clo chiếm 24,7%.
Xác định các nguyên tố X và Y.
 Xem đáp án
Xem đáp án
X tạo bởi chất ion với clo có công thức là XC1, vậy X là kim loại có hoá trị I.
Y cùng số nhóm với X vậy cũng có hoá trị I, công thức clorua của nó là YC1.
Ta có:
( và lần lượt là NTK của nguyên tố Y và nguyên tố clo). Đó là Ag. Nguyên tố X cùng chu kì, cùng số thứ tự nhóm với Ag là kali (K))