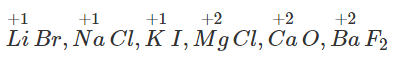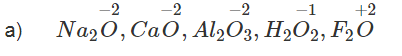Giải SBT Bài 16: Luyện tập: Liên kết hóa học
-
913 lượt thi
-
20 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 3:
Cho các chất và ion : Mn, MnO, MnCl4, MnO4- Số oxi hoá của Mn trong các chất và ion trên lần lượt là?
 Xem đáp án
Xem đáp án
Đáp án B
Câu 6:
Trong dãy oxit : Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7. Những oxit có liên kết ion là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 7:
Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np4. Trong hợp chất khí của nguyên tố X với hiđro, X chiếm 94,12% khối lượng. Phần trăm khối lượng của X trong oxit cao nhất là
 Xem đáp án
Xem đáp án
Đáp án D
Câu 8:
Hợp chất khí với hiđro của nguyên tố R có công thức tổng quát là RH4, oxit cao nhất của nguyên tố này chứa 53,3% oxi về khối lượng. Nguyên tố R là
 Xem đáp án
Xem đáp án
Đáp án D
Câu 10:
Hãy tính số oxi hoá của crom (Cr) trong hợp chất K2Cr2O7
 Xem đáp án
Xem đáp án
Gọi x là số oxi hoá của Cr. Vì trong một phân tử trung hoà, tổng đại số các số oxi hoá của các nguyên tử bằng không nên ta có :
2.(+1) + 2.X + 7.(-2) = 0
2x = +14 - 2 = +12
x = +6
Vậy số oxi hoá của Cr trong K2Cr2O7 bằng +6.
Câu 11:
Hãy tính số oxi hoá của lưu huỳnh (S) trong hợp chất H2SO4
 Xem đáp án
Xem đáp án
Gọi x là số oxi hoá của S, ta có :
2.(+l) + x + 4.(-2) = 0
x = +8 - 2 = +6
Số oxi hoá của s trong H2SO4 là +6
Câu 12:
Hãy cho biết sự khác nhau về liên kết hoá học trong các tinh thể ion, tinh thể nguyên tử và tinh thể phân tử
 Xem đáp án
Xem đáp án
Trong tinh thể ion, liên kết giữa các ion là liên kết ion.
Trong tinh thể nguyên tử, liên kết giữa các nguyên tử là liên kết cộng hoá trị.
Trong tinh thể phân tử, liên kết giữa các phân tử là tương tác yếu, được gọi là tương tác giữa các phân tử.
Câu 13:
Hãy cho biết sự khác nhau về các cấu tử (các hạt tạo nên tinh thể) trong tinh thể ion, tinh thể nguyên tử, tinh thể phân tử.
 Xem đáp án
Xem đáp án
Trong tinh thể ion, các cấu tử là các ion âm và dương. Trong tinh thể nguyên tử, các cấu tử là các nguyên tử. Trong tinh thể phân tử, các cấu từ là các phân tử.Trong tinh thể ion, các cấu tử là các ion âm và dương. Trong tinh thể nguyên tử, các cấu tử là các nguyên tử. Trong tinh thể phân tử, các cấu từ là các phân tử.
Câu 14:
Hãy cho biết sự khác nhau về tính chất giữa tinh thể nguyên tử và tinh thể phân tử.
 Xem đáp án
Xem đáp án
Liên kết giữa các nguyên tử trong tinh thể nguyên tử là liên kết cộng hoá trị rất mạnh. Vì vậy, các nguyên tử liên kết với nhau một cách chặt chẽ, do đó tinh thể nguyên tử Liên kết giữa các nguyên tử trong tinh thể nguyên tử là liên kết cộng hoá trị rất mạnh. Vì vậy, các nguyên tử liên kết với nhau một cách chặt chẽ, do đó tinh thể nguyên tử rất bền, rất cứng, nhiệt độ nóng chảy và nhiệt độ sôi cao. Trong tinh thể phân tử, các phân tử vẫn tồn tại như những đơn vị độc lập và hút nhau bằng lực tương tác yếu giữa các phân tử. Vì vậy, các tinh thể phân tử dễ nóng chảy, dễ bay hơi. Các tinh thể nguyên tử rất khó hoà tan trong các dung môi khác nhau. Các tinh thể phân tử cấu tạo từ các phân tử không phân cực dễ hoà tan trong các dung môi không phân cực. Các tinh thể phân tử cấu tạo từ các phân tử phân cực dễ hoà tan trong các dung môi phân cực.rất bền, rất cứng, nhiệt độ nóng chảy và nhiệt độ sôi cao. Trong tinh thể phân tử, các phân tử vẫn tồn tại như những đơn vị độc lập và hút nhau bằng lực tương tác yếu giữa các phân tử. Vì vậy, các tinh thể phân tử dễ nóng chảy, dễ bay hơi. Các tinh thể nguyên tử rất khó hoà tan trong các dung môi khác nhau. Các tinh thể phân tử cấu tạo từ các phân tử không phân cực dễ hoà tan trong các dung môi không phân cực. Các tinh thể phân tử cấu tạo từ các phân tử phân cực dễ hoà tan trong các dung môi phân cực.
Câu 15:
Hãy viết công thức cấu tạo của các phân tử : N2, CH4, NH3, H2O
Dựa vào quy tắc biến thiên độ âm điện của các nguyên tố trong một chu kì, hãy cho biết trong các phân tử nói trên, phân tử nào có liên kết không phân cực, phân tử nào có liên kết phân cực mạnh nhất.
 Xem đáp án
Xem đáp án
Các liên kết trong phân tử N2 là các liên kết cộng hoá trị điển hình, không phân cực vì đó là những liên kết giữa hai nguyên tử giống nhau (hiệu độ im điện bằng không).
Các liên kết trong các phân tử còn lại là các liên kết giữa các nguyên tử trong cùng một chu kì (C, N, O) và nguyên tử H (độ âm điện bằng 2,20). ri trong cùng một chu kì, độ âm điện tăng dần từ trái sang phải nên so với H, hiệu độ âm điện cũng tăng theo, do đó các liên kết trong phân tử H2O là các liên kết phân cực mạnh nhất.
Câu 16:
Cho dãy oxit sau đây :
Na2O, MgO, Al2O3, SiO2, P2O5, SO2, Cl2O7
Biết rằng độ âm điện của các nguyên tố :
Na, Mg, A1, Si, P, S, Cl, O Lần lượt bằng : 0,93 ; 1,31; 1,61; 1,90; 2,19; 2,58; 3,16; 3,44.
Hãy dự đoán trong các oxit đó thì liên kết trong các oxit nào là liên kết ion, liên kết cộng hoá trị có cực, liên kết cộng hoá trị không cực ?
 Xem đáp án
Xem đáp án
Liên kết trong các oxit đó là liên kết giữa oxi và các nguyên tố thuộc chu kì 3.
Căn cứ vào hiệu độ âm điện, có thể dự đoán liên kết trong các oxit : Na2O, MgO, Al2O3 là liên kết ion, liên kết trong các oxit : SiO2, P2O5, SO3 à các liên kết cộng hoá trị có cực, liên kết trong oxit Cl2O7 là liên kết cộng hoá trị không cực
Câu 18:
a) Hãy cho biết số oxi hoá của o trong các hợp chất : Na2O, CaO, Al2O3, H2O2, F2O.
b) Hãy cho biết trong trường hợp nào thì oxi có số oxi hoá bằng -2, bằng -1, bằng +2.
 Xem đáp án
Xem đáp án
b) Oxi có số oxi hoá bằng :
-1 trong các peoxit, thí dụ H - O - O - H (H2O2)
+ 2 khi kết hợp với flo (F), vì oxi có độ âm điện (3,44) nhỏ hơn độ âm điện của flo (3,98).
-2 trong các trường hợp khác.
Câu 19:
Các cation R+, Y2+ và anion X- đều có cấu hình electron lớp ngoài cùng là 3s23p6 . Xác định vị trí của R, Y, X trong bảng tuần hoàn.
 Xem đáp án
Xem đáp án
R+: 3s23p6 → R: 1s22s2p63s23p64s1: STT = 19 (K), chu kỳ 4 nhóm IA
Y2+: 3s23p6 → R: 1s22s2p63s23p64s2: STT = 20 (Ca), chu kỳ 4 nhóm IIA
X-: 3s23p6 → R: 1s22s2p63s23p5: STT = 17 (Cl), chu kỳ 3 nhóm VIIA