Trắc nghiệm Hóa 10 Dạng 2. Tính tốc độ trung bình của phản ứng có đáp án
-
1738 lượt thi
-
17 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
Cho phản ứng phân hủy N2O5 như sau:
2N2O5(g) → 4NO2 (g) + O2 (g)
Tại thời điểm ban đầu, nồng độ của N2O5 là 0,02M; Sau 100s, nồng độ N2O5 còn 0,0169M. Tốc độ trung bình của phản ứng phân hủy N2O5 trong 100 s đầu tiên là
Câu 2:
Phản ứng của H2 với I2 là phản ứng đơn giản:
H2(g) + I2(g) → 2HI(g)
Nếu nồng độ của I2 tăng gấp đôi, thì
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Theo định luật tác dụng khối lượng, tốc độ phản ứng được viết dưới dạng:
\[\upsilon = k{C_{{H_2}}}{C_{{I_2}}}\]
Khi nồng độ của I2 tăng gấp đôi thì: \[{\upsilon ^'} = k{C_{{H_2}}}2{C_{{I_2}}} = 2k{C_{{H_2}}}{C_{{I_2}}} = 2\upsilon \].
Vậy tốc độ phản ứng tăng 2 lần.
Câu 3:
Cho phản ứng \[3{O_2}(g) \to 2{O_3}(g)\]
Ban đầu nồng độ oxygen là 0,024M. Sau 5s thì nồng độ của oxygen là 0,02M. Tốc độ trung bình của phản ứng trên trong 5s đầu tiên là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Tốc độ trung bình của phản ứng trên tính theo oxygen:
\[\bar v = - \frac{1}{3}\frac{{\Delta {C_{{O_2}}}}}{{\Delta t}} = - \frac{1}{3} \times \frac{{0,02 - 0,024}}{{5 - 0}} = {\rm{ 2,67}}.{\rm{1}}{{\rm{0}}^{ - 4}}{\rm{ (M}}\,{{\rm{s}}^{ - 1}})\]
Câu 4:
Cho phản ứng phân hủy N2O5 như sau:
2N2O5 (g) → 4NO2 (g) + O2 (g)
Nồng độ ban đầu của NO2 là 0 M, sau 100 s là 0,0062 M. Tốc độ trung bình của phản ứng trong 100 s đầu tiên là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Tốc độ trung bình của phản ứng trong 100s đầu tiên là:
\[\overline \upsilon = \frac{1}{4}.\frac{{\Delta {C_{N{O_2}}}}}{{\Delta t}} = \frac{1}{4}.\frac{{(0,0062 - 0)}}{{100 - 0}} = 1,{55.10^{ - 5}}(M{s^{ - 1}})\]
Câu 5:
Hydrogen peroxide phân hủy theo phản ứng sau:
2H2O2 → 2H2O + O2
Tại thời điểm ban đầu, thể tích khí oxygen là 0 cm3, sau thời gian 15 phút thể tích khí oxygen là 16 cm3. Tốc độ trung bình của phản ứng trong 15 phút đầu tiên là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Tốc độ trung bình của phản ứng trong 15 phút đầu tiên là
\[\overline \upsilon = \frac{{\Delta {C_{{O_2}}}}}{{\Delta t}} = \frac{{(16 - 0)}}{{(15 - 0)}}\]≈ 1,067 cm3 phút-1.
Câu 6:
Cho phản ứng hóa học sau:
Mg (s) + 2HCl (aq) → MgCl2 (aq) + H2 (g)
Sau 40 giây, nồng độ của dung dịch HCl giảm tử 0,6 M về còn 0,4 M. Tốc độ trung bình của phản ứng theo HCl trong 40 giây là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Tốc độ trung bình của phản ứng theo HCl trong 40 giây là:
\[\overline v = - \frac{1}{2}\frac{{\Delta {C_{HCl}}}}{{\Delta t}} = - \frac{1}{2}.\frac{{(0,4 - 0,6)}}{{40}} = 2,5 \times {10^{ - 3}}(M/s)\]
Câu 7:
Cho phản ứng đơn giản sau (xảy ra trong bình kín):
2NO (g) + O2 (g) → 2NO2 (g)
Ở nhiệt độ không đổi, nồng độ NO tăng hai lần, nồng độ O2 không đổi thì
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Theo định luật tác dụng khối lượng, tốc độ của phản ứng được viết dưới dạng:
\[v = kC_{NO}^2{C_{{O_2}}}\]
Khi nồng độ NO tăng hai lần, nồng độ O2 không đổi thì:
\[v' = k{(2{C_{NO}})^2}{C_{{O_2}}} = 4kC_{NO}^2{C_{{O_2}}} = 4v\]
Hay tốc độ phản ứng tăng 4 lần.
Câu 8:
Cho phương trình hóa học sau: CHCl3 (g) + Cl2 (g) → CCl4 (g) + HCl (g). Khi nồng độ của CHCl3 giảm 2 lần, nồng độ Cl2 giữ nguyên thì tốc độ phản ứng sẽ
 Xem đáp án
Xem đáp án
Đáp án đúng là: B.
Theo định luật tác dụng khối lượng, tốc độ phản ứng được viết dưới dạng:
\[\upsilon {\rm{ }} = k.{C_{CHC{l_3}}}.{C_{C{l_2}}}\]
Khi nồng độ của CHCl3 giảm 2 lần, nồng độ Cl2 giữ nguyên ta có:
\[\upsilon '{\rm{ }} = k.\frac{{{C_{CHC{l_3}}}}}{2}.{C_{C{l_2}}} = \frac{\upsilon }{2}\]
Vậy khi nồng độ của CHCl3 giảm 2 lần, nồng độ Cl2 giữ nguyên thì tốc độ phản ứng sẽ giảm đi một nửa.
Câu 9:
Cho phản ứng hóa học sau:
2SO2 (g) + O2 (g) → 2SO3 (g)
Trong khoảng thời gian 420 giây, nồng độ SO2 giảm từ 0,027 M xuống 0,0194 M. Tốc độ trung bình của phản ứng tính theo nồng độ SO2 trong khoảng thời gian trên là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Tốc độ trung bình của phản ứng tính theo nồng độ SO2 trong 420 giây là:
\(\overline v = - \frac{1}{2} \times \frac{{\Delta {C_{S{O_2}}}}}{{\Delta t}} = - \frac{1}{2} \times \frac{{(0,0194 - 0,0270)}}{{420}} \approx 9 \times {10^{ - 6}}(M/s)\)
Câu 10:
Cho phản ứng xảy ra như sau:
H2 (g) + Cl2 (g) → 2HCl (g)
Công thức đúng để xác định tốc độ trung bình của phản ứng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
H2 (g) + Cl2 (g) → 2HCl (g)
Biểu thức tốc độ trung bình của phản ứng là
\(\overline v = \frac{{ - \Delta {C_{{H_2}}}}}{{\Delta t}} = \frac{{ - \Delta {C_{C{l_2}}}}}{{\Delta t}} = \frac{{\Delta {C_{HCl}}}}{{2\Delta t}}\)
Câu 11:
Phản ứng 3H2 (g) + N2 (g) → 2NH3 (g) có tốc độ mất đi của H2 so với tốc độ hình thành NH3 là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Tốc độ phản ứng bằng \[\frac{1}{3}\] tốc độ mất đi của H2 và bằng \[\frac{1}{2}\] tốc độ hình thành của NH3.
\[\overline v = \frac{1}{3}{v_{{H_2}}} = \frac{1}{2}{v_{N{H_3}}} \Rightarrow {v_{{H_2}}} = \frac{3}{2}{v_{N{H_3}}}\]
Câu 12:
Thiết bị sau có thể được sử dụng để đo tốc độ phản ứng của một số phản ứng hóa học:
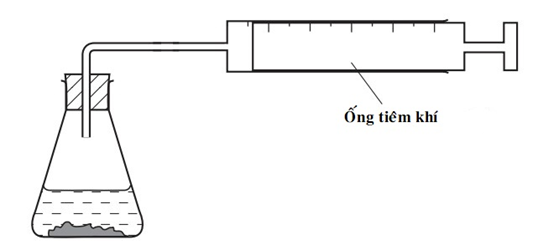
Cho các phản ứng sau:
(1) AgNO3(aq) + HCl(aq) → AgCl(s) + HNO3(aq)
(2) 2H2O2(aq) 2H2O(l) + O2(g)
(3) MgO(s) + 2HCl (aq) → MgCl2(aq) + H2O(l)
(4) ZnCO3(s) + 2HCl (aq) → ZnCl 2(aq) + CO2(g) + H2O(l)
Hai phản ứng phù hợp với thiết bị trên là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Thiết bị này được sử dụng để đo tốc độ của một số phản ứng hóa học có sản phẩm thu được là chất khí nên phản ứng số (2) và (4) thỏa mãn thiết bị trên.
(2) 2H2O2(aq) 2H2O(l) + O2(g)
(4) ZnCO3(s) + 2HCl (aq) → ZnCl 2(aq) + CO2(g) + H2O(l)
Câu 13:
Đối với phản ứng tổng quát: aA + bB ® cC + dD
Gọi DCA, DCB, DCC, DCD lần lượt là biến thiên lượng chất các chất A, B, C, D trong khoảng thời gian Dt. Tốc độ trung bình của phản ứng được tính theo biểu thức là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Đối với phản ứng tổng quát: aA + bB ® cC + dD
Gọi DCA, DCB, DCC, DCD lần lượt là biến thiên lượng chất các chất A, B, C, D trong khoảng thời gian Dt. Tốc độ trung bình của phản ứng được tính theo biểu thức:
\[{v_{tb}} = - \frac{1}{a} \cdot \frac{{\Delta {C_A}}}{{\Delta t}} = - \frac{1}{b} \cdot \frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{c} \cdot \frac{{\Delta {C_C}}}{{\Delta t}} = \frac{1}{d} \cdot \frac{{\Delta {C_D}}}{{\Delta t}}\]
Câu 14:
Xét phản ứng đơn giản sau: 2NO (g) + O2 (g) ® 2NO (g).
Mối liên hệ giữa tốc độ phản ứng và nồng độ các chất tham gia phản ứng được thể hiện bằng biểu thức:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Xét phản ứng: 2NO (g) + O2 (g) ® 2NO (g).
Mối liên hệ giữa tốc độ phản ứng và nồng độ các chất tham gia phản ứng được biểu diễn bằng biểu thức: \[v = k \cdot C_{NO}^2 \cdot {C_{{O_2}}}\].
Câu 15:
Đâu là đơn vị tốc độ phản ứng ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Đơn vị tốc độ phản ứng là: (đơn vị nồng độ) (đơn vị thời gian)−1
Ví dụ: mol L−1 s−1; M s−1.
Câu 16:
Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Tốc độ phản ứng chỉ nhận giá trị dương, do đó phải thêm dấu trừ trong biểu thức tính tốc độ trung bình của phản ứng theo các chất tham gia phản ứng.
Câu 17:
Cho phản ứng đơn giản xảy ra trong bình kín: 3H2(g) + N2 (g) ⟶ 2NH3 (g).
Tốc độ phản ứng thay đổi như thế nào nếu nồng độ H2 và N2 đều tăng 2 lần?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Theo định luật tác dụng khối lượng: \(v = kC_{{H_2}}^3C_{{N_2}}^{}\)
Nếu nồng độ H2 và N2 đều tăng lên 2 lần, ta có:
\(v' = k{\left( {2.C_{{H_2}}^{}} \right)^3}\left( {2.C_{{N_2}}^{}} \right) = 16 \cdot kC_{{H_2}}^3C_{{N_2}}^{} = 16v.\)
Vậy tốc độ phản ứng tăng 16 lần.
