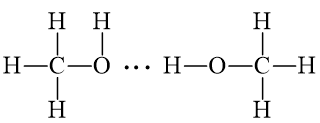Bài tập Ôn tập chương 3 có đáp án
-
157 lượt thi
-
7 câu hỏi
-
15 phút
Danh sách câu hỏi
Câu 1:
Hoàn thành sơ đồ hệ thống hóa kiến thức trang 68 Hóa học 10:
 Xem đáp án
Xem đáp án
Liên kết hóa học gồm:
- Liên kết cộng hóa trị
+ Khái niệm: là liên kết hóa học được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
+ Kiểu liên kết: không phân cực, phân cực và cho nhận.
• Không phân cực: cặp electron dùng chung nằm chính giữa hai nguyên tử.
Ví dụ: Cl2, Br2, …
• Có phân cực: cặp electron dùng chung lệch về nguyên tử có độ âm điện lớn hơn.
Ví dụ: H2O, CO, NH3, …
• Cho nhận: cặp electron dùng chung là do một nguyên tử đóng góp.
Ví dụ: SO2, HNO3, …
- Liên kết ion
+ Khái niệm: là liên kết hóa học được hình thành giữa hai ion mang điện tích trái dấu (tồn tại trong khối tinh thể)
Ví dụ: NaCl, NaF, CaCl2, …
+ Tinh thể ion: Các ion âm và dương sắp xếp tại các nút của mạng tinh thể theo trật tự luân phiên, liên kết bằng lực hút tĩnh điện của chúng.

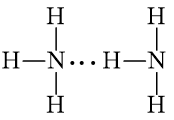
- Liên kết hydrogen và tương tác van der waals
+ Khái niệm: đều là liên kết giữa các phân tử (hay nguyên tử) trung hòa hút nhau bởi bản chất tĩnh điện giữa các lưỡng cực δ+ và δ-.
+ Liên kết hydrogen:
+ Tương tác Van der waals:
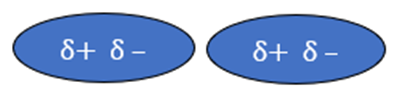
+ Ảnh hưởng: đều làm tăng nhiệt độ sôi, nhiệt độ nóng chảy của các chất.
Câu 2:
Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết ion?
 Xem đáp án
Xem đáp án
Đáp án B
Các hợp chất ion thường được tạo bởi các kim loại điển hình (IA, IIA) với phi kim điển hình (O, VIIA).
⇒ Na2O, KCl, BaCl2, Al2O3 là các hợp chất ion.
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án D
Liên kết cộng hóa trị không phân cực là loại liên kết trong các đơn chất.
Câu 4:
Viết công thức cấu tạo và công thức Lewis của các phân tử sau PH3, H2O, C2H6. Trong phân tử nào có liên kết phân cực mạnh nhất.
 Xem đáp án
Xem đáp án
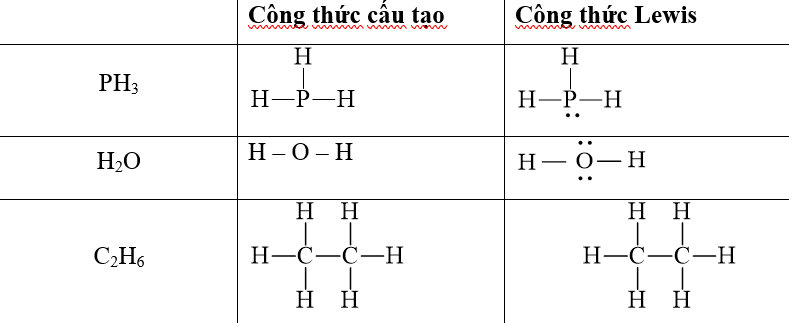
- Các nguyên tử O, P, N đều tạo liên kết phân cực với H, trong đó nguyên tử O có độ âm điện lớn hơn cả nên liên kết O – H sẽ phân cực nhất.
⇒ Phân tử H2O có liên kết phân cực mạnh nhất.
Câu 5:
Dựa vào giá trị đó âm điện của các nguyên tử trong Bảng 6.2, xác định loại liên kết trong phân tử các chất CH4, CaCl2, HBr, NH3.
 Xem đáp án
Xem đáp án
Trong phân tử CH4, hiệu độ âm điện của C và H: 2,55 – 2,2 = 0,35
⇒ Liên kết giữa C và H là liên kết cộng hóa trị không phân cực.
Trong phân tử CaCl2, hiệu độ âm điện của Ca và Cl: 3,16 – 1 = 2,16
⇒ Liên kết giữa Ca và Cl là liên kết ion.
Trong phân tử HBr, hiệu độ âm điện của H và Br: 2,96 – 2,2 = 0,76
⇒ Liên kết giữa H và Br là liên kết cộng hóa trị phân cực.
Trong phân tử NH3, hiệu độ âm điện của N và H: 3,04 – 2,2 = 0,84
⇒ Liên kết giữa N và H là liên kết cộng hóa trị phân cực.
Câu 6:
Cho dãy các oxide sau Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7.
a) Độ phân cực của các liên kết trong dãy các oxide trên thay đổi thế nào?
b) Dựa vào giá trị độ âm điện của các nguyên tố trong Bảng 6.2, cho biết loại liên kết (ion, cộng hoá trị phân cực, cộng hóa trị không phân cực) trong từng phân tử oxide.
 Xem đáp án
Xem đáp án
a) Liên kết M – O (M: nguyên tố chu kì 3, trừ Ar) trong oxide có độ phân cực tăng dần.
b) Hiệu độ âm điện của nguyên tố kim loại với oxi là:
Na2O: 2,51 ⇒ Liên kết giữa Na và O là liên kết ion.
MgO: 2,13 ⇒ Liên kết giữa Mg và O là liên kết ion.
Al2O3: 1,83 ⇒ Liên kết giữa Al và O là liên kết ion.
SiO2: 1,54 ⇒ Liên kết giữa Si và O là liên kết cộng hóa trị có cực
P2O5: 1,25 ⇒ Liên kết giữa P và O là liên kết cộng hóa trị có cực
SO3: 0,86 ⇒ Liên kết giữa S và O là liên kết cộng hóa trị có cực
Cl2O7: 0,28 ⇒ Liên kết giữa Cl và O là liên kết cộng hóa trị không cực
Câu 7:
a) Cho dãy các phân tử C2H6, CH3OH, NH3. Phân tử nào trong dãy có thể tạo liên kết hydrogen? Vì sao?
b) Vẽ sơ đồ biểu diễn liên kết hydrogen giữa các phân tử đó.
 Xem đáp án
Xem đáp án
a) Phân tử CH3OH và NH3 có thể tạo liên kết hydrogen vì nguyên tử N, O đều có cặp electron chưa tham gia liên kết và có liên kết với nguyên tử hydrogen.
b)