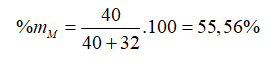Đề thi Hóa học 10 Giữa học kì 1 biên soạn (Đề 2)
-
1164 lượt thi
-
30 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Cho nguyên tố X, nguyên tử của nó có cấu hình electron là: . X thuộc nguyên tố
 Xem đáp án
Xem đáp án
Đáp án C
Theo trật tự phân mức năng lượng, electron cuối cùng được điền vào phân lớp d.
X thuộc nguyên tố d.
Câu 3:
Các electron của nguyên tử nguyên tố R được phân bố trên 4 lớp, lớp ngoài cùng có 2 electron, số phân lớp có chứa electron của R là 6. Số đơn vị điện tích hạt nhân nguyên tử của nguyên tố R có thể là giá trị nào
 Xem đáp án
Xem đáp án
Đáp án D
Cấu hình electron của R là:
→ Số đơn vị điện tích hạt nhân của R bằng số electron = 20.
Câu 4:
Nguyên tử của nguyên tố A có tổng số electron ở các phân lớp p là 9. Nguyên tố A là
 Xem đáp án
Xem đáp án
Đáp án A
Cấu hình electron nguyên tử A là: → A là P.
Câu 6:
Cation có cấu hình electron ở phân lớp ngoài cùng là . Kết luận sai là
 Xem đáp án
Xem đáp án
Đáp án C
Cấu hình electron của ion là
→ Cấu hình electron của X là: 1s22s22p63s1
X có 1 electron lớp ngoài cùng nên là nguyên tử của nguyên tố kim loại.
Câu 7:
Nguyên tử M có 7 electron ở phân lớp 3d. Số hạt mang điện của nguyên tử M là
 Xem đáp án
Xem đáp án
Đáp án B
Cấu hình electron nguyên tử M là:
→Trong M, Số electron = số proton = 27.
Số hạt mang điện của M là 27.2 = 54.
Câu 8:
Các phân lớp có trong lớp M là
 Xem đáp án
Xem đáp án
Đáp án A
Lớp M là lớp thứ 3. Các phân lớp có trong lớp thứ 3 là: 3s; 3p; 3d.
Câu 9:
Khối lượng riêng của kim loại canxi là 1,55 g/. Khối lượng mol của nguyên tử canxi là 40 g/mol. Trong tinh thể canxi, các nguyên tử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng. Bán kính nguyên tử canxi tính theo lí thuyết là
 Xem đáp án
Xem đáp án
Đáp án A
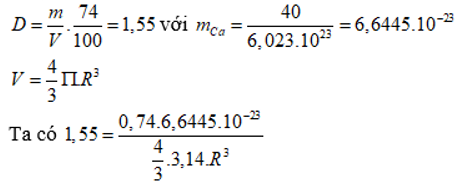
→ R = 1,96.10-8 (cm) = 0,196nm.
Câu 11:
Tổng số hạt của nguyên tử X là 155. Số hạt mang điện nhiều hơn số hạt không mang điện là 33. Số khối của nguyên tử X là
 Xem đáp án
Xem đáp án
Đáp án D
Gọi số hạt proton, nơtron và electron trong X lần lượt là: p, n và e.
Theo bài ra ta có:
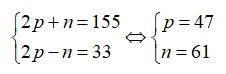
Số khối của X là 47 + 61 = 108.
Câu 12:
Trong nguyên tử có số hạt mang điện nhiều hơn số hạt không mang điện là
 Xem đáp án
Xem đáp án
Đáp án D
Số hạt mang điện trong Al = số p + số e = 2z = 13.2 =26.
Số hạt không mang điện trong Al = số nơtron = A – z = 27 – 13 = 14.
Câu 13:
Nguyên tử photpho có 15 proton, 16 nơtron và 15 electron, khối lượng của 1 nguyên tử photpho là
 Xem đáp án
Xem đáp án
Đáp án A
Khối lượng P là 15u + 16u + 15. 0,00055u = 31u.
Câu 14:
Cho nguyên tử . Trong nguyên tử Ca có:
 Xem đáp án
Xem đáp án
Đáp án D
Số p = số e = z = 20.
Số n = A – z = 40 – 20 = 20.
Câu 15:
Trong nguyên tử, loại hạt có khối lượng không đáng kể so với các hạt còn lại là
 Xem đáp án
Xem đáp án
Đáp án D
Câu 16:
Cấu hình electron nào sau đây là của nguyên tố kim loại
 Xem đáp án
Xem đáp án
Đáp án A
Nguyên tử có 1,2,3 electron lớp ngoài cùng là nguyên tử của nguyên tố kim loại trừ H, He, Bo.
A. → 2 e lớp ngoài cùng → là kim loại.
C. → 2 e lớp ngoài cùng, chu kỳ 1 → là khí hiếm He.
Câu 18:
Y là nguyên tố d có 4 lớp electron và có 3 electron ở mức năng lượng cao nhất. Số hiệu nguyên tử của nguyên tố Y là
 Xem đáp án
Xem đáp án
Đáp án C
Cấu hình electron của Y là
→ Số electron của Y là 23 → Số hiệu nguyên tử Y là 23.
Câu 19:
Nguyên tử khối trung bình của Vanadi (V) là 50,94. V có hai đồng vị, trong đó chiếm 6%. Số khối đồng vị thứ hai là
 Xem đáp án
Xem đáp án
Đáp án B
Gọi số khối của đồng vị thứ 2 là x. Ta có:
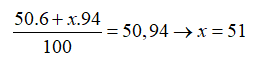
Câu 20:
Số electron tối đa trong lớp 2 là
 Xem đáp án
Xem đáp án
Đáp án A
Số electron tối đa trong lớp th
Số electron tối đa trong lớp 2 là
A. 8 B. 18 C. 32 D. 2
ứ 2 là 2.22 = 8.
Câu 21:
Cho kí hiệu nguyên tử . Phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án C
Từ kí hiệu nguyên tử xác đinh được số khối A = 39, số p = số e = z = 19.
A sai vì số hạt mang điện trong hạt nhân = số p = 19.
B sai vì số hiệu nguyên tử = 19.
C đúng vì cấu hình electron của là → có 3 lớp e.
D sai vì số n = 39 – 19 = 20 hơn số proton là 1.
Câu 22:
Trong các cấu hình electron dưới đây cấu hình không đúng là
 Xem đáp án
Xem đáp án
Đáp án C
Phân lớp 3p chưa bão hòa.
Câu 23:
Một ion có 18 electron và 19 protron mang điện tích là
 Xem đáp án
Xem đáp án
Đáp án B
Ion có số proton lớn hơn số electron nên mang điện tích dương.
Số đơn vị điện tích của ion là 19 – 18 = 1.
Vậy điện tích của ion là .
Câu 24:
Trong tự nhiên, Clo có 2 đồng vị và , trong đó đồng vị chiếm 75% về số đồng vị. Nguyên tử khối trung bình của Cl là
 Xem đáp án
Xem đáp án
Đáp án B
Nguyên tử khối trung bình của Cl là:
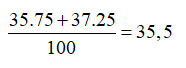
Câu 25:
Có các đồng vị sau . Có thể tạo ra số phân tử hiđroclorua HCl là
 Xem đáp án
Xem đáp án
Đáp án C
Có thể tạo ra các phân tử là:
![]()
Câu 26:
Một nguyên tử M có 96 proton, 151 nơtron. Kí hiệu nguyên tử M là
 Xem đáp án
Xem đáp án
Đáp án A
Số khối của M là A = 96 + 151 = 247.
Số hiệu nguyên tử M là z = số p = 96.
Kí hiệu nguyên tử M là: .
Câu 27:
Cho 3 nguyên tử: . Các nguyên tử nào là đồng vị của nhau?
 Xem đáp án
Xem đáp án
Đáp án B
Y và Z có cùng số p là 12 nên là đồng vị của nhau.
Câu 28:
Argon tách ra từ không khí là hỗn hợp của 3 đồng vị: (99,6%); (0,063%); (0,337%). Nguyên tử khối trung bình của Ar là
 Xem đáp án
Xem đáp án
Đáp án A
Nguyên tử khối trung bình của Ar là:
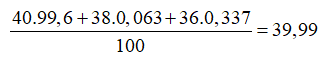
Câu 29:
Tổng số khối của 2 đồng vị X, Y là 72 trong đó có 38 hạt không mang điện. X, Y là các đồng vị của nguyên tố
 Xem đáp án
Xem đáp án
Đáp án A
Gọi số proton và nơtron của X là px và nx; proton và nơtron của Y là py và ny.
Trong đó px = py = p.
Theo bài ra ta có:
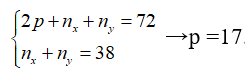
Vậy X và Y là đồng vị của Cl.
Câu 30:
Tổng số hạt (e, p, n) trong phân tử MX là 108 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 36. Số khối của M nhiều hơn số khối của X là 8 đơn vị. Số hạt trong sub> lớn hơn số hạt trong là 8 hạt. % khối lượng của M có trong hợp chất là
 Xem đáp án
Xem đáp án
Đáp án D
Gọi số proton, nơtron và electron tron M lần lượt là , và .
số proton, nơtron và electron tron X lần lượt là , và .
Trong đó = và = .
Có tổng số hạt trong phân tử MX là 108 → 2 + + 2 + = 108 (1)
Trong MX, số hạt mang điện nhiều hơn số hạt không mang điện là 36
→ 2 + 2 – ( + ) = 36 (2)
Từ (1) và (2) có + = 36 và + = 36 (1‘)
Số khối của M nhiều hơn số khối của X là 8 → + – - = 8 (3)
Số hạt trong lớn hơn số hạt trong là 8 hạt
→ 2 + – 2 - (2 + + 2) = 8 → 2 + -2 – = 12 (4)
Từ (3) và (4) có – = 4 và – = 4 (2’)
Từ (1‘) (2’) có = 20 ; = 16; = 20 và = 16.
Coi khối lượng nguyên tử xấp xỉ số khối có:
= 20 + 20 = 40; = 16 + 16 = 32.
% khối lượng của M có trong hợp chất là